Bruk av Autometallography å lokalisere og semi kvantifisere sølv Cetacean vev
Summary
En protokoll presenteres for å lokalisere Ag i cetacean lever og nyre vev av autometallography. Videre, en ny analysen, kalt cetacean histologiske Ag analysen (CHAA) er utviklet for å beregne de Ag konsentrasjonene i de vev.
Abstract
Silver nanopartikler (AgNPs) har vært mye brukt i kommersielle produkter, inkludert tekstiler, kosmetikk og helsevesenet elementer, på grunn av sin sterke antimikrobielle effekter. De kan bli sluppet inn i miljøet og akkumuleres i havet. Derfor AgNPs er den viktigste kilden til Ag forurensning, og offentlig bevissthet om miljømessige toksisitet av Ag er økende. Tidligere studier har vist bioakkumulering (i produsenter) og forstørrelsen (i forbrukerne/rovdyr) AG. Cetaceans, kan som apex predators av havet, ha blitt negativt påvirket av Ag/Ag forbindelser. Men konsentrasjonen av Ag/Ag forbindelser i cetacean vev kan måles ved Induktivt kombinert plasma masse spektroskopi (ICP-MS), er bruk av ICP-MS begrenset av dens høy kapitalkostnad og kravet for tissue lagring/forberedelse. Derfor en autometallography (AMG) metode med en bilde kvantitativ analyse ved hjelp av formalin-fast, parafin-embedded (FFPE)-vev kan være en adjuvant metode for å lokalisere Ag distribusjon på suborgan nivå og beregne Ag konsentrasjonen i cetacean vev. AMG positive signaler er hovedsakelig brune til svarte granulater av ulike størrelser i cytoplasma av proksimale nyre rørformede epitel og hepatocytter Kupffer celler. Noen ganger, noen amorfe gyllengul til brun AMG positive signaler er oppført i lumen og kjelleren membran av noen proksimale nyre tubuli. Analysen for å estimere Ag konsentrasjonen kalles den Cetacean histologiske Ag analysen (CHAA), som er en regresjonsmodell etablert av dataene fra bildet kvantitativ analyse av AMG metode og ICP-MS. Bruk av AMG CHAA å lokalisere og semi kvantifisere tungmetaller gir en praktisk metode for spatio-temporale og cross-species studier.
Introduction
Silver nanopartikler (AgNPs) har vært mye brukt i kommersielle produkter, inkludert tekstiler, kosmetikk og helsevesenet elementer, på grunn av deres store antimikrobielle effekter1,2. Produksjon av AgNPs og antall AgNP inneholder produkter er derfor økt tid3,4. Men AgNPs kan bli sluppet inn i miljøet og akkumuleres i havet5,6. De har blitt den største kilden til Ag forurensning, og offentlige bevisstheten om miljømessige toksisitet av Ag er økende.
Statusen for AgNPs og Ag i det marine miljøet er innviklet og stadig skiftende. Tidligere studier har indikert at AgNPs kan forbli partikler, samlet, oppløse, reagere med ulike kjemiske arter, eller regenereres Ag+ ioner7,8. Flere typer Ag forbindelser, som AgCl, har blitt funnet i marine sedimenter, der de kan svelges av bunnlevende organismer og angi næringskjeden9,10. Ifølge en tidligere studie utført i Chi-ku lagune området langs sørvest kysten av Taiwan, Ag konsentrasjonen av marine sedimenter er svært lav og lik crustal overflod, og de av fisk leveren vev er vanligvis under gjenkjenning begrense (< 0.025 μg/g våt/våt)11. Tidligere studier i ulike land har imidlertid vist relativt høy Ag konsentrasjonene i lever cetaceans12,13. Ag konsentrasjonen i lever av cetaceans er alder-avhengige, antyder at kilden til Ag i kroppen er mest sannsynlig deres byttedyr12. Disse funnene videre foreslå biomagnification AG i dyr på høyere nivåer i næringskjeden. Barder kan som apex rovdyr i havet, ha lidd negative helseeffekter forårsaket av Ag/Ag forbindelser12,13,14. Viktigst, som cetaceans er mennesker pattedyr, og den negative helsemessige konsekvenser forårsaket av Ag/Ag forbindelser i cetaceans kan også forekomme i mennesker. Med andre ord, kunne cetaceans sentinel dyr for helse av marine miljø og mennesker. Derfor er helseeffektene, vev distribusjon og konsentrasjonen av Ag i cetaceans til stor bekymring.
Men konsentrasjonen av Ag/Ag forbindelser i cetacean vev kan måles ved Induktivt kombinert plasma masse spektroskopi (ICP-MS), er bruk av ICP-MS begrenset av dens høy kapitalkostnad (instrument og vedlikehold) og kravene til vev lagring /Preparation12,15. I tillegg er det vanligvis vanskelig å samle omfattende vevsprøver i alle undersøkelser av strandet cetacean tilfeller logistiske problemer, mangel på arbeidskraft, og mangel på beslektede ressurser12. Frossent prøvene for ICP-MS analyse lagres ikke lett på grunn av begrenset kjøling plassen og frossent prøver kan bli forkastet på grunn av ødelagte kjøling utstyr12. Disse nevnte hindringene hemme undersøkelser av forurensning i cetacean vev av ICP-MS analyse frossent utvalg. Formalin fast vevsprøver er relativt enkelt å samle under obduksjon av døde-strandet cetaceans. Derfor er det nødvendig å utvikle en brukervennlig og rimelig metode for å oppdage/mål tungmetallene i cetacean vev ved hjelp av formalin fast vevsprøver.
Selv om suborgan distribusjoner og konsentrasjoner av lut og alkaliske metaller kan bli endret under formalin-faste, parafin-embedded (FFPE) prosessen, bare mindre effekter på overgangen metaller, som Ag, har vært kjent16. Derfor har FFPE vev vært ansett som en ideell eksempel ressurs for metall lokalisering og målinger16,17. Autometallography (AMG), en histochemical prosess, kan forsterke tungmetaller som ulik størrelse gyllengul til svart AMG positive signaler på FFPE vev seksjoner, og disse forsterket tungmetaller kan visualiseres under * lys18, 19 , 20 , 21. dermed metoden AMG gir informasjon om suborgan distribusjonen av tungmetaller. Det kan gi viktig tilleggsinformasjon for å studere metabolske veier av tungmetaller i biologiske systemer fordi ICP-MS kan bare måle konsentrasjonen av tungmetaller på orgel nivå18. Digitalt bilde analyseprogramvare, for eksempel ImageJ, er videre utlignet til kvantitativ analyse av histologiske vev deler22,23. Ulik størrelse gyllen gul til svart AMG positive signaler av FFPE vev kan være kvantifisert og brukes til å beregne konsentrasjonen av tungmetaller. Selv om absolutt Ag konsentrasjonen ikke kan direkte bestemmes av AMG metoden med bilde kvantitativ analyse, kan det estimeres ved en regresjonsmodell basert på dataene innhentet fra bildet kvantitativ analyse og ICP-MS, kalt cetacean histologiske Ag analysen (CHAA). Vanskelighetene måle Ag konsentrasjoner av ICP-MS analyse i mest strandet cetaceans, CHAA er en verdifull adjuvant metode for å beregne Ag konsentrasjonene i cetacean vev, som ikke kan bestemmes ved ICP-MS analyse på grunn av manglende frosset vevsprøver. Dette dokumentet beskriver protokollen for en histochemical teknikk (AMG-metoden) for lokalisere Ag på suborgan nivå og analysen kalt CHAA å anslå Ag konsentrasjonen i lever og nyre vev av cetaceans.
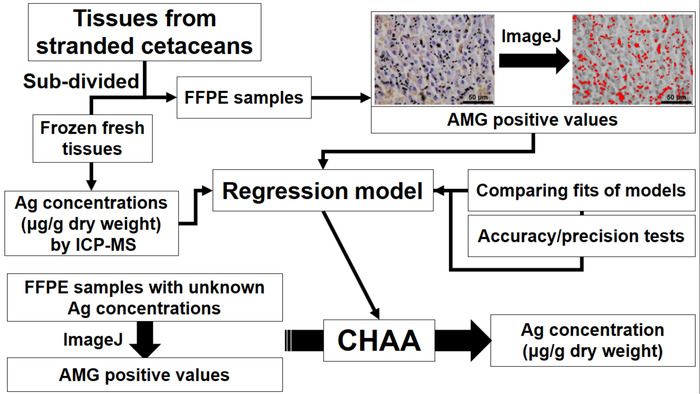
Figur 1: flytskjema som viser etablering og anvendelse av cetacean histologiske Ag analysen (CHAA) for å estimere Ag konsentrasjoner. CHAA = cetacean histologiske Ag analysen, FFPE = Formalin-fast parafin-innebygd, ICP-MS = Induktivt kombinert plasma masse spectroscopy. Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Hensikten med artikkelen studien er å etablere en adjuvant metode å evaluere Ag distribusjonen på suborgan nivåer og beregne Ag konsentrasjonene i cetacean vev. Gjeldende protokollene inkluderer 1) bestemme Ag konsentrasjoner i cetacean vev av ICP-MS, 2) AMG analyse av par-matchet med kjente Ag konsentrasjoner, 3) etablering av regresjonsmodellen (CHAA) for å estimere Ag konsentrasjonen av AMG positive verdier, 4) evaluering av nøyaktighet og presisjon CHAA og 5) estimering av Ag konsentrasjoner av CHAA.
<p cla…Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi takker Taiwan Cetacean Stranding nettverket for prøvetaking og oppbevaring, inkludert Taiwan Cetacean samfunnet, Taipei; Cetacean Research Laboratory (Prof Lien-Siang Chou), Institutt for økologi og evolusjonsbiologi, National Taiwan University, Taipei; National Museum of Natural Science (Dr. Chiou-Ju Yao), Taichung; og marinbiologi & Cetacean Research Center, National Cheng Kung University. Vi takker også skogbruk Bureau, Council of Agriculture, Executive Yuan om deres tillatelse.
Materials
| HQ Silver enhancement kit | Nanoprobes | #2012 | |
| Surgipath Paraplast | Leica Biosystems | 39601006 | Paraffin |
| 100% Ethanol | Muto Pure Chemical Co., Ltd | 4026 | |
| Non-Xylene | Muto Pure Chemical Co., Ltd | 4328 | |
| Silane coated slide | Muto Pure Chemical Co., Ltd | 511614 | |
| Cover glass (25 x 50 mm) | Muto Pure Chemical Co., Ltd | 24501 | |
| Malinol | Muto Pure Chemical Co., Ltd | 20092 | |
| GM Haematoxylin Staining | Muto Pure Chemical Co., Ltd | 3008-1 | |
| 10% neutral buffered formalin solution | Chin I Pao Co., Ltd | — | |
| Tip (1000 μL) | MDBio, Inc. | 1000 | |
| PIPETMAN Classic P1000 | Gilson, Inc. | F123602 | |
| 15 ml Centrifuge Tube | GeneDireX, Inc. | PC115-0500 | |
| Dogfish liver | National Research Council of Canada | DOLT-2 | |
| Dogfish muscle | National Research Council of Canada | DORM-2 | |
| Inductively coupled plasma mass spectrometry (ICP-MS) | PerkinElmer Inc. | PE-SCIEX ELAN 6100 DRC | |
| FreeZone 6 liter freeze dry system | Labconco | 7752030 | For freeze drying |
| BRAND® SILBERBRAND volumetric flask | Merck | Z326283 | |
| 30 mL standard vial, flat interior with 33 mm closure | Savillex Corporation | 200-030-12 | For diagestion |
| Nitric acid, superpur®, 65.0% | Merck | 1.00441 | For diagestion |
| Hot Plate/Stirrers | Corning® | PC-220 | For diagestion |
| High Shear lab mixer | Silverson | SL2T | For homogenization |
| Sterile polypropylene sample jar (250mL) | Thermo Scientific™ | 6186L05 | For homogenization |
| Digital camera | Nikon Corporation | DS-Fi2 | |
| Light microscope | Nikon Corporation | ECLIPSE Ni-U | |
| Shandon™ Finesse™ 325 manual microtome | Thermo Scientific™ | A78100001H | |
| Accu-Cut® SRM™ 200 rotary microtome | Sakura | 1429 | |
| Microtome blade S35 | FEATHER® | 207500000 | |
| Slide staining dish and cover | Brain Research Laboratories | #3215 | |
| Steel staining rack | Brain Research Laboratories | #3003 | |
| Shandon embedding center | Thermo Scientific™ | S-EC | |
| Shandon Citadel® tissue processor | Thermo Scientific™ | 69800003 | |
| Slide warmer | Lab-Line Instruments | 26005 | |
| Water bath | Shandon Capshaw | 3964 | |
| Filter paper | Merck | 1541-070 | |
| Prism 6.01 for windows | GraphPad Software | Statistic software | |
| ImageJ | National Institutes of Health | ||
| Stainless steel tissue embedding mould | Shenyang Roundfin Trade Co., Ltd | RD-TBM003 | For paraffin emedding |
References
- McGillicuddy, E., et al. Silver nanoparticles in the environment: Sources, detection and ecotoxicology. Science Total Environment. 575, 231-246 (2017).
- Yu, S. J., Yin, Y. G., Liu, J. F. Silver nanoparticles in the environment. Environmental Science: Processes and Impacts. 15 (1), 78-92 (2013).
- Hansen, S. F., et al. Nanoproducts- what is actually available to European consumers?. Environmental Science: Nano. 3 (1), 169-180 (2016).
- Vance, M. E., et al. Nanotechnology in the real world: Redeveloping the nanomaterial consumer products inventory. Beilstein Journal of Nanotechnology. 6, 1769-1780 (2015).
- Farre, M., Gajda-Schrantz, K., Kantiani, L., Barcelo, D. Ecotoxicity and analysis of nanomaterials in the aquatic environment. Analytical and Bioanalytical Chemistry. 393 (1), 81-95 (2009).
- Walters, C. R., Pool, E. J., Somerset, V. S. Ecotoxicity of silver nanomaterials in the aquatic environment: a review of literature and gaps in nano-toxicological research. Journal of Environmental Science and Health. Part A, Toxic/hazardous Substances & Environmental Engineering. 49 (13), 1588-1601 (2014).
- Levard, C., Hotze, E. M., Lowry, G. V., Brown, G. E. Environmental transformations of silver nanoparticles: impact on stability and toxicity. Environmental Science & Technology. 46 (13), 6900-6914 (2012).
- Massarsky, A., Trudeau, V. L., Moon, T. W. Predicting the environmental impact of nanosilver. Environmental Toxicology and Pharmacology. 38 (3), 861-873 (2014).
- Wang, H., et al. Toxicity, bioaccumulation, and biotransformation of silver nanoparticles in marine organisms. Environmental Science and Technology. 48 (23), 13711-13717 (2014).
- Buffet, P. E., et al. A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species: the ragworm Hediste diversicolor and the bivalve mollusc Scrobicularia plana. Science of the Total Environment. 470, 1151-1159 (2014).
- Chen, M. H. Baseline metal concentrations in sediments and fish, and the determination of bioindicators in the subtropical Chi-ku Lagoon, S W Taiwan. Marine Pollution Bulletin. 44 (7), 703-714 (2002).
- Li, W. T., et al. Investigation of silver (Ag) deposition in tissues from stranded cetaceans by autometallography (AMG). Environmental Pollution. , 534-545 (2018).
- Chen, M. H., et al. Tissue concentrations of four Taiwanese toothed cetaceans indicating the silver and cadmium pollution in the western Pacific Ocean. Marine Pollution Bulletin. 124 (2), 993-1000 (2017).
- Li, W. T., et al. Immunotoxicity of silver nanoparticles (AgNPs) on the leukocytes of common bottlenose dolphins (Tursiops truncatus). Scientific Reports. , (2018).
- Bornhorst, J. A., Hunt, J. W., Urry, F. M., McMillin, G. A. Comparison of sample preservation methods for clinical trace element analysis by inductively coupled plasma mass spectrometry. American Journal of Clinical Pathology. 123 (4), 578-583 (2005).
- Bonta, M., Torok, S., Hegedus, B., Dome, B., Limbeck, A. A comparison of sample preparation strategies for biological tissues and subsequent trace element analysis using LA-ICP-MS. Analytical and Bioanalytical Chemistry. 409 (7), 1805-1814 (2017).
- Bischoff, K., Lamm, C., Erb, H. N., Hillebrandt, J. R. The effects of formalin fixation and tissue embedding of bovine liver on copper, iron, and zinc analysis. Journal of Veterinary Diagnostic Investigation. 20 (2), 220-224 (2008).
- Miller, D. L., Yu, I. J., Genter, M. B. Use of Autometallography in Studies of Nanosilver Distribution and Toxicity. International Journal of Toxicology. 35 (1), 47-51 (2016).
- Anderson, D. S., et al. Influence of particle size on persistence and clearance of aerosolized silver nanoparticles in the rat lung. Toxicological Sciences. 144 (2), 366-381 (2015).
- Kim, W. Y., Kim, J., Park, J. D., Ryu, H. Y., Yu, I. J. Histological study of gender differences in accumulation of silver nanoparticles in kidneys of Fischer 344 rats. Journal of Toxicology and Environmental Health, Part A. 72 (21-22), 1279-1284 (2009).
- Danscher, G. Applications of autometallography to heavy metal toxicology. Pharmacology Toxicology. 68 (6), 414-423 (1991).
- Deroulers, C., et al. Analyzing huge pathology images with open source software. Diagnostic Pathology. 8, 92 (2013).
- Shu, J., Dolman, G. E., Duan, J., Qiu, G., Ilyas, M. Statistical colour models: an automated digital image analysis method for quantification of histological biomarkers. BioMedical Engineering Online. 15, 46 (2016).
- Geraci, J. R., Lounsbury, V. J. Specimen and data collection. Marine mammals ashore: a field guide for strandings. , 167-230 (2005).
- Shih, C. -. C., Liu, L. -. L., Chen, M. -. H., Wang, W. -. H. . Investigation of heavy metal bioaccumulation in dolphins from the coastal waters off Taiwan. , (2001).
- Liang, C. S., et al. The relationship between the striatal dopamine transporter and novelty seeking and cognitive flexibility in opioid dependence. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 74, 36-42 (2017).
- Spiess, A. N., Neumeyer, N. An evaluation of R2 as an inadequate measure for nonlinear models in pharmacological and biochemical research: a Monte Carlo approach. BMC Pharmacology. 10, 6 (2010).
- Stoltenberg, M., Danscher, G. Histochemical differentiation of autometallographically traceable metals (Au, Ag, Hg, Bi, Zn): protocols for chemical removal of separate autometallographic metal clusters in Epon sections. Histochemical Journal. 32 (11), 645-652 (2000).
- Dimitriadis, V. K., Domouhtsidou, G. P., Raftopoulou, E. Localization of Hg and Pb in the palps, the digestive gland and the gills in Mytilus galloprovincialis (L.) using autometallography and X-ray microanalysis. Environmental Pollution. 125 (3), 345-353 (2003).
- Loumbourdis, N. S., Danscher, G. Autometallographic tracing of mercury in frog liver. Environmental Pollution. 129 (2), 299-304 (2004).
- Stoltenberg, M., Larsen, A., Kemp, K., Bloch, D., Weihe, P. Autometallographic tracing of mercury in pilot whale tissues in the Faroe Islands. International Journal of Circumpolar Health. 62 (2), 182-189 (2003).

