软聚聚硅氧烷-尿素弹性体在人工晶体中的应用
Summary
本研究描述了氨基丙基端聚二甲基硅氧烷和聚二甲基苯基硅氧烷共聚物和软聚硅氧烷 (psu) 弹性体的合成路线。介绍了 psu 作为人工晶状体的应用。本文还介绍了体外细胞毒性的评价方法。
Abstract
本研究讨论了软聚利通尿素 (psu) 弹性体作为适应型人工晶体 (a-IOLs) 的合成方法。氨基丙基端聚二甲基硅氧烷 (pdms) 以前是通过环链平衡环链制备的, 环硅氧烷八甲基环四硅氧烷 (d 4) 和 1, bis(3-氨基丙基)-四甲基二硅氧烷 (aptmds)。通过d4和2、4、6、8-四甲基-2、4、6、8-四苯基-环四硅氧烷 (d4me,ph) 的共聚, 将苯基基团引入硅氧烷主干中。为提高聚硅氧烷的折射率, 合成了这些聚二甲基苯基硅氧烷嵌段共聚物。对于作为 a-IOL 的应用, 聚硅氧烷的折射率必须与年轻的人眼镜片的折射率相等。聚硅氧烷分子量受环硅氧烷与末端阻滞剂 aptmds 的比例控制。利用紫外-可见分光光度计对200至750纳米之间的薄膜进行透射率测量, 检测 psu 弹性体的透明度。在750纳米 (可见光谱的上端) 的透射率值是根据 pdms 分子量绘制的, > 90% 的透射率被观察到, 直到分子量为 18, 000 g·mol-1.采用模切狗骨形状试样的应力应变试验研究了 psu 弹性体的力学性能。为了评估机械稳定性, 通过反复拉伸 (10倍) 的试样到5% 和100% 的伸长率来测量机械滞后性。随着 pdms 分子量的增加, 滞后程度显著降低。使用 mts 细胞活力试验对某些选定的 psu 弹性体的体外细胞毒性进行了评估。本文所述的方法允许合成一个柔软的, 透明的, 和非细胞毒性的 psu 弹性体, 折射率大致等于年轻的人眼镜片。
Introduction
老年性白内障, 影响年龄≥ 60岁, 导致早期的自然晶状体混浊。这种与年龄有关的情况可能是由紫外线照射 1、2、3加速的氧化变化引起的。老年性白内障的常规治疗方法包括手术摘除白内障晶状体, 然后通过注射系统将人工人工晶状体 (iol) 植入空晶状体胶囊2。然而, 大多数 iol 是由丙烯酸聚合物 (疏水和亲水性丙烯酸酯或甲基丙烯酸酯聚合物) 与极其刚性结构制造;因此, 眼睛失去了适应不同距离2,4的能力。因此, 使用单点人工晶体植入物的患者依赖眼镜进行近视 (例如, 在阅读报纸或书籍时)5。
据报道, 白内障手术后恢复住宿能力的方法不同。在这些方法中, 可以区分两个主要策略: 通过注入液体或凝胶状聚合物来填充空晶状体胶囊, 并开发出柔软、可折叠的 a-IOLs 6,7,8。”镜片填充” 的概念很有希望, 因为凝胶的模数可以低至天然人眼镜片 (约1-2 kpa)9;然而, 这种方法仍然是实验8, 研究只在动物眼睛上进行。
镜片胶囊已被重新填充充气硅胶气球 10充满液体硅胶或直接注射硅胶11,12, 随后通过水丝化在胶囊中固化.然而, 有关气球表面皱纹的问题, 与术前状态相比, 适应振幅较低, 以及严重继发性白内障 (前、后囊混浊) 的形成,7, 8,12,13。特别是, 长时间的治疗 (70分钟-12小时) 会增加漏入周围眼睛隔间的风险, 导致术后炎症10,14.因此, 建议使用其他材料来替代晶体透镜, 包括基于聚乙二醇二丙烯酸酯的水凝胶、丙烯酸酯改性的乙烯醇共聚物 (n-乙烯基吡咯烷酮)15、甲基丙烯酸酯聚硅氧烷16,17, 聚氧乙烯醚18, 和二异氰酸酯交联聚醇9。然而, 单体粘度 (即注射和交联后的凝胶肿胀)、极低或高折射率、机械稳定性和完整性、不可预知的术后折射、低适应范围和白内障后的形成是主要问题6、7、8、9、15、18。在商业上, 住宿能力主要是通过开发可折叠的 iol 来恢复的。这种 iol 应通过睫毛肌的收缩,通过人工晶状体囊前部的运动来提供调节。1996年、2001年和 2002年上市的 7、8 种车型已经上市。然而, 在临床研究期间, 植入 a-IOLs 的估计住宿振幅极低 (≤1.5 d), 允许无辅助读数 (3-4 d)6、7、8、19,20. 因此, 正在开发一个由两个连接光学器件 (双光学 iol) 组成的 a-IOL, 以增加舱位范围6、21。只检查了一个镜头的设计, 以检查其在人眼中的调节性能, 尽管据报道结果相互矛盾, 有 22、23、24、25。
通常情况下, 有机硅弹性体被认为是生物惰性和无毒的;因此, 有机硅弹性体在医学和医学工程中作为生物相容性材料应用的历史由来已久 (例如, 在乳房植入物、颅面植入物、关节假肢、伤口敷料、导管、排水沟和分流中)26,27. 有机硅弹性体由于其柔软性、透明度和高吸氧性, 还可用作隐形眼镜和 iol2、28、29.然而, 有机硅必须是共价交联的, 通常需要加固填料才能获得足够的机械完整性。交联是不利的, 因为它禁止随后通过热塑性塑料方法 (如注射成型) 或通过溶液处理 (如溶剂铸造) 来加工弹性体。相反, 热塑性聚氨酯表现出机械稳定性, 但在生物环境中容易降解, 特别是在使用聚酯或聚醚基大醇的情况下。因此, 将柔韧性和水解稳定性与优异的机械性能结合起来的努力集中在将羟基或氨基功能 pdms 作为软段插入聚氨酯、聚氨酯-尿素和多尿 27。为了增强极性聚氨酯或尿素硬段与高非极性 pdms 软段的兼容性, 并提高机械性能, 将不同的聚醚基大二醇与 pdms30,31 结合在一起 ,32岁。特别是, thilak gunatillake 集团对有机硅聚氨酯的发展进行了系统的研究, 该聚氨酯在起搏器绝缘或人工等长期生物医学应用中具有更好的生物稳定性和机械性能。心脏瓣膜33。他们合成了芳香族聚氨酯, 混合软段包括羟基端 pdms 和不同的聚醚, 以及脂肪族聚碳酸酯二醇。在所有合成的聚氨酯中, 聚六环氧乙烷 (phmo) 和 pdms 的结合在硬段相容性方面表现出最佳的力学性能.在随后的研究中, 他们进一步研究了 pdms-phmo 比以及二硅氧基扩链剂对有机硅聚氨酯 34,35的机械性能的影响, 36. 结果表明, 大二醇组合物 80 wt% pdms 和 20 wt% phmo, 除了一个共链扩展器, 如 1, 3-bis(4-羟基丁基)-四甲基二硅氧烷 (bhtd), 产生具有良好机械性能的聚软体聚氨酯和热塑性塑料加工性。此外, 与常用的软聚醚聚氨酯37、38、39相比, 这些有机硅聚氨酯具有增强的生物稳定性。
类似材料的生物相容性和稳定性及其在心血管应用中的用途也有40、41、42.根据这些结果, 使用二硅氧基扩链剂的硅基聚脲弹性体 (或 psu) 被认为具有较高的灵活性和柔软性, 尽管具有足够的机械强度, 以在应用后保持其形状。反复的压力。例如, hermans等人构建了一个基于聚氨酯的实验双光-iol 原型, 因为以前用于使用有机硅制造的设计极其柔软, 可以处理其中的应用载荷。被磨碎的猪眼睛 43。
本文介绍了一种基于硅氧烷的软 psu 的合成方法, 该 psu 在机械和光学性能方面得到了优化, 适用于作为适应 iol 的应用。由于硅氧烷分子量可以改变 psu 弹性体的机械性能, 因此同样的工艺也可应用于硅氧烷基 psu 的开发, 这可以在涂料和皮肤敷料中得到应用。此外, 如果使用卡宾醇端置 pdms, 该程序可用于制备基于硅氧烷的聚氨酯或聚氨酯尿素弹性体。根据用于合成的二异氰酸酯 (即脂肪或芳香族) 的类型, 可能需要改变反应条件 (包括时间、温度, 也许还有溶剂成分)。对于脂肪族二异氰酸酯如 4, 4-甲基二异氰酸酯 (环己基异氰酸酯) (h12 mdi) 或异丙酮二异氰酸酯的应用, 必须使用有机锡催化剂 (如二丁基锡扩张剂或二乙酰氧基四丁基异丙酮。例如, 羟基丙基端 pdms 和 h12 mdi 之间的反应是在催化剂存在的情况下进行的。此外, 反应温度需要提高到50-60°c。对于芳香族二异氰酸酯 (如 4, 4-甲基氰酸酯 (mdi) 的应用, 反应温度必须适度但足够增加, 因为芳香族二异氰酸酯通常对亲核基团的反应性高于比脂肪族二异氰酸酯是。利用无水四氢呋喃 (thf) 和二甲基甲酰胺(dmf) 或二甲基乙酰胺 (dmac) 的溶剂混合物作为三胺具有一定的催化活性, 可以促进 mdi 与碳醇端 pdms 的反应。
Protocol
Representative Results
Discussion
采用无水、强碱性催化剂,通过环链平衡实现高分子量氨基丙基端 pdms 至关重要。其他典型应用的催化剂, 如四甲基氢氧化铵 (tmah) 或氢氧化钾 (koh), 含有水残留物, 可促进副反应;因此, 得到了具有相似分子量的双功能、单功能和非功能 pdms 链的混合物44。此外, 如果使用 tmah, 反应需要 & gt;48 h 才能完成, 并不总是进行完整的单体消耗44。
特别是, 端部阻滞剂 aptmds 的称重对于获得所需的 pdms 分子量至关重要。例如, 如果如议定书第2.1 节所述, 如果使用 0.85 g 合成 pdms, 而不是 0.9 g 的 aptmds, 这将导致理论分子量大约 & gt;900 g·mol-1.此外, 理论分子量取决于转换。如果循环侧产品没有通过真空蒸馏去除 , 将获得较高的转化值。例如, 要使用相同的合成程序 (如议定书第2.1 节), 计算出的90% 的换算率将导致理论上计算的分子量;此值为 910 g·mol-1 大于85% 的换算率.滴定法测定聚硅氧烷分子量的偏差可能与 pdms 在烧瓶中的称重有关, 特别是在使用 50 ml 滴定管进行滴定的情况下。与0.06 克聚硅氧烷的称重有关的偏差可能会导致约 650 g·mol-1 的计算差.因此, 建议使用半自动滴定仪。
pdms 的折射率可以通过纳入5、51、卤化苯基52或含硫组53来提高。在所述的 yilgör、riffr 和 mcgrath 54 所述的八丁基环四硅氧烷 (d 4ph)共聚的方式将苯基纳入 pdms 的尝试没有成功 ,可能是因为笨重的环状主干使应用催化剂不可能在选定的反应温度下分解硅氧烷键。如果在160°c 的反应温度下使用 koh, 则可以打开 d4ph环。然而, 聚硅氧烷的极高分子量, 其中大概含有大量的非功能性杂质。此外, 在这些共聚物中去除催化剂 koh 并不简单, 需要使用乙醇 hcl 进行中和步骤, 然后对催化剂进行水萃取。然后, pdms 必须溶解在有机溶剂中, 如 ch2cl2, 以分离含有机 pdms 相的水相。最后, 有机相必须在 mgso4上干燥, 然后使用旋转蒸发器54进行过滤和真空蒸馏。相反, 本手稿中介绍的方法允许通过热分解立即去除催化剂。因此, 如29种si-nmr所证实, 通过液体单体 d4me, ph 的共聚, 使苯基成功地引入 pdms主干, 而不是使用固体单体 d 4 ph, 而是成功地引入 pdms 主干。光谱50。
合成的 psu 弹性体表现为 ym 0.6-5.5 mpa 和高弹性, 伸长率高达1000%。如此高的伸长率不仅与聚合物分割结构有关, 而且与 psu 弹性体的高分子量 (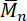 > 100, 000·mol-1)48有关.在室温下, 氨基与脂肪族异氰酸酯基团之间发生瞬时反应, 导致分子量迅速增加。这一结果通过在溶剂中进行反应得到了进一步的支持, 因为粘度的轻微增加似乎并没有显著减缓反应速度, 否则会极大地影响分子量, 以实现近乎平衡的速度化学计量比。相反, 当使用短链二醇, 如 1, 4-丁二醇, 作为扩链剂时, 由此产生的聚氨酯尿素弹性体不仅弹性较低, 而且失去了相当大的机械稳定性, 特别是在高分子量 pdms 为高分子 pdms 的情况下。用于合成。这一结果大概与弹性体的分子量相当低有关 (结果未公布), 这与所有异氰酸酯基团在多加法的最后阶段的不完全转换相对应。此外, 氨基和羟基对脂肪族二异氰酸酯的反应性差异极大地影响了体外细胞毒性试验的结果。从氨基链扩展器 aptmds 制备的 psu 弹性体提取物对 hcam 细胞没有任何细胞毒性作用 (图 12)。然而, 如果使用硅氧烷基聚氨酯-尿素弹性体的提取物, 细胞活力就会大大降低 (结果未公布), 这可能与低分子量的浸漏液和残留的未反应异氰酸酯基团有关。
> 100, 000·mol-1)48有关.在室温下, 氨基与脂肪族异氰酸酯基团之间发生瞬时反应, 导致分子量迅速增加。这一结果通过在溶剂中进行反应得到了进一步的支持, 因为粘度的轻微增加似乎并没有显著减缓反应速度, 否则会极大地影响分子量, 以实现近乎平衡的速度化学计量比。相反, 当使用短链二醇, 如 1, 4-丁二醇, 作为扩链剂时, 由此产生的聚氨酯尿素弹性体不仅弹性较低, 而且失去了相当大的机械稳定性, 特别是在高分子量 pdms 为高分子 pdms 的情况下。用于合成。这一结果大概与弹性体的分子量相当低有关 (结果未公布), 这与所有异氰酸酯基团在多加法的最后阶段的不完全转换相对应。此外, 氨基和羟基对脂肪族二异氰酸酯的反应性差异极大地影响了体外细胞毒性试验的结果。从氨基链扩展器 aptmds 制备的 psu 弹性体提取物对 hcam 细胞没有任何细胞毒性作用 (图 12)。然而, 如果使用硅氧烷基聚氨酯-尿素弹性体的提取物, 细胞活力就会大大降低 (结果未公布), 这可能与低分子量的浸漏液和残留的未反应异氰酸酯基团有关。
该协议介绍了一种制备氨基功能聚硅氧烷的简便方法, 该方法随后可作为宏观二胺用于合成高分子量、软、弹性聚硅氧乙烯醚弹性体。由于 psu 的机械性能可以根据 pdms 分子量的不同而变化, 因此可以在其他应用领域使用这些聚合物。此外, 制备氨基功能聚硅氧烷的程序可用于引入侧基, 如乙烯基, 通过与吊坠乙烯基的循环硅氧烷共聚 (未显示结果)。这可能开辟新的应用领域, 包括制备软交联聚硅氧烷凝胶 (例如, 通过 pt 催化水解与氢功能有机硅或通过 uv 激活的硫醇烯添加硫醇烯的硫醇烯添加可吸入功能 pdms) (结果)。
Disclosures
The authors have nothing to disclose.
Acknowledgements
作者感谢联邦教育和研究部 (bmbf) 在第13fh032i3 赠款下资助这项工作。德国堡 (dfg, gepris 项目 253160297) 的财政支持得到了感谢。提交人还要感谢图宾根大学的 priska kolb 和 paul schuler 进行了1次 h-nmr 和29项 si-nmr 测量。还要感谢 csc jäkle chemie gmbh & co. kg 提供的 h12 mdi。作者要感谢来自 biotronik 的 herbert thelen 和 andrélemme 对 psu 样品进行环氧乙烷灭菌, 并感谢 lada kitaeva (reutlingen 大学) 在应力应变和迟滞测量方面提供的支持。
Materials
| Octamethylcyclotetrasiloxane (D4), 97 % | ABCR GmbH | AB111277 | presumably impairs fertility, must be degassed before use CAS: 556-67-2 |
| 1,3-Bis(3-aminopropyl)-tetramethyldisiloxane, 97% | ABCR GmbH | 110832 | sensitive to air, must be stored under nitrogen CAS: 2469-55-8 |
| 2,4,6,8-Tetramethyl-2,4,6,8-tetraphenylcyclotetrasiloxane | Sigma Aldrich | 40094 | technical grade CAS: 77-63-4 |
| Tetramethylammonium hydroxide pentahydrate | Alfa Aesar | L09658 | toxic if swallowed and upon skin contact, strong base, sensitive to air, hygroscopic, store under refrigeration and under nitrogen CAS: 10424-65-4 |
| 4,4¢-Methylenbis(cyclohexylisocyanate) (H12MDI) | Covestro via CSC Jäkle Chemie GmbH & Co. KG | toxic if inhaled, skin and eye irritant CAS: 5124-30-1 |
|
| Tetrahydrofuran (anhydrous) 99.8 % | Alfa Aesar | 44608 | stabilized with BHT CAS: 109-99-9 |
| Chloroform 99 % | Grüssing GmbH Analytica | 1025125000 | stabilized with ethanol, presumably carcinogenic, can impair fertility and cause damage to an unborn child CAS: 67-66-3 |
| Chloroform-d, 99.8 % | Sigma Aldrich | 151823 | CAS: 865-49-6 |
| Dulbecco's modified Eagle's medium (DMEM) high glucose | Thermo Fisher Scientific Life Technologies GmbH | 41965-039 | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific Life Technologies GmbH | A3160801 | |
| Trypsin/EDTA, 0.25 % phenol red | Thermo Fisher Scientific Life Technologies GmbH | 25200056 | |
| Cell Titer Aqueous One Solution cell proliferation assay (MTS) | Promega GmbH | G3580 | |
| HaCaT-cells | CLS Cell Lines Service GmbH | 300493 | |
| BioComFold | Morcher GmbH | foldable accommodating intraocular lens | |
| Accommodative 1CU | Human Optics AG | foldable accommodating intraocular lens | |
| CrystaLens | Bausch and Lomb Inc. | foldable accommodating intraocular lens | |
| Silmer OH-Di10 | Siltech Corp. | Carbinol-terminated Polydimethylsiloxane | |
| Synchrony | Visiogen Inc. | dual-optic foldable accommodating intraocular lens | |
| Elast-Eon | AorTech International plc | thermoplastic PDMS-PHMO-based polyurethane for medical applications | |
| Pellethane 2363-80A | Lubrizol Life Sciences | thermoplastic polyether-based polyurethane for medical applications | |
| Zwick universal tensile testing machine model 81565 and software testXpert II | Zwick GmbH & Co. KG | tensile testing machine | |
| CASY | Roche Innovatis AG | cell counting system | |
| Multisizer | Beckman Coulter Life Sciences | cell counting system |
References
- Berman, E. R. . Biochemistry of the Eye. , (1991).
- Bozukova, D., Pagnoulle, C., Jérôme, R., Jérôme, C. Polymers in modern ophthalmic implants-Historical background and recent advances. Materials Science and Engineering: R: Reports. 69 (6), 63-83 (2010).
- Kohnen, T., Baumeister, M., Kook, D., Klaproth, O. K., Ohrloff, C. Kataraktchirurgie mit Implantation einer Kunstlinse. Deutsches Ärzteblatt International. 106 (43), 695-702 (2009).
- Lace, R., Murray-Dunning, C., Williams, R. Biomaterials for ocular reconstruction. Journal of Materials Science. 50 (4), 1523-1534 (2015).
- Ong, H. S., Evans, J. R., Allan, B. D. S. Accommodative intraocular lens versus standard monofocal intraocular lens implantation in cataract surgery. Cochrane Database of Systematic Reviews. 5 (5), 1-44 (2014).
- Sheppard, A. L., Bashir, A., Wolffsohn, J. S., Davies, L. N. Accommodating intraocular lenses: a review of design concepts, usage and assessment methods. Clinical and Experimental Optometry. 93 (6), 441-452 (2010).
- Menapace, R., Findl, O., Kriechbaum, K., Leydolt-Koeppl, C. Accommodating intraocular lenses: a critical review of present and future concepts. Graefe’s Archive for Clinical and Experimental Ophthalmology. 245 (4), 473-489 (2007).
- Dick, H. B. Accommodative intraocular lenses: current status. Current Opinion in Ophthalmology. 16 (1), 8-26 (2005).
- De Groot, J. H., et al. Hydrogels for an Accommodating Intraocular Lens. An Explorative Study. Biomacromolecules. 4 (3), 608-616 (2003).
- Nishi, O., et al. Refilling the lens with an inflatable endocapsular balloon: surgical procedure in animal eyes. Graefe’s Archive for Clinical and Experimental Ophthalmology. 230 (1), 47-55 (1992).
- Nishi, O., Nishi, K. Accommodation amplitude after lens refilling with injectable silicone by sealing the capsule with a plug in primates. Archives of Ophthalmology. 116 (10), 1358-1361 (1998).
- Nishi, O., Nishi, K., Mano, C., Ichihara, M., Honda, T. Lens refilling with injectable silicone in rabbit eyes. Journal of Cataract & Refractive Surgery. 24 (7), 975-982 (1998).
- Nishi, O., Nakai, Y., Mizumoto, Y., Yamada, Y. Capsule opacification after refilling the capsule with an inflatable endocapsular balloon. Journal of Cataract & Refractive Surgery. 23 (10), 1548-1555 (1997).
- Koopmans, S. A., et al. Accommodative Lens Refilling in Rhesus Monkeys. Investigative Ophthalmology & Visual Science. 47 (7), 2976-2984 (2006).
- de Groot, J. H., et al. Injectable intraocular lens materials based upon hydrogels. Biomacromolecules. 2 (3), 628-634 (2001).
- Hao, X., et al. Functionalised polysiloxanes as injectable, in situ curable accommodating intraocular lenses. Biomaterials. 31 (32), 8153-8163 (2010).
- Hao, X., et al. High refractive index polysiloxane as injectable, in situ curable accommodating intraocular lens. Biomaterials. 33 (23), 5659-5671 (2012).
- Han, Y. K., et al. In vitro and in vivo study of lens refilling with poloxamer hydrogel. British Journal of Ophthalmology. 87, 1399-1402 (2003).
- Glasser, A. Accommodation: Mechanism and Measurement. Ophthalmology Clinics. 19 (1), 1-12 (2006).
- Glasser, A. Restoration of accommodation. Current Opinion in Ophthalmology. 17 (1), 12-18 (2006).
- Tomas-Juan, J., Murueta-Goyena, L. A. Axial movement of the dual-optic accommodating intraocular lens for the correction of the presbyopia: Optical performance and clinical outcomes. Journal of Optometry. 8 (2), 67-76 (2015).
- McLeod, S. D., Vargas, L. G., Portney, V., Ting, A. Synchrony dual-optic accommodating intraocular lens: Part 1: Optical and biomechanical principles and design considerations. Journal of Cataract & Refractive Surgery. 33 (1), 37-46 (2007).
- McDonald, J. P., et al. Sarfarazi Elliptical Accommodating IntraOcular Lens (EAIOL) in Rhesus Monkey Eyes In Vitro and In Vivo. Investigative Ophthalmology & Visual Science. 44 (13), 256 (2003).
- Ossma, I. L., et al. Synchrony dual-optic accommodating intraocular lens: Part 2: Pilot clinical evaluation. Journal of Cataract & Refractive Surgery. 33 (1), 47-52 (2007).
- Alio, J. L., Plaza-Puche, A. B., Montalban, R., Ortega, P. Near visual outcomes with single-optic and dual-optic accommodating intraocular lenses. Journal of Cataract Refractive Surgery. 38 (9), 1568-1575 (2012).
- Chen, Q., Liang, S., Thousas, G. A. Elastomeric biomaterials for tissue engineering. Progress in Polymer Science. 38, 584-671 (2013).
- Ward, R. S., Jones, R. L., Ducheyne, P. Polyurethanes and Silicone Polyurethane Copolymers. Comprehensive Biomaterials. , 431-477 (2011).
- Yoda, R. Elastomers for biomedical applications. Journal of Biomaterials Science, Polymer Edition. 9 (6), 561-626 (1998).
- Nicolson, P. C., Vogt, J. Soft contact lens polymers: an evolution. Biomaterials. 22 (24), 3273-3283 (2001).
- Adhikari, R., Gunatillake, P. A., McCarthy, S. J., Meijs, G. F. Mixed macrodiol-based siloxane polyurethanes: effect of the comacrodiol structure on properties and morphology. Journal of Applied Polymer Science. 78 (5), 1071-1082 (2000).
- Sheth, J. P., et al. Structure-property behavior of poly(dimethylsiloxane) based segmented polyurea copolymers modified with poly(propylene oxide). Polymer. 46 (19), 8185-8193 (2005).
- Yilgor, I., Yilgor, E. Silicone-urea copolymers modified with polyethers. ACS Symposium Series. 964, 100-115 (2007).
- . Elast-EonTM biocompatible polyurethane – CSIROpedia Available from: https://csiropedia.csiro.au/elast-eon-biocompatible-polyurethane/ (2008)
- Gunatillake, P. A., Meijs, G. F., McCarthy, S. J., Adhikari, R. Poly(dimethylsiloxane)/poly(hexamethylene oxide) mixed macrodiol based polyurethane elastomers. I. Synthesis and properties. Journal of Applied Polymer Science. 76 (14), 2026-2040 (2000).
- Adhikari, R., Gunatillake, P. A., McCarthy, S. J., Meijs, G. F. Low-modulus siloxane-based polyurethanes. I. Effect of the chain extender 1,3-bis(4-hydroxybutyl)1,1,3,3-tetramethyldisiloxane (BHTD) on properties and morphology. Journal of Applied Polymer Science. 83 (4), 736-746 (2002).
- Adhikari, R., Gunatillake, P. A., McCarthy, S. J., Bown, M., Meijs, G. F. Low-modulus siloxane-polyurethanes. Part II. Effect of chain extender structure on properties and morphology. Journal of Applied Polymer Science. 87 (7), 1092-1100 (2003).
- Martin, D. J., et al. Polydimethylsiloxane/polyether-mixed macrodiol-based polyurethane elastomers: biostability. Biomaterials. 21 (10), 1021-1029 (2000).
- Simmons, A., et al. Long-term in vivo biostability of poly(dimethylsiloxane)/poly(hexamethylene oxide) mixed macrodiol-based polyurethane elastomers. Biomaterials. 25 (20), 4887-4900 (2004).
- Gunatillake, P. A., Martin, D. J., Meijs, G. F., McCarthy, S. J., Adhikari, R. Designing biostable polyurethane elastomers for biomedical implants. Australian Journal of Chemistry. 56 (6), 545-557 (2003).
- Briganti, E., et al. Silicone based polyurethane materials: a promising biocompatible elastomeric formulation for cardiovascular applications. Journal of Materials Science: Materials in Medicine. 17 (3), 259-266 (2006).
- Lim, F., Buchko, C., Shah, A., Simhambhatla, M. Medical device formed of silicone-polyurethane. U.S. Patent Application. , (2002).
- Ward, R., Anderson, J., McVenes, R., Stokes, K. In vivo biostability of polysiloxane polyether polyurethanes: Resistance to biologic oxidation and stress cracking. Journal of Biomedical Materials Research Part A. 77 (3), 580-589 (2006).
- Hermans, E. A., et al. Development of a ciliary muscle-driven accommodating intraocular lens. Journal of Cataract & Refractive Surgery. 34 (12), 2133-2138 (2008).
- Hoffman, J. J., Leir, C. M. Tetramethylammonium 3-aminopropyl dimethylsilanolate-A new catalyst for the synthesis of high purity, high molecular weight α,ω-bis(aminopropyl) polydimethylsiloxanes. Polymer International. 24, 131-138 (1991).
- Keiper, F. D. I. N. Prüfung von Kautschuk und Elastomeren – Bestimmung von Reißfestigkeit, Zugfestigkeit, Reißdehnung und Spannungswerten im Zugversuch. Deutsches Institut für Normung e.V. , (2017).
- Wenzelewski, K. DIN EN ISO 10993-5. Biologische Beurteilung von Medizinprodukten – Teil 5: Prüfungen auf In-vitro-Zytotoxizität (ISO 10993-5:2009); Deutsche Fassung EN ISO 10993-5:2009. Deutsches Institut für Normung e.V. , (2009).
- . CellTiter 96® AQueous One Solution Cell Proliferation Assay. Technical Bulletin Available from: https://www.promega.com/-/media/files/resources/protocols/technical-bulletins/0/celltiter-96-aqueous-one-solution-cell-proliferation-assay-system-protocol.pdf (2012)
- Riehle, N., et al. Influence of PDMS molecular weight on transparency and mechanical properties of soft polysiloxane-urea-elastomers for intraocular lens application. European Polymer Journal. 101, 190-201 (2018).
- Gottlieb, H. E., Kotlyar, V., Nudelman, A. NMR Chemical Shifts of Common Laboratory Solvents as Trace Impurities. Journal of Organic Chemistry. 62 (21), 7512-7515 (1997).
- Riehle, N., Götz, T., Kandelbauer, A., Tovar, G. E. M., Lorenz, G. Data on the synthesis and mechanical characterization of polysiloxane-based urea-elastomers prepared from amino-terminated polydimethylsiloxanes and polydimethyl-methyl-phenyl-siloxane-copolymers. Data in Brief. 18, 1784-1794 (2018).
- Christ, R., Nash, B. A., Petraitis, D. J. Optically clear reinforced silicone elastomers of high optical refractive index and improved mechanical properties for use in intraocular lenses. U.S. Patent 5494946 A. , (1993).
- Jha, G. S., Seshadri, G., Mohan, A., Khandal, R. K. Sulfur containing optical plastics and its ophthalmic lenses applications. e-Polymers. 8 (1), 376-402 (2008).
- Rogulska, M., Kultys, A., Olszewska, E. New thermoplastic poly(thiourethane-urethane) elastomers based on hexane-1,6-diyl diisocyanate (HDI). Journal of Thermal Analysis and Calorimetry. 114 (2), 903-916 (2013).
- Yilgör, I., Riffle, J. S., McGrath, J. E., Harris, F. W., Spinelli, H. J. Reactive Siloxane Oligomers. Reactive Oligomers. , 161-174 (1985).

