低酸素/SU5416モデルを用いたマウスにおける肺高血圧の誘導と特徴づけ
Summary
このプロトコルは、低酸素症への暴露およびVEGF受容体拮抗薬の注射に基づくマウスにおける肺高血圧(PH)の誘導について説明する。動物は、プロトコルの開始から3週間後にPHおよび右心室(RV)肥大を発症する。モデルの機能的および形態的特徴付けも提示される。
Abstract
肺高血圧症(PH)は、右心カテーテル法によって評価されるように、安静時25mmHgを超える平均肺動脈圧によって定義される病態生理学的状態である。疾患の広いスペクトルは、病因、病理組織病理学、臨床提示、予後、および治療への応答で異なるPHにつながることができます。過去数年間で大きな進歩を遂げたにもかかわらず、PHは未硬化の病気のままです。根本的なメカニズムを理解することは、新しい治療法の開発への道を開くことができます。動物モデルは、この目標を達成するための重要な研究ツールです。現在、PHの再現に使用できるモデルがいくつかあります。このプロトコルは、2 ヒット マウス PH モデルについて説明します。PH開発の刺激は、血管内皮増殖因子(VEGF)受容体アンタゴニストであるSU5416の低酸素および注射である。低酸素/SU5416の開始から3週間後、動物はヒトPH(主に1群)で観察された組織病理学的変化を模倣した肺血管改修を発症する。肺循環における血管の再モデリングは、右心室(RV)のリモデリングをもたらす。RV圧(開胸法を用いた)、RVの形態測定(心室の両方を解剖し、計量すること)および改造の組織学的評価(血管再造形と心臓の両方を評価して、RV心筋細胞肥大および線維症を評価することによって肺)を詳細に説明する。このプロトコルの利点は、野生型と遺伝子組み換えマウスの両方での適用の可能性、比較的容易かつ低コストの実装、および対象疾患の迅速な開発(3週間)である。この方法の制限は、マウスが重度の表現型を発症しないことであり、PHはノルモキシアに戻ると可逆的である。予防は、治療研究と同様に、(外科げっ歯類モデルとは対照的に)高度なスキルの必要性なしに、このモデルで容易に実施することができる。
Introduction
肺高血圧症(PH)は、右心カテーテル法,1,2によって評価されるように、平均肺動脈(PA)圧が安静時25mmHgを超える状態で定義される病1態生理学的状態である。PHに至る病気はさまざまです。PH関連条件を整理する試みとして、いくつかの分類システムが開発されました。現在の臨床分類は、複数のPH関連疾患を5つの異なるグループ1に分類する。この区別は、患者の様々なグループが臨床提示、病理、予後、および治療2に対する応答において異なる疾患を有するので重要である。表1は、各疾患の基本的な病理的特徴を補完する現在の分類を要約する。
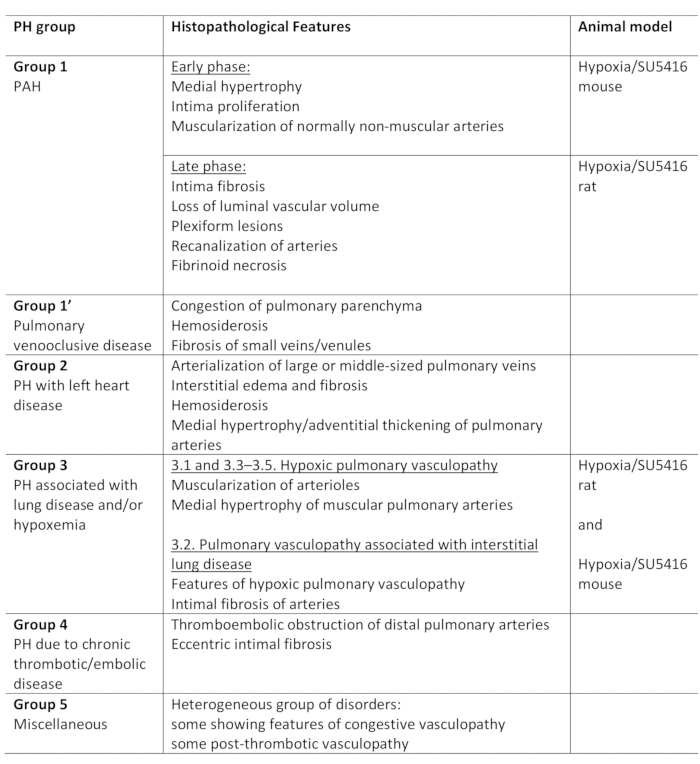
表1:グループ内の主な組織病理学的特徴とともに、PHの臨床分類の概要。低酸素/SU5416プロトコルのモデル化PHに適しています。このテーブルは19から変更されています。PH: 肺高血圧症,PAH:肺動脈性高血圧
PH関連疾患の治療の著しい進歩にもかかわらず、PHは治癒なしで残っており、3年の死亡率は20%から80%の間に30%の範囲である。これは、PHの根本的なメカニズムを理解し、その後、予防し、進行を遅らせ、病気を治す新しい治療法の開発に不可欠な必要性を示しています。動物モデルはこの範囲にとって極めて重要です。現在、PHを研究するために様々なモデルが存在する。興味のある読者は、このトピック2、3、43に2関する優れたレビューを4参照しています。PHに至る様々な疾患を念頭に置いて、ヒトPHの多様な状態を1つの動物モデルで完全に再現できないことは明らかです。利用可能な動物モデルは、i)シングルヒット、ii)2ヒット、iii)ノックアウト、およびiv)過剰発現モデル3に分類することができます。シングルヒットモデルでは、PHは単一の病理学的刺激によって誘発され、2つのヒットモデルはより重篤なPHを誘導し、複雑なヒト疾患をより密接に模倣することを目的とした2つの病理学的刺激を組み合わせる。病因学的な違いに加えて、いくつかの刺激は動物の種および遺伝的背景にも依存するPHモデリングの違いをもたらす4。
最も一般的に使用される古典的なPHげっ歯類モデルの1つは、慢性低酸素モデル2です。低酸素症は、ヒトだけでなく、いくつかの動物種においてPHを誘導することが知られている。低酸素症は、PHに対する生理学的刺激であるという利点を有する(表1)。しかし、げっ歯類のPHを誘導するために使用される低酸素症の程度は、ヒトよりもはるかに重篤であるが、単一の侮辱(低酸素)は、血管のリモデリングの軽度の形態にしか導かない。これは、人間の病気の重症度を模倣しません。第二ヒットの添加は、PHを誘導するための余分な刺激であり、有望な結果を示した:低酸素刺激と結合されたげっ歯類への化合物SU5416の注入は、より重度のPH表現型22、5、65,6を誘導する。SU5416は血管内皮増殖因子(VEGF)受容体-2の阻害剤である。それはVEGF受容体をブロックし、内皮細胞アポトーシスにつながる.低酸素条件下では、これはアポトーシス耐性内皮細胞のサブセットの増殖を刺激する。さらに、SU5416は平滑筋細胞増殖をもたらす。これらの効果の組み合わせは、肺循環の病理学的血管リモデリングをもたらし、PA圧力の上昇および右心室リモデリング22、5、75,7をもたらす。このモデルは、まずラット6で説明され、後でマウス4、5、75,に適用された。4マウスモデルは、ラットに比べて重症の血管リモデリングを呈する。さらに、ノルモキシアに戻すと、ラットではPHが進行し続け、一方マウスでは部分的に可逆性である。
以下のプロトコルは、低酸素/SU5416法(計画、タイムライン、実行)を用いてマウスでPHをモデリングするためのすべてのステップを説明する。さらに、モデルの特性評価は、このプロトコルに記載されています:機能的に(開胸技術を使用して右心室(RV)圧力を侵襲的に測定することによって、形態論的(左右の心室の両方を解剖して計量することによって)、組織学的(肺血管リモデリング、右心室心筋肥大および線維症を評価することによって)
このプロトコルで説明されているすべての手順と方法は、どの経験レベルでも調査担当者が簡単に実装できます。オープンチェスト技術(ここで説明)を用いたRVの機能測定は、現場でのゴールドスタンダード法ではないが、経験の浅い実験者でも迅速に学習し、正確に再現できるという利点を有する。
Protocol
Representative Results
Discussion
このプロトコルは、慢性低酸素症とSU5416注射(低酸素/SU5416)18の2つの病理学的刺激を組み合わせることによってマウスの18PHをモデル化する方法を記述する。このマウスモデルをヒトPH状態と相関させようとする試みにおいて、必然的に現在のPH分類を見なければならない、表1に示す。ほぼすべての形態のPHは、肺血管収縮および内皮および平滑筋細胞の異常増殖に…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この研究は、米国心臓協会(AHA-17SDG3370112および18IPA34170258)からの助成金によって支えられ、国立衛生研究所NIH K01 HL135474からY.S.O.Bへのドイツハーツティフトゥンによってサポートされました。
Materials
| Acetic acid glacial | Roth | 3738.1 | |
| Acetone, Histology Grade | The Lab Depot | VT110D | |
| ADVantage Pressure-Volume System | Transonic | ADV500 | |
| Bouin's solution | Sigma | Ht10132 | |
| Cautery System | Fine Science Tools | 18000-00 | |
| Connection tubing and valves | |||
| Cotton-Tipped Applicators | Covidien | 8884541300 | |
| Coverslips, 24 x50 mm | Roth | 1871 | |
| Data Acquisition and Analysis | Emka | iox2 | |
| Direct Red 80 | Sigma | 365548-5G | |
| DMSO (Dimethyl Sulfoxide) | Sigma Aldrich | 276855 | |
| Dry ice | |||
| Dumont # 5 forceps | Fine Science Tools | 11251-10 | |
| Dumont # 7 Fine Forceps | Fine Science Tools | 11274-20 | |
| Embedding molds | Sigma Aldrich | E-6032 | |
| Eosin Solution Aqueous | Sigma | HT110216 | |
| Ethanol, laboratory Grade | Carolina Biological Supply Company | 861285 | |
| Fast Green FCF | Sigma | F7252-5G | |
| Fine scissors | Fine Science Tools | 14090-09 | |
| Goat Serum | invitrogen | 16210-064 | |
| Heating pad | Gaymar | T/Pump | |
| Hematoxylin 2 | Thermo Scientific | 7231 | |
| Hypoxic chamber | Biospherix | A30274P | |
| Induction chamber | DRE Veterinary | 12570 | |
| Intubation catheter (i.v. catheter SurFlash (20 G x 1") ) | Terumo | SR*FF2025 | |
| Iris scissors | Fine Science Tools | 14084-08 | |
| Isoflurane | Baxter | NDC-10019-360-40 | |
| Isoflurane vaporizer | DRE Veterinary | 12432 | |
| Mice (C57BL/6) | Charles River | ||
| Needles 25 G x 5/8" | BD | 305122 | |
| OCT | Tissue Tek | 4583 | |
| PBS (Phosphate Buffered Saline) | Corning | 21-031-CV | |
| Piric Acid- Saturated Solution 1.3 % | Sigma | P6744-1GA | |
| Pressure volume catheter | Transonic | FTH-1212B-4018 | |
| Retractor | Kent Scientific | SURGI-5001 | |
| Static oxygen Controller ProOx 360 | Biospherix | P360 | |
| SU 5416 | Sigma Aldrich | S8442 | |
| Surgical Suture, black braided silk, 5.0 | Surgical Specialties Corp. | SP116 | |
| Surgical tape | 3M | 1527-1 | |
| Syringe 10 ml | BD | 303134 | |
| Syringes with needle 1 ml | BD | 309626 | |
| Sytox Green Nuclein Acid Stain | Thermo Scientific | S7020 | |
| Tenotomy scissors | Pricon | 60-521 | |
| Toluol | Roth | 9558.3 | |
| Ventilator | CWE | SAR-830/P | |
| WGA Alexa Fluor | Thermo Scientific | W11261 | |
| Xylene | Roth |
References
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Heart Journal. 37 (1), 67-119 (2016).
- Stenmark, K. R., Meyrick, B., Galie, N., Mooi, W. J., McMurtry, I. F. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American Journal of Physiology-Lung Cell Molecular Physiology. 297 (6), 1013-1032 (2009).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: the evolution of animal models in pulmonary hypertension research; are we there yet. Pulmonary Circulation. 3 (4), 739-756 (2013).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. American Journal of Physiology-Lung Cell Molecular Physiology. 302 (10), 977-991 (2012).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 184 (10), 1171-1182 (2011).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. FASEB Journal. 15 (2), 427-438 (2001).
- Vitali, S. H., et al. The Sugen 5416/hypoxia mouse model of pulmonary hypertension revisited: long-term follow-up. Pulmonary Circulation. 4 (4), 619-629 (2014).
- Breen, E. C., Scadeng, M., Lai, N. C., Murray, F., Bigby, T. D. Functional magnetic resonance imaging for in vivo quantification of pulmonary hypertension in the Sugen 5416/hypoxia mouse. Experimental Physiology. 102 (3), 347-353 (2017).
- Wang, Z., Schreier, D. A., Hacker, T. A., Chesler, N. C. Progressive right ventricular functional and structural changes in a mouse model of pulmonary arterial hypertension. Physiological Reports. 1 (7), 00184 (2013).
- Momcilovic, M., et al. Utilizing 18F-FDG PET/CT Imaging and Quantitative Histology to Measure Dynamic Changes in the Glucose Metabolism in Mouse Models of Lung Cancer. Journal of Visualized Experiment. (137), 57167 (2018).
- Guma, S. R., et al. Natural killer cell therapy and aerosol interleukin-2 for the treatment of osteosarcoma lung metastasis. Pediatric Blood Cancer. 61 (4), 618-626 (2014).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. Journal of Histochemistry and Cytochemistry. 62 (10), 751-758 (2014).
- Penumatsa, K. C., et al. Transglutaminase 2 in pulmonary and cardiac tissue remodeling in experimental pulmonary hypertension. American Journal of Physiology-Lung Cell Molecular Physiology. 313 (5), 752-762 (2017).
- Wang, Z., et al. Organ-level right ventricular dysfunction with preserved Frank-Starling mechanism in a mouse model of pulmonary arterial hypertension. Journal of Applied Physiology. 124 (5), 1244-1253 (2018).
- van de Veerdonk, M. C., Bogaard, H. J., Voelkel, N. F. The right ventricle and pulmonary hypertension. Heart Failure Reviews. 21 (3), 259-271 (2016).
- Emde, B., Heinen, A., Godecke, A., Bottermann, K. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction. European Journal of Histochemistry. 58 (4), 2448 (2014).
- Pena, S. D., Gordon, B. B., Karpati, G., Carpenter, S. Lectin histochemistry of human skeletal muscle. Journal of Histochemistry and Cytochemistry. 29 (4), 542-546 (1981).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods in Molecular Biology. 1816, 243-252 (2018).
- Colvin, K. L., Yeager, M. E. Animal Models of Pulmonary Hypertension: Matching Disease Mechanisms to Etiology of the Human Disease. Journal of Pulmonary and Respiratory Medicine. 4 (4), (2014).
- Benza, R. L., et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 122 (2), 164-172 (2010).
- Jacob, S. W., Rosenbaum, E. E. The toxicology of dimethyl sulfoxide (DMSO). Headache. 6 (3), 127-136 (1966).
- Jacob, S. W., Wood, D. C. Dimethyl sulfoxide (DMSO). Toxicology, pharmacology, and clinical experience. American Journal of Surgery. 114 (3), 414-426 (1967).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiment. (103), 52942 (2015).
- Ma, Z., Mao, L., Rajagopal, S. Hemodynamic Characterization of Rodent Models of Pulmonary Arterial Hypertension. Journal of Visualized Experiment. (110), 53335 (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiment. (111), 53810 (2016).
- Penumatsa, K. C., Warburton, R. R., Hill, N. S., Fanburg, B. L. CrossTalk proposal: The mouse SuHx model is a good model of pulmonary arterial hypertension. Journal of Physiology. 597 (4), 975-977 (2019).

