Induction et caractérisation de l’hypertension pulmonaire chez les souris à l’aide du modèle Hypoxie/SU5416
Summary
Ce protocole décrit l’induction de l’hypertension pulmonaire (PH) chez les souris basée sur l’exposition à l’hypoxie et l’injection d’un antagoniste des récepteurs VEGF. Les animaux développent l’hypertrophie ph et ventriculaire droite (RV) 3 semaines après le début du protocole. La caractérisation fonctionnelle et morphométrique du modèle est également présentée.
Abstract
L’hypertension pulmonaire (PH) est une condition pathophysiologique, définie par une pression artérielle pulmonaire moyenne dépassant 25 mm Hg au repos, telle qu’évaluée par cathétérisme cardiaque droit. Un large éventail de maladies peut mener à PH, différent dans leur étiologie, histopathologie, présentation clinique, pronostic, et réponse au traitement. Malgré des progrès significatifs au cours des dernières années, ph reste une maladie non réparée. Comprendre les mécanismes sous-jacents peut ouvrir la voie au développement de nouvelles thérapies. Les modèles animaux sont d’importants outils de recherche pour atteindre cet objectif. Actuellement, il existe plusieurs modèles disponibles pour la récapitulation ph. Ce protocole décrit un modèle PH de souris à deux succès. Les stimuli pour le développement de PH sont l’hypoxie et l’injection de SU5416, un antagoniste du facteur de croissance endothéliale vasculaire (VEGF). Trois semaines après l’initiation de l’Hypoxie/SU5416, les animaux développent le remodelage vasculaire pulmonaire imitant les changements histopathologiques observés dans le PH humain (principalement groupe 1). Le remodelage vasculaire dans la circulation pulmonaire a comme résultat le remodelage du ventricule droit (RV). Les procédures de mesure des pressions de RV (utilisant la méthode de coffre ouvert), les analyses morphométriques du RV (par disséquer et pesant les deux ventricules cardiaques) et les évaluations histologiques du remodelage (à la fois pulmonaire en évaluant le remodelage vasculaire et cardiaque en évaluant l’hypertrophie cardiomyocyte de RV) sont décrites en détail. Les avantages de ce protocole sont la possibilité de l’application à la fois chez les souris sauvages et chez les souris génétiquement modifiées, la mise en œuvre relativement facile et peu coûteuse, et le développement rapide de la maladie d’intérêt (3 semaines). Les limites de cette méthode sont que les souris ne développent pas un phénotype grave et PH est réversible au retour à la normoxie. La prévention, ainsi que les études thérapeutiques, peuvent facilement être mises en œuvre dans ce modèle, sans la nécessité de compétences avancées (par opposition aux modèles chirurgicaux de rongeurs).
Introduction
L’hypertension pulmonaire (PH) est une affection pathophysiologique, définie par une pression artérielle pulmonaire moyenne (PA) supérieure à 25 mm Hg au repos, telle qu’évaluée par cathétérisme cardiaque droit1,2. Il ya une variété de maladies qui peuvent conduire à PH. Dans le but d’organiser les conditions associées au PH, plusieurs systèmes de classification ont été mis au point. La classification clinique actuelle classe les multiples maladies associées au PH dans 5 groupes différents1. Cette distinction est importante puisque divers groupes de patients ont des maladies qui diffèrent dans leur présentation clinique, la pathologie, le pronostic, et la réponse au traitement2. Le tableau 1 résume la classification actuelle, complétée par les caractéristiques histopathologiques de base de chaque maladie.
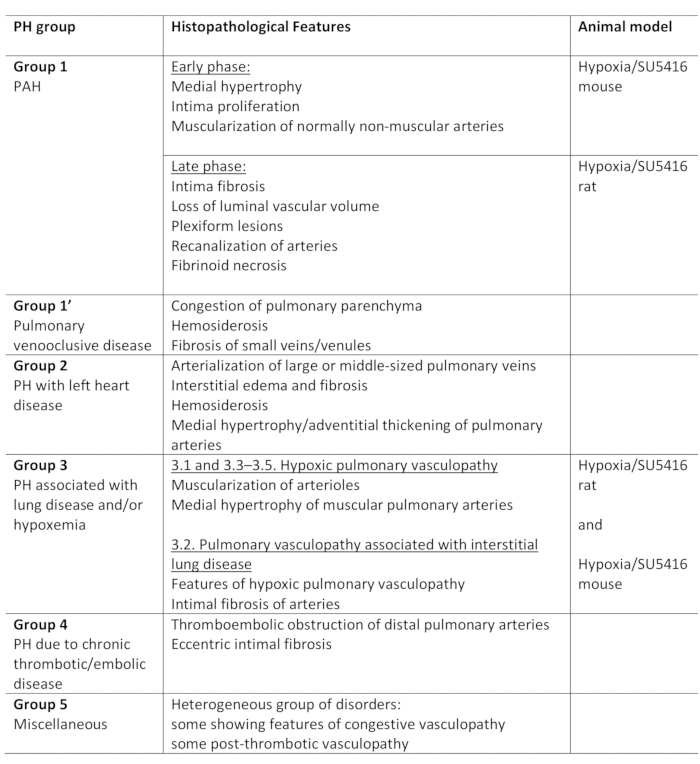
Tableau 1 : Vue d’ensemble de la classification clinique de ph, ainsi que des principales caractéristiques histopathologiques au sein des groupes. Aptitude du protocole Hypoxia/SU5416 pour la modélisation de PH. Ce tableau a été modifié à partir de19. PH: Hypertension pulmonaire, HAP: Hypertension artérielle pulmonaire
Malgré des progrès significatifs dans le traitement des maladies associées au PH, PH reste toujours sans remède, avec un taux de mortalité à 3 ans allant de 20% à 80%3. Cela indique la nécessité impérative de comprendre les mécanismes sous-jacents de PH et, par la suite, le développement de nouvelles thérapies pour prévenir, ralentir la progression, et guérir la maladie. Les modèles animaux sont d’une importance cruciale pour cette portée. Actuellement, divers modèles existent pour étudier le PH. Le lecteur intéressé est référé aux excellents commentaires sur ce sujet2,3,4. Compte tenu de la variété des maladies conduisant à la PH, il est évident que les diverses conditions de PH humaine ne peut pas être parfaitement récapitulée dans un modèle animal. Les modèles animaux disponibles peuvent être classés dans i) single-hit, ii) deux coups, iii) knock-out, et iv) modèles de surexpression3. Dans les modèles à impact unique, PH est induite par un stimulus pathologique unique, tandis que les modèles à deux coups combinent deux stimuli pathologiques dans le but d’induire un PH plus grave et donc plus étroitement imiter la maladie humaine complexe. Outre les différences étiologiques, les plusieurs stimuli entraînent des différences de modélisation ph qui dépendent aussi de l’espèce et de l’arrière-plan génétique des animaux4.
L’un des modèles classiques les plus couramment utilisés de rongeurs PH est le modèle chronique d’hypoxie2. L’hypoxie est connue pour induire la PH chez l’homme ainsi que chez plusieurs espèces animales. L’hypoxie a l’avantage d’être un stimulus physiologique pour ph (Tableau 1). Cependant, alors que le degré d’hypoxie utilisé pour induire la PH chez les rongeurs est beaucoup plus grave que chez l’homme, l’insulte unique (hypoxie) conduit seulement à une forme légère de remodelage vasculaire. Cela n’imite pas la gravité de la maladie humaine. L’ajout d’un deuxième coup, un stimulus supplémentaire pour induire PH, a montré des résultats prometteurs: injection du composé SU5416 aux rongeurs combiné avec le stimulus hypoxique induit un phénotype PH plus grave2,5,6. SU5416 est un inhibiteur du récepteur du facteur de croissance endothélial vasculaire (VEGF) récepteur-2. Il bloque les récepteurs vegf et conduit à l’apoptose des cellules endothéliales. Dans des conditions hypoxiques, cela stimule la prolifération d’un sous-ensemble de cellules endothéliales résistantes à l’apoptose. En outre, SU5416 conduit à la prolifération des cellules musculaires lisses. La combinaison de ces effets entraîne un remodelage vasculaire pathologique de la circulation pulmonaire et conduit à une pression élevée pa et le remodelage ventriculaire droit2,5,7. Le modèle a d’abord été décrit chez les rats6 et plus tard appliqué sur les souris4,5,7. Le modèle de souris présente un remodelage vasculaire moins sévère que celui des rats. En outre, lorsqu’il est retourné à la normoxie, PH continue de progresser chez les rats, tandis que chez les souris, il est partiellement réversible.
Le protocole suivant décrit toutes les étapes de modélisation de PH chez les souris à l’aide de la méthode Hypoxia/SU5416 (planification, chronologie, exécution). En outre, la caractérisation du modèle est décrite dans ce protocole : fonctionnellement (en mesurant invasivement la pression ventriculaire droite (RV) utilisant la technique de coffre ouverte), morphométrique (par disséquer et pesant les ventricules droit et gauche), aussi bien que histologiquement (en évaluant le remodelage vasculaire pulmonaire, hypertrophie et fibrose ventriculaire droite).
Toutes les étapes et méthodes décrites dans ce protocole peuvent être facilement mises en œuvre par les enquêteurs à n’importe quel niveau d’expérience. Bien que les mesures fonctionnelles du RV en utilisant la technique de la poitrine ouverte (décrite ici) ne soit pas la méthode d’étalon-or sur le terrain, elle a l’avantage qu’elle peut être rapidement apprise et reproduite avec précision même par un expérimentateur moins expérimenté.
Protocol
Representative Results
Discussion
Ce protocole décrit comment modéliser le PH chez la souris en combinant deux stimuli pathologiques : l’hypoxie chronique et l’injection de SU5416 (Hypoxia/SU5416)18. Dans une tentative de corréler ce modèle de souris avec la condition humaine ph, il faut inévitablement regarder la classification actuelle ph, indiqué dans le tableau 1. Ph sous presque toutes les formes est caractérisée par la vasoconstriction pulmonaire et la prolifération aberrante des cellules muscul…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par des subventions de l’American Heart Association (AHA- 17SDG33370112 et 18IPA34170258) et des National Institutes of Health NIH K01 HL135474 à Y.S. O.B a été soutenu par le Deutsche Herzstiftung.
Materials
| Acetic acid glacial | Roth | 3738.1 | |
| Acetone, Histology Grade | The Lab Depot | VT110D | |
| ADVantage Pressure-Volume System | Transonic | ADV500 | |
| Bouin's solution | Sigma | Ht10132 | |
| Cautery System | Fine Science Tools | 18000-00 | |
| Connection tubing and valves | |||
| Cotton-Tipped Applicators | Covidien | 8884541300 | |
| Coverslips, 24 x50 mm | Roth | 1871 | |
| Data Acquisition and Analysis | Emka | iox2 | |
| Direct Red 80 | Sigma | 365548-5G | |
| DMSO (Dimethyl Sulfoxide) | Sigma Aldrich | 276855 | |
| Dry ice | |||
| Dumont # 5 forceps | Fine Science Tools | 11251-10 | |
| Dumont # 7 Fine Forceps | Fine Science Tools | 11274-20 | |
| Embedding molds | Sigma Aldrich | E-6032 | |
| Eosin Solution Aqueous | Sigma | HT110216 | |
| Ethanol, laboratory Grade | Carolina Biological Supply Company | 861285 | |
| Fast Green FCF | Sigma | F7252-5G | |
| Fine scissors | Fine Science Tools | 14090-09 | |
| Goat Serum | invitrogen | 16210-064 | |
| Heating pad | Gaymar | T/Pump | |
| Hematoxylin 2 | Thermo Scientific | 7231 | |
| Hypoxic chamber | Biospherix | A30274P | |
| Induction chamber | DRE Veterinary | 12570 | |
| Intubation catheter (i.v. catheter SurFlash (20 G x 1") ) | Terumo | SR*FF2025 | |
| Iris scissors | Fine Science Tools | 14084-08 | |
| Isoflurane | Baxter | NDC-10019-360-40 | |
| Isoflurane vaporizer | DRE Veterinary | 12432 | |
| Mice (C57BL/6) | Charles River | ||
| Needles 25 G x 5/8" | BD | 305122 | |
| OCT | Tissue Tek | 4583 | |
| PBS (Phosphate Buffered Saline) | Corning | 21-031-CV | |
| Piric Acid- Saturated Solution 1.3 % | Sigma | P6744-1GA | |
| Pressure volume catheter | Transonic | FTH-1212B-4018 | |
| Retractor | Kent Scientific | SURGI-5001 | |
| Static oxygen Controller ProOx 360 | Biospherix | P360 | |
| SU 5416 | Sigma Aldrich | S8442 | |
| Surgical Suture, black braided silk, 5.0 | Surgical Specialties Corp. | SP116 | |
| Surgical tape | 3M | 1527-1 | |
| Syringe 10 ml | BD | 303134 | |
| Syringes with needle 1 ml | BD | 309626 | |
| Sytox Green Nuclein Acid Stain | Thermo Scientific | S7020 | |
| Tenotomy scissors | Pricon | 60-521 | |
| Toluol | Roth | 9558.3 | |
| Ventilator | CWE | SAR-830/P | |
| WGA Alexa Fluor | Thermo Scientific | W11261 | |
| Xylene | Roth |
References
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Heart Journal. 37 (1), 67-119 (2016).
- Stenmark, K. R., Meyrick, B., Galie, N., Mooi, W. J., McMurtry, I. F. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American Journal of Physiology-Lung Cell Molecular Physiology. 297 (6), 1013-1032 (2009).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: the evolution of animal models in pulmonary hypertension research; are we there yet. Pulmonary Circulation. 3 (4), 739-756 (2013).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. American Journal of Physiology-Lung Cell Molecular Physiology. 302 (10), 977-991 (2012).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 184 (10), 1171-1182 (2011).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. FASEB Journal. 15 (2), 427-438 (2001).
- Vitali, S. H., et al. The Sugen 5416/hypoxia mouse model of pulmonary hypertension revisited: long-term follow-up. Pulmonary Circulation. 4 (4), 619-629 (2014).
- Breen, E. C., Scadeng, M., Lai, N. C., Murray, F., Bigby, T. D. Functional magnetic resonance imaging for in vivo quantification of pulmonary hypertension in the Sugen 5416/hypoxia mouse. Experimental Physiology. 102 (3), 347-353 (2017).
- Wang, Z., Schreier, D. A., Hacker, T. A., Chesler, N. C. Progressive right ventricular functional and structural changes in a mouse model of pulmonary arterial hypertension. Physiological Reports. 1 (7), 00184 (2013).
- Momcilovic, M., et al. Utilizing 18F-FDG PET/CT Imaging and Quantitative Histology to Measure Dynamic Changes in the Glucose Metabolism in Mouse Models of Lung Cancer. Journal of Visualized Experiment. (137), 57167 (2018).
- Guma, S. R., et al. Natural killer cell therapy and aerosol interleukin-2 for the treatment of osteosarcoma lung metastasis. Pediatric Blood Cancer. 61 (4), 618-626 (2014).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. Journal of Histochemistry and Cytochemistry. 62 (10), 751-758 (2014).
- Penumatsa, K. C., et al. Transglutaminase 2 in pulmonary and cardiac tissue remodeling in experimental pulmonary hypertension. American Journal of Physiology-Lung Cell Molecular Physiology. 313 (5), 752-762 (2017).
- Wang, Z., et al. Organ-level right ventricular dysfunction with preserved Frank-Starling mechanism in a mouse model of pulmonary arterial hypertension. Journal of Applied Physiology. 124 (5), 1244-1253 (2018).
- van de Veerdonk, M. C., Bogaard, H. J., Voelkel, N. F. The right ventricle and pulmonary hypertension. Heart Failure Reviews. 21 (3), 259-271 (2016).
- Emde, B., Heinen, A., Godecke, A., Bottermann, K. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction. European Journal of Histochemistry. 58 (4), 2448 (2014).
- Pena, S. D., Gordon, B. B., Karpati, G., Carpenter, S. Lectin histochemistry of human skeletal muscle. Journal of Histochemistry and Cytochemistry. 29 (4), 542-546 (1981).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods in Molecular Biology. 1816, 243-252 (2018).
- Colvin, K. L., Yeager, M. E. Animal Models of Pulmonary Hypertension: Matching Disease Mechanisms to Etiology of the Human Disease. Journal of Pulmonary and Respiratory Medicine. 4 (4), (2014).
- Benza, R. L., et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 122 (2), 164-172 (2010).
- Jacob, S. W., Rosenbaum, E. E. The toxicology of dimethyl sulfoxide (DMSO). Headache. 6 (3), 127-136 (1966).
- Jacob, S. W., Wood, D. C. Dimethyl sulfoxide (DMSO). Toxicology, pharmacology, and clinical experience. American Journal of Surgery. 114 (3), 414-426 (1967).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiment. (103), 52942 (2015).
- Ma, Z., Mao, L., Rajagopal, S. Hemodynamic Characterization of Rodent Models of Pulmonary Arterial Hypertension. Journal of Visualized Experiment. (110), 53335 (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiment. (111), 53810 (2016).
- Penumatsa, K. C., Warburton, R. R., Hill, N. S., Fanburg, B. L. CrossTalk proposal: The mouse SuHx model is a good model of pulmonary arterial hypertension. Journal of Physiology. 597 (4), 975-977 (2019).

