저산소증/SU5416 모델을 사용하여 마우스에서 폐 고혈압의 유도 및 특성화
Summary
이 프로토콜은 저산소증에 노출및 VEGF 수용체 길항제의 주입에 근거하여 마우스에 있는 폐 고혈압 (PH)의 유도를 기술합니다. 동물은 프로토콜의 개시 후에 PH 및 오른쪽 심실 (RV) 비대 3 주를 개발합니다. 모델의 기능적 및 형태특성도 표시됩니다.
Abstract
폐 고혈압 (PH)은 오른쪽 심장 카테터화에 의해 평가된 바와 같이, 휴식시 25mm Hg를 초과하는 평균 폐 동맥 압력에 의해 정의된 병리학적 상태입니다. 질병의 광범위 한 스펙트럼 PH로 이어질 수 있습니다., 그들의 병 인에서 다른, 조직 병리학, 임상 발표, 예 후, 그리고 치료에 응답. 지난 몇 년 동안 상당한 진전에도 불구하고, PH는 치료되지 않은 질병으로 남아 있습니다. 근본적인 기계장치를 이해하는 것은 새로운 치료의 발달을 위한 도로를 포장할 수 있습니다. 동물 모델은 이 목표를 달성하기 위한 중요한 연구 도구입니다. 현재, PH를 다시 수상에 사용할 수 있는 몇 가지 모델이 있다. 이 프로토콜은 2개의 적중 마우스 PH 모델을 설명합니다. PH 개발을 위한 자극은 저산소증및 SU5416의 주사, 혈관 내피 성장 인자(VEGF) 수용체 길항제이다. Hypoxia/SU5416의 개시 3 주 후에, 동물은 인간 PH에서 관찰된 조직병리학적인 변경을 모방하는 폐 혈관 리모델링을 개발합니다 (주로 그룹 1). 폐 순환에서 혈관 리모델링은 오른쪽 심실(RV)의 리모델링을 초래한다. RV 압력을 측정하기 위한 절차(오픈 가슴 방법을 사용하여), RV의 형태 분석(심장 심실을 해부하고 계량하여) 및 리모델링의 조직학적 평가(RV 심근세포 비대및 섬유증을 평가하여 혈관 리모델링 및 심장을 평가하여 폐 모두)가 상세히 설명되어 있습니다. 이 프로토콜의 장점은 야생 유형과 유전자 변형 마우스 모두에서 응용 프로그램의 가능성, 상대적으로 쉽고 저렴한 구현, 관심있는 질병의 빠른 개발 (3 주). 이 방법의 한계는 마우스가 심각한 표현형을 개발하지 않고 PH는 노목시아로 돌아오면 되돌릴 수 있다는 것이다. 예방, 뿐만 아니라 치료 연구, 쉽게 이 모델에서 구현될 수 있습니다., 고급 기술의 필요 없이 (외과 설치류 모델 반대).
Introduction
폐 고혈압(PH)은 병리학적 상태이며, 오른쪽 심장 카테터화1,,2에의해 평가되는 바와 같이, 휴식 시 25mm Hg를 초과하는 평균 폐 동맥(PA) 압력에 의해 정의된다. PH로 이어질 수 있는 다양한 질병이 있습니다. PH 관련 조건을 구성하기 위해 여러 분류 시스템이 개발되었습니다. 현재 임상 분류는 5개의 다른 그룹1에서다중 PH 관련 질병을 분류합니다. 이러한 구분은 다양한 환자 그룹이 임상 발표, 병리학, 예후 및 치료에 대한 반응2에서다른 질병을 가지고 있기 때문에 중요합니다. 표 1은 각 질병의 기본적인 조직 병리학적 특성으로 보완된 현재 분류를 요약합니다.
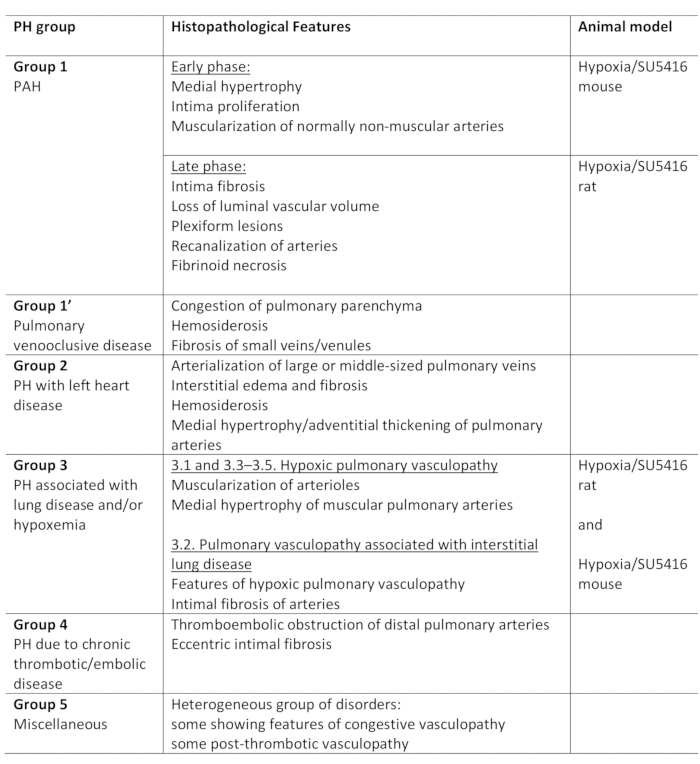
표 1: PH의 임상 분류에 대한 개요와 그룹 내의 주요 조직 병리학 적 특징. 모델링 PH를 위한 저산소증/SU5416 프로토콜의 적합성. 이 테이블은19에서수정되었습니다. PH: 폐 고혈압, PAH: 폐 동맥 고혈압
PH 관련 질병의 처리에 있는 중요한 어드밴스에 에도 불구하고, PH는 아직도 20%와 80% 사이에서 구역 수색하는 3 년 사망률과 함께 치료없이 남아있습니다. 이것은 PH의 근본적인 기계장치를 이해하기 위한 필수적필요를 나타내고, 그 후에, 진행을 방지하고, 느리게 하고, 질병을 치료하기 위하여 새로운 치료의 발달을 나타냅니다. 동물 모델은 이 범위에 매우 중요합니다. 현재 PH를 연구하기 위해 다양한 모델이 존재합니다. 관심있는 독자는이 주제에 대한 우수한 리뷰를참조2,,3,,4. PH로 이어지는 다양한 질병을 염두에 두고, 인간 PH의 다양한 조건이 한 동물 모델에서 완벽하게 재구성될 수 없다는 것은 명백합니다. 사용 가능한 동물 모델은 i) 단일 히트, ii) 투히트, iii) 녹아웃, iv) 과발현 모델3로분류될 수 있다. 단일 히트 모델에서 PH는 단일 병리학 적 자극에 의해 유도되는 반면, 2 히트 모델은 두 개의 병리학적 자극을 더 심한 PH를 유도하는 목표와 결합하여 복잡한 인간 질병을 보다 밀접하게 모방합니다. 이외에도, 몇몇 자극은 동물의 종 및 유전적 배경에 의존하는 PH 모델링차이귀착됩니다 4.
가장 일반적으로 사용되는 고전적인 PH 설치류 모델 중 하나는 만성 저산소증 모델2입니다. 저산소증은 여러 동물 종뿐만 아니라 인간에서 PH를 유도하는 것으로 알려져있다. 저산소증은PH(표 1)에대한 생리학적 자극이라는 장점이 있다. 그러나 설치류에서 PH를 유도하는 데 사용되는 저산소증의 정도는 인간보다 훨씬 더 심각하지만 단일 모욕 (저산소증)은 혈관 리모델링의 온화한 형태로만 이어집니다. 이것은 인간 적인 질병의 엄격을 모방하지 않습니다. 두 번째 히트의 추가, PH 유도에 대한 추가 자극, 유망한 결과를 보여 주었다: 저산소 자극과 결합 된 설치류에 화합물 SU5416의 주입은 더 심각한 PH 표현형2,,5,,6을유도한다. SU5416은 혈관 내피 성장 인자(VEGF) 수용체-2의 억제제이다. It blocks the VEGF receptors and leads to endothelial cell apoptosis. 저산소 조건하에서, 이것은 세포증 저항하는 내피 세포의 부분 집합의 증식을 자극합니다. 또한, SU5416은 원활한 근육 세포 증식으로 이어집니다. 이러한 효과의 조합은 폐 순환의 병리학적인 혈관 리모델링을 초래하고 높은 PA 압력 및 오른쪽 심실 리모델링2,,5,,7로이어집니다. 모델은 쥐6에서 처음 기술되었고 나중에 마우스4,,5,,7에적용되었다. 마우스 모델은 쥐에 비해 덜 심한 혈관 리모델링을 나타낸다. 더욱이, 노목기로 돌아왔을 때, PH는 쥐에서 계속 진행되고, 쥐에서는 부분적으로 가역적이다.
다음 프로토콜은 Hypoxia/SU5416 메서드(계획, 타임라인, 실행)를 사용하여 마우스에서 PH모델링을 위한 모든 단계를 설명합니다. 추가적으로, 모델의 특성화는 이 프로토콜에 기술됩니다: 기능적으로 (개방된 가슴 기술을 사용하여 오른쪽 심실(RV) 압력을 침습적으로 측정함으로써), 형태 (좌우 심실을 해부하고 계량하여), 뿐만 아니라 조직학적으로 (폐 혈관 리모델링, 오른쪽 심실 심근 경전경을 평가하여).
이 프로토콜에 설명된 모든 단계와 메서드는 모든 경험 수준에서 조사관에 의해 쉽게 구현될 수 있습니다. 오픈 가슴 기술을 이용한 RV의 기능적 측정(here 편설명)은 현장에서 금본위제 방법이 아니지만, 경험이 부족한 실험가에서도 빠르게 학습하고 정확하게 재현할 수 있다는 장점이 있다.
Protocol
Representative Results
Discussion
이 프로토콜은 만성 저산소증과 SU5416 주입 (Hypoxia/SU5416)18의두 가지 병리학 적 자극을 결합하여 마우스에서 PH를 모델링하는 방법을 설명합니다. 이 마우스 모델을 인간 PH 조건과 상호 연관시키려면 표 1에표시된 현재 PH 분류를 필연적으로 살펴봐야 합니다. 거의 모든 형태의 PH는 내피 및 부드러운 근육 세포의 폐 혈관 수축 및 비정상적인 증식을 특징으로합니다. 이?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 작품은 미국 심장 협회 (AHA-17SDG337012 및 18IPA34170258)의 보조금에 의해 지원되었으며, 건강 NIH K01 HL135474에서 Y.S. O.B에 대한 국립 보건 원에서 도이치 헤르츠스티프퉁 (Deutsche Herzstiftung)에 의해 지원되었습니다.
Materials
| Acetic acid glacial | Roth | 3738.1 | |
| Acetone, Histology Grade | The Lab Depot | VT110D | |
| ADVantage Pressure-Volume System | Transonic | ADV500 | |
| Bouin's solution | Sigma | Ht10132 | |
| Cautery System | Fine Science Tools | 18000-00 | |
| Connection tubing and valves | |||
| Cotton-Tipped Applicators | Covidien | 8884541300 | |
| Coverslips, 24 x50 mm | Roth | 1871 | |
| Data Acquisition and Analysis | Emka | iox2 | |
| Direct Red 80 | Sigma | 365548-5G | |
| DMSO (Dimethyl Sulfoxide) | Sigma Aldrich | 276855 | |
| Dry ice | |||
| Dumont # 5 forceps | Fine Science Tools | 11251-10 | |
| Dumont # 7 Fine Forceps | Fine Science Tools | 11274-20 | |
| Embedding molds | Sigma Aldrich | E-6032 | |
| Eosin Solution Aqueous | Sigma | HT110216 | |
| Ethanol, laboratory Grade | Carolina Biological Supply Company | 861285 | |
| Fast Green FCF | Sigma | F7252-5G | |
| Fine scissors | Fine Science Tools | 14090-09 | |
| Goat Serum | invitrogen | 16210-064 | |
| Heating pad | Gaymar | T/Pump | |
| Hematoxylin 2 | Thermo Scientific | 7231 | |
| Hypoxic chamber | Biospherix | A30274P | |
| Induction chamber | DRE Veterinary | 12570 | |
| Intubation catheter (i.v. catheter SurFlash (20 G x 1") ) | Terumo | SR*FF2025 | |
| Iris scissors | Fine Science Tools | 14084-08 | |
| Isoflurane | Baxter | NDC-10019-360-40 | |
| Isoflurane vaporizer | DRE Veterinary | 12432 | |
| Mice (C57BL/6) | Charles River | ||
| Needles 25 G x 5/8" | BD | 305122 | |
| OCT | Tissue Tek | 4583 | |
| PBS (Phosphate Buffered Saline) | Corning | 21-031-CV | |
| Piric Acid- Saturated Solution 1.3 % | Sigma | P6744-1GA | |
| Pressure volume catheter | Transonic | FTH-1212B-4018 | |
| Retractor | Kent Scientific | SURGI-5001 | |
| Static oxygen Controller ProOx 360 | Biospherix | P360 | |
| SU 5416 | Sigma Aldrich | S8442 | |
| Surgical Suture, black braided silk, 5.0 | Surgical Specialties Corp. | SP116 | |
| Surgical tape | 3M | 1527-1 | |
| Syringe 10 ml | BD | 303134 | |
| Syringes with needle 1 ml | BD | 309626 | |
| Sytox Green Nuclein Acid Stain | Thermo Scientific | S7020 | |
| Tenotomy scissors | Pricon | 60-521 | |
| Toluol | Roth | 9558.3 | |
| Ventilator | CWE | SAR-830/P | |
| WGA Alexa Fluor | Thermo Scientific | W11261 | |
| Xylene | Roth |
References
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Heart Journal. 37 (1), 67-119 (2016).
- Stenmark, K. R., Meyrick, B., Galie, N., Mooi, W. J., McMurtry, I. F. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American Journal of Physiology-Lung Cell Molecular Physiology. 297 (6), 1013-1032 (2009).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: the evolution of animal models in pulmonary hypertension research; are we there yet. Pulmonary Circulation. 3 (4), 739-756 (2013).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. American Journal of Physiology-Lung Cell Molecular Physiology. 302 (10), 977-991 (2012).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 184 (10), 1171-1182 (2011).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. FASEB Journal. 15 (2), 427-438 (2001).
- Vitali, S. H., et al. The Sugen 5416/hypoxia mouse model of pulmonary hypertension revisited: long-term follow-up. Pulmonary Circulation. 4 (4), 619-629 (2014).
- Breen, E. C., Scadeng, M., Lai, N. C., Murray, F., Bigby, T. D. Functional magnetic resonance imaging for in vivo quantification of pulmonary hypertension in the Sugen 5416/hypoxia mouse. Experimental Physiology. 102 (3), 347-353 (2017).
- Wang, Z., Schreier, D. A., Hacker, T. A., Chesler, N. C. Progressive right ventricular functional and structural changes in a mouse model of pulmonary arterial hypertension. Physiological Reports. 1 (7), 00184 (2013).
- Momcilovic, M., et al. Utilizing 18F-FDG PET/CT Imaging and Quantitative Histology to Measure Dynamic Changes in the Glucose Metabolism in Mouse Models of Lung Cancer. Journal of Visualized Experiment. (137), 57167 (2018).
- Guma, S. R., et al. Natural killer cell therapy and aerosol interleukin-2 for the treatment of osteosarcoma lung metastasis. Pediatric Blood Cancer. 61 (4), 618-626 (2014).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. Journal of Histochemistry and Cytochemistry. 62 (10), 751-758 (2014).
- Penumatsa, K. C., et al. Transglutaminase 2 in pulmonary and cardiac tissue remodeling in experimental pulmonary hypertension. American Journal of Physiology-Lung Cell Molecular Physiology. 313 (5), 752-762 (2017).
- Wang, Z., et al. Organ-level right ventricular dysfunction with preserved Frank-Starling mechanism in a mouse model of pulmonary arterial hypertension. Journal of Applied Physiology. 124 (5), 1244-1253 (2018).
- van de Veerdonk, M. C., Bogaard, H. J., Voelkel, N. F. The right ventricle and pulmonary hypertension. Heart Failure Reviews. 21 (3), 259-271 (2016).
- Emde, B., Heinen, A., Godecke, A., Bottermann, K. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction. European Journal of Histochemistry. 58 (4), 2448 (2014).
- Pena, S. D., Gordon, B. B., Karpati, G., Carpenter, S. Lectin histochemistry of human skeletal muscle. Journal of Histochemistry and Cytochemistry. 29 (4), 542-546 (1981).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods in Molecular Biology. 1816, 243-252 (2018).
- Colvin, K. L., Yeager, M. E. Animal Models of Pulmonary Hypertension: Matching Disease Mechanisms to Etiology of the Human Disease. Journal of Pulmonary and Respiratory Medicine. 4 (4), (2014).
- Benza, R. L., et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 122 (2), 164-172 (2010).
- Jacob, S. W., Rosenbaum, E. E. The toxicology of dimethyl sulfoxide (DMSO). Headache. 6 (3), 127-136 (1966).
- Jacob, S. W., Wood, D. C. Dimethyl sulfoxide (DMSO). Toxicology, pharmacology, and clinical experience. American Journal of Surgery. 114 (3), 414-426 (1967).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiment. (103), 52942 (2015).
- Ma, Z., Mao, L., Rajagopal, S. Hemodynamic Characterization of Rodent Models of Pulmonary Arterial Hypertension. Journal of Visualized Experiment. (110), 53335 (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiment. (111), 53810 (2016).
- Penumatsa, K. C., Warburton, R. R., Hill, N. S., Fanburg, B. L. CrossTalk proposal: The mouse SuHx model is a good model of pulmonary arterial hypertension. Journal of Physiology. 597 (4), 975-977 (2019).

