Induksjon og karakterisering av pulmonal hypertensjon hos mus ved bruk av hypoksi/SU5416-modellen
Summary
Denne protokollen beskriver induksjon av pulmonal hypertensjon (PH) hos mus basert på eksponering for hypoksi og injeksjon av en VEGF reseptor antagonist. Dyrene utvikler PH og høyre ventrikulær (RV) hypertrofi 3 uker etter initiering av protokollen. Den funksjonelle og morfometriekarakteriseringen av modellen presenteres også.
Abstract
Pulmonal hypertensjon (PH) er en patofysiologisk tilstand, definert av et gjennomsnittlig pulmonal arterielt trykk som overstiger 25 mm Hg i ro, som vurdert ved høyre hjertekateterisering. Et bredt spekter av sykdommer kan føre til PH, forskjellig i deres etiologi, histopatologi, klinisk presentasjon, prognose og respons på behandling. Til tross for betydelig fremgang de siste årene, er PH fortsatt en uregistrert sykdom. Å forstå de underliggende mekanismene kan bane vei for utvikling av nye terapier. Dyremodeller er viktige forskningsverktøy for å oppnå dette målet. For tiden er det flere modeller tilgjengelig for rekapituerende PH. Denne protokollen beskriver en to-hit mus PH-modell. Stimuli for PH utvikling er hypoksi og injeksjon av SU5416, en vaskulær endotelvekstfaktor (VEGF) reseptor antagonist. Tre uker etter initiering av hypoksi/SU5416 utvikler dyr lungevaskulær remodeling som etterligner histopatologiske endringer observert i human PH (hovedsakelig gruppe 1). Vaskulær remodeling i lungesirkulasjonen resulterer i ombygging av høyre ventrikkel (RV). Prosedyrene for måling av bobiltrykk (ved hjelp av den åpne brystmetoden), de morfologiske analysene av bobilen (ved å dissekere og veie både hjerte ventrikler) og histologiske vurderinger av remodeling (både lunge ved å vurdere vaskulær remodeling og hjerte ved å vurdere RV kardiomyocytt hypertrofi og fibrose) er beskrevet i detalj. Fordelene med denne protokollen er muligheten for søknaden både i vill type og i genmodifiserte mus, den relativt enkle og rimelige implementeringen, og den raske utviklingen av sykdommen av interesse (3 uker). Begrensninger av denne metoden er at mus ikke utvikler en alvorlig fenotype og PH er reversibel når de går tilbake til normoksi. Forebygging, samt terapistudier, kan enkelt implementeres i denne modellen, uten nødvendigheten av avanserte ferdigheter (i motsetning til kirurgiske gnagermodeller).
Introduction
Pulmonal hypertensjon (PH) er en patofysiologisk tilstand, definert av et gjennomsnittlig lungearterialt (PA) trykk som overstiger 25 mm Hg i ro, som vurdert ved høyre hjertekateterisering1,2. Det finnes en rekke sykdommer som kan føre til PH. I et forsøk på å organisere ph-tilknyttede forhold er det utviklet flere klassifiseringssystemer. Den nåværende kliniske klassifiseringen kategoriserer flere PH-assosierte sykdommer i 5 forskjelligegrupper 1. Dette skillet er av betydning siden ulike pasientgrupper har sykdommer som varierer i klinisk presentasjon, patologi, prognose og respons på behandling2. Tabell 1 oppsummerer den nåværende klassifiseringen, supplert med de grunnleggende histopatologiske egenskapene til hver sykdom.
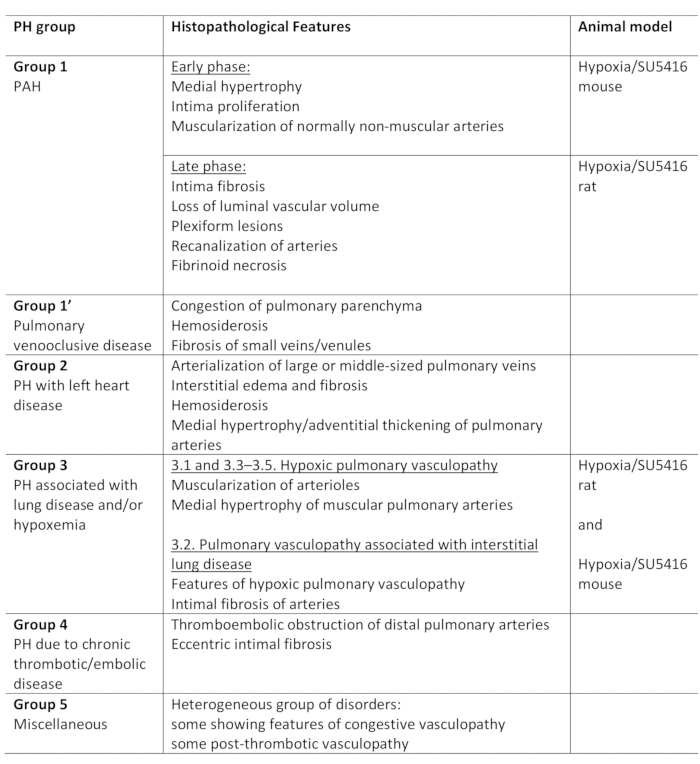
Tabell 1: Oversikt over klinisk klassifisering av PH, sammen med de viktigste histopatologiske trekkene i gruppene. Egnetheten til Hypoksi/SU5416-protokollen for modellering av PH. Denne tabellen er endret fra19. PH: Pulmonal hypertensjon, PAH: Pulmonal arteriell hypertensjon
Til tross for betydelige fremskritt i behandlingen av PH-assosierte sykdommer, forblir PH fortsatt uten en kur, med en 3-års dødelighet mellom 20% og 80%3. Dette indikerer det avgjørende behovet for å forstå de underliggende mekanismene til PH og deretter utviklingen av nye terapier for å forhindre, bremse utviklingen og kurere sykdommen. Dyremodeller er av avgjørende betydning for dette omfanget. For tiden finnes det ulike modeller for å studere PH. Den interesserte leseren er referert til de gode anmeldelsene om dette emnet2,3,4. Med tanke på mangfoldet av sykdommer som fører til PH, er det åpenbart at de ulike forholdene til menneskelig PH ikke kan perfekt rekakalateres i en dyremodell. Dyr modeller tilgjengelig kan kategoriseres i i) single-hit, ii) to-hit, iii) knockout, og iv) overexpression modeller3. I single-hit-modellene induseres PH av en enkelt patologisk stimulans, mens to-hit-modeller kombinerer to patologiske stimuli med mål om å indusere mer alvorlig PH og dermed nærmere etterligne den komplekse menneskelige sykdommen. Foruten de etiologiske forskjellene resulterer de flere stimuliene i PH-modelleringsforskjeller som også avhenger av arten og dyrenes genetiske bakgrunn4.
En av de mest brukte klassiske PH gnagermodeller er kronisk hypoksi modell2. Hypoksi er kjent for å indusere PH hos mennesker så vel som i flere dyrearter. Hypoksi har fordelen av å være en fysiologisk stimulans for PH (tabell 1). Men mens graden av hypoksi som brukes til å indusere PH hos gnagere er mye mer alvorlig enn hos mennesker, fører enkeltfornærmelse (hypoksi) bare til en mild form for vaskulær ombygging. Dette imiterer ikke alvorlighetsgraden av den menneskelige sykdommen. Tilsetning av en andre-hit, en ekstra stimulans for å indusere PH, viste lovende resultater: injeksjon av forbindelsen SU5416 til gnagere kombinert med hypoksisk stimulansindusereren mer alvorlig PH fenotype 2,5,6. SU5416 er en hemmer av vaskulær endotelvekstfaktor (VEGF) reseptor-2. Det blokkerer VEGF reseptorer og fører til endotelcelle apoptose. Under hypoksiske forhold stimulerer dette spredningen av en undergruppe av apoptoseresistente endotelceller. Videre fører SU5416 til jevn muskelcellespredning. Kombinasjonen av disse effektene resulterer i patologisk vaskulær remodeling av lungesirkulasjonen og fører til forhøyet PA-trykk og høyre ventrikulær remodeling2,,5,,7. Modellen ble først beskrevet hos rotter6 og senere brukt på mus4,5,7. Musemodellen viser mindre alvorlig vaskulær ombygging sammenlignet med rotter. Videre, når den returneres til normoksi, fortsetter PH å utvikle seg hos rotter, mens hos mus er det delvis reversibel.
Følgende protokoll beskriver alle trinnene for modellering av PH hos mus ved hjelp av Hypoksi/SU5416-metoden (planlegging, tidslinje, utførelse). I tillegg er karakteriseringen av modellen beskrevet i denne protokollen: funksjonelt (ved å måle riktig ventrikulært (RV) trykk ved hjelp av den åpne brystteknikken), morfometrisk (ved å dissekere og veie både høyre og venstre ventrikler), samt histologisk (ved å evaluere lungevaskulær remodeling, høyre ventrikulær kardiomyocytt hypertrofi og fibrose).
Alle trinnene og metodene som er beskrevet i denne protokollen, kan enkelt implementeres av undersøkere på alle erfaringstrinn. Mens de funksjonelle målingene av RV ved hjelp av den åpne brystteknikken (beskrevet her) ikke er gullstandardmetoden i feltet, har den fordelen at den raskt kan læres og nøyaktig reproduseres selv av en mindre erfaren eksperimenterer.
Protocol
Representative Results
Discussion
Denne protokollen beskriver hvordan man modellerer PH hos mus ved å kombinere to patologiske stimuli: kronisk hypoksi og SU5416 injeksjon (Hypoksi/SU5416)18. I et forsøk på å korrelere denne musemodellen med den menneskelige PH-tilstanden, må man uunngåelig se på den nåværende PH-klassifiseringen, vist i tabell 1. PH i nesten alle former er preget av lungevasokonstriksjon og avvikende spredning av endotel- og glatte muskelceller. Dette fører til forhøyet trykk i lungear…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av tilskudd fra American Heart Association (AHA- 17SDG33370112 og 18IPA34170258) og fra National Institutes of Health NIH K01 HL135474 til Y.S. O.B ble støttet av Deutsche Herzstiftung.
Materials
| Acetic acid glacial | Roth | 3738.1 | |
| Acetone, Histology Grade | The Lab Depot | VT110D | |
| ADVantage Pressure-Volume System | Transonic | ADV500 | |
| Bouin's solution | Sigma | Ht10132 | |
| Cautery System | Fine Science Tools | 18000-00 | |
| Connection tubing and valves | |||
| Cotton-Tipped Applicators | Covidien | 8884541300 | |
| Coverslips, 24 x50 mm | Roth | 1871 | |
| Data Acquisition and Analysis | Emka | iox2 | |
| Direct Red 80 | Sigma | 365548-5G | |
| DMSO (Dimethyl Sulfoxide) | Sigma Aldrich | 276855 | |
| Dry ice | |||
| Dumont # 5 forceps | Fine Science Tools | 11251-10 | |
| Dumont # 7 Fine Forceps | Fine Science Tools | 11274-20 | |
| Embedding molds | Sigma Aldrich | E-6032 | |
| Eosin Solution Aqueous | Sigma | HT110216 | |
| Ethanol, laboratory Grade | Carolina Biological Supply Company | 861285 | |
| Fast Green FCF | Sigma | F7252-5G | |
| Fine scissors | Fine Science Tools | 14090-09 | |
| Goat Serum | invitrogen | 16210-064 | |
| Heating pad | Gaymar | T/Pump | |
| Hematoxylin 2 | Thermo Scientific | 7231 | |
| Hypoxic chamber | Biospherix | A30274P | |
| Induction chamber | DRE Veterinary | 12570 | |
| Intubation catheter (i.v. catheter SurFlash (20 G x 1") ) | Terumo | SR*FF2025 | |
| Iris scissors | Fine Science Tools | 14084-08 | |
| Isoflurane | Baxter | NDC-10019-360-40 | |
| Isoflurane vaporizer | DRE Veterinary | 12432 | |
| Mice (C57BL/6) | Charles River | ||
| Needles 25 G x 5/8" | BD | 305122 | |
| OCT | Tissue Tek | 4583 | |
| PBS (Phosphate Buffered Saline) | Corning | 21-031-CV | |
| Piric Acid- Saturated Solution 1.3 % | Sigma | P6744-1GA | |
| Pressure volume catheter | Transonic | FTH-1212B-4018 | |
| Retractor | Kent Scientific | SURGI-5001 | |
| Static oxygen Controller ProOx 360 | Biospherix | P360 | |
| SU 5416 | Sigma Aldrich | S8442 | |
| Surgical Suture, black braided silk, 5.0 | Surgical Specialties Corp. | SP116 | |
| Surgical tape | 3M | 1527-1 | |
| Syringe 10 ml | BD | 303134 | |
| Syringes with needle 1 ml | BD | 309626 | |
| Sytox Green Nuclein Acid Stain | Thermo Scientific | S7020 | |
| Tenotomy scissors | Pricon | 60-521 | |
| Toluol | Roth | 9558.3 | |
| Ventilator | CWE | SAR-830/P | |
| WGA Alexa Fluor | Thermo Scientific | W11261 | |
| Xylene | Roth |
References
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Heart Journal. 37 (1), 67-119 (2016).
- Stenmark, K. R., Meyrick, B., Galie, N., Mooi, W. J., McMurtry, I. F. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American Journal of Physiology-Lung Cell Molecular Physiology. 297 (6), 1013-1032 (2009).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: the evolution of animal models in pulmonary hypertension research; are we there yet. Pulmonary Circulation. 3 (4), 739-756 (2013).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. American Journal of Physiology-Lung Cell Molecular Physiology. 302 (10), 977-991 (2012).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 184 (10), 1171-1182 (2011).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. FASEB Journal. 15 (2), 427-438 (2001).
- Vitali, S. H., et al. The Sugen 5416/hypoxia mouse model of pulmonary hypertension revisited: long-term follow-up. Pulmonary Circulation. 4 (4), 619-629 (2014).
- Breen, E. C., Scadeng, M., Lai, N. C., Murray, F., Bigby, T. D. Functional magnetic resonance imaging for in vivo quantification of pulmonary hypertension in the Sugen 5416/hypoxia mouse. Experimental Physiology. 102 (3), 347-353 (2017).
- Wang, Z., Schreier, D. A., Hacker, T. A., Chesler, N. C. Progressive right ventricular functional and structural changes in a mouse model of pulmonary arterial hypertension. Physiological Reports. 1 (7), 00184 (2013).
- Momcilovic, M., et al. Utilizing 18F-FDG PET/CT Imaging and Quantitative Histology to Measure Dynamic Changes in the Glucose Metabolism in Mouse Models of Lung Cancer. Journal of Visualized Experiment. (137), 57167 (2018).
- Guma, S. R., et al. Natural killer cell therapy and aerosol interleukin-2 for the treatment of osteosarcoma lung metastasis. Pediatric Blood Cancer. 61 (4), 618-626 (2014).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. Journal of Histochemistry and Cytochemistry. 62 (10), 751-758 (2014).
- Penumatsa, K. C., et al. Transglutaminase 2 in pulmonary and cardiac tissue remodeling in experimental pulmonary hypertension. American Journal of Physiology-Lung Cell Molecular Physiology. 313 (5), 752-762 (2017).
- Wang, Z., et al. Organ-level right ventricular dysfunction with preserved Frank-Starling mechanism in a mouse model of pulmonary arterial hypertension. Journal of Applied Physiology. 124 (5), 1244-1253 (2018).
- van de Veerdonk, M. C., Bogaard, H. J., Voelkel, N. F. The right ventricle and pulmonary hypertension. Heart Failure Reviews. 21 (3), 259-271 (2016).
- Emde, B., Heinen, A., Godecke, A., Bottermann, K. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction. European Journal of Histochemistry. 58 (4), 2448 (2014).
- Pena, S. D., Gordon, B. B., Karpati, G., Carpenter, S. Lectin histochemistry of human skeletal muscle. Journal of Histochemistry and Cytochemistry. 29 (4), 542-546 (1981).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods in Molecular Biology. 1816, 243-252 (2018).
- Colvin, K. L., Yeager, M. E. Animal Models of Pulmonary Hypertension: Matching Disease Mechanisms to Etiology of the Human Disease. Journal of Pulmonary and Respiratory Medicine. 4 (4), (2014).
- Benza, R. L., et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 122 (2), 164-172 (2010).
- Jacob, S. W., Rosenbaum, E. E. The toxicology of dimethyl sulfoxide (DMSO). Headache. 6 (3), 127-136 (1966).
- Jacob, S. W., Wood, D. C. Dimethyl sulfoxide (DMSO). Toxicology, pharmacology, and clinical experience. American Journal of Surgery. 114 (3), 414-426 (1967).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiment. (103), 52942 (2015).
- Ma, Z., Mao, L., Rajagopal, S. Hemodynamic Characterization of Rodent Models of Pulmonary Arterial Hypertension. Journal of Visualized Experiment. (110), 53335 (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiment. (111), 53810 (2016).
- Penumatsa, K. C., Warburton, R. R., Hill, N. S., Fanburg, B. L. CrossTalk proposal: The mouse SuHx model is a good model of pulmonary arterial hypertension. Journal of Physiology. 597 (4), 975-977 (2019).

