Indução e Caracterização da Hipertensão Pulmonar em Camundongos usando o Modelo De Hypoxia/SU5416
Summary
Este protocolo descreve a indução da hipertensão pulmonar (PH) em camundongos com base na exposição à hipóxia e na injeção de um antagonista receptor VEGF. Os animais desenvolvem hipertrofia ph e ventricular direita (RV) 3 semanas após o início do protocolo. A caracterização funcional e morfométrica do modelo também é apresentada.
Abstract
Hipertensão Pulmonar (AP) é uma condição fisioterológica, definida por uma pressão arterial pulmonar média superior a 25 mm Hg em repouso, conforme avaliado pelo cateterismo cardíaco direito. Um amplo espectro de doenças pode levar à ETI, diferindo em sua etiologia, histopatologia, apresentação clínica, prognóstico e resposta ao tratamento. Apesar dos progressos significativos nos últimos anos, a AP continua sendo uma doença não recorrente. Compreender os mecanismos subjacentes pode abrir caminho para o desenvolvimento de novas terapias. Modelos animais são importantes ferramentas de pesquisa para alcançar esse objetivo. Atualmente, existem vários modelos disponíveis para recapitulação de PH. Este protocolo descreve um modelo PH de dois hits do mouse. Os estímulos para o desenvolvimento de PH são a hipóxia e a injeção de SU5416, um antagonista do receptor fator de crescimento endotelial vascular (VEGF). Três semanas após o início da Hipóxia/SU5416, os animais desenvolvem remodelação vascular pulmonar imitando as alterações histopatológicas observadas na AP humana (predominantemente grupo 1). A remodelação vascular na circulação pulmonar resulta na remodelação do ventrículo direito (RV). Os procedimentos para medir as pressões de RV (utilizando o método do peito aberto), as análises morfômicas do RV (dissecando e pesando ambos os ventrículos cardíacos) e as avaliações histológicas da remodelagem (tanto pulmonares através da avaliação da remodelagem vascular quanto do cardíaco, avaliando a hipertrofia e a fibrose cardiomiocócica do RV) são descritas detalhadamente. As vantagens deste protocolo são a possibilidade da aplicação tanto em camundongos selvagens quanto em camundongos geneticamente modificados, a implementação relativamente fácil e de baixo custo, e o rápido desenvolvimento da doença de interesse (3 semanas). As limitações deste método são que os camundongos não desenvolvem um fenótipo grave e a FP é reversível no retorno à normoxia. A prevenção, assim como os estudos terapêuticos, podem ser facilmente implementados neste modelo, sem a necessidade de habilidades avançadas (em oposição aos modelos de roedores cirúrgicos).
Introduction
Hipertensão pulmonar (AP) é uma condição fisioterológica, definida por uma pressão arterial pulmonar média (PA) superior a 25 mm Hg em repouso, conforme avaliado pelo cateterismo cardíaco direito1,,2. Há uma variedade de doenças que podem levar à PH. Na tentativa de organizar as condições associadas ao PH, vários sistemas de classificação foram desenvolvidos. A classificação clínica atual categoriza as múltiplas doenças associadas à AP em 5 diferentes grupos1. Essa distinção é importante, pois vários grupos de pacientes possuem doenças que diferem em sua apresentação clínica, patologia, prognóstico e resposta ao tratamento2. A Tabela 1 resume a classificação atual, complementada com as características histopatológicas básicas de cada doença.
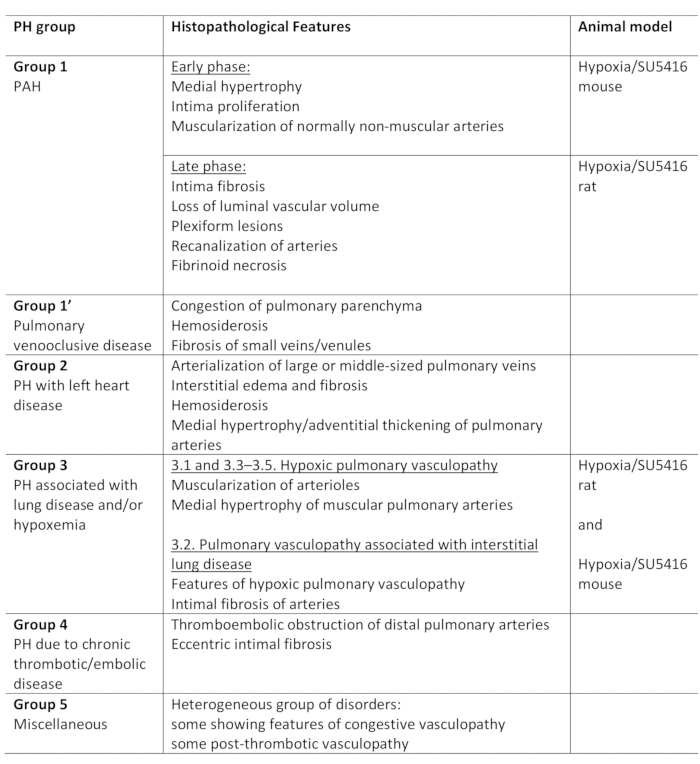
Tabela 1: Visão geral da classificação clínica de PH, juntamente com as principais características histopatológicas dentro dos grupos. Adequação do protocolo Hypoxia/SU5416 para modelagem de PH. Esta tabela foi modificada a partir de19. PH: Hipertensão pulmonar, PAH: Hipertensão Arterial Pulmonar
Apesar dos avanços significativos no tratamento de doenças associadas à AP, a AP ainda permanece sem cura, com uma taxa de mortalidade de 3 anos variando entre 20% e 80%3. Isso indica a necessidade imperativa de compreender os mecanismos subjacentes da AP e, posteriormente, o desenvolvimento de novas terapias para prevenir, retardar a progressão e curar a doença. Modelos animais são de importância crucial para este escopo. Atualmente, existem vários modelos para estudar PH. O leitor interessado é encaminhado para as excelentes avaliações sobre este tópico2,3,4. Tendo em vista a variedade de doenças que levam à PH, é óbvio que as diversas condições da AP humana não podem ser perfeitamente recapituladas em um modelo animal. Os modelos animais disponíveis podem ser categorizados em i) single-hit, ii) two-hit, iii) knockout, e iv) overexpression models3. Nos modelos de um único hit, a FP é induzida por um único estímulo patológico, enquanto os modelos de dois hits combinam dois estímulos patológicos com o objetivo de induzir a PH mais grave e, assim, imitar mais de perto a complexa doença humana. Além das diferenças etiológicas, os diversos estímulos resultam em diferenças de modelagem de PH que dependem também da espécie e do fundo genético dos animais4.
Um dos modelos clássicos de roedores PH mais usados é o modelo de hipóxia crônica2. A hipóxia é conhecida por induzir PH em humanos, bem como em várias espécies animais. A hipóxia tem a vantagem de ser um estímulo fisiológico para PH (Tabela 1). No entanto, enquanto o grau de hipóxia usado para induzir PH em roedores é muito mais grave do que em humanos, o único insulto (hipóxia) leva apenas a uma forma leve de remodelagem vascular. Isso não imita a gravidade da doença humana. A adição de um segundo hit, um estímulo extra para induzir a PH, mostrou resultados promissores: a injeção do composto SU5416 aos roedores combinado com o estímulo hipóxico induz um fenótipo PH mais grave2,,5,6. SU5416 é um inibidor do receptor fator de crescimento endotelial vascular (VEGF) receptor-2. Bloqueia os receptores VEGF e leva à apoptose celular endotelial. Em condições hipóxiis, isso estimula a proliferação de um subconjunto de células endoteliais resistentes à apoptose. Além disso, o SU5416 leva à proliferação de células musculares lisas. A combinação desses efeitos resulta em remodelação vascular patológica da circulação pulmonar e leva à elevada pressão da AF e remodelação ventricular direita2,,5,,7. O modelo foi descrito pela primeira vez em ratos6 e posteriormente aplicado em camundongos4,5,7. O modelo do mouse exibe remodelagem vascular menos severa em comparação com ratos. Além disso, quando retornado à normoxia, a AP continua a progredir em ratos, enquanto em camundongos é parcialmente reversível.
O protocolo a seguir descreve todas as etapas para modelagem de PH em camundongos usando o método Hypoxia/SU5416 (planejamento, cronograma, execução). Além disso, a caracterização do modelo está descrita neste protocolo: funcionalmente (medindo invasivamente a pressão ventricular direita (RV) utilizando a técnica do peito aberto), morfometricamente (dissecando e pesando tanto os ventrículos direito quanto esquerdo), bem como histologicamente (avaliando a remodelagem vascular pulmonar, hipertrofia cardiomiófica ventricular direita e fibrose).
Todas as etapas e métodos descritos neste protocolo podem ser facilmente implementados pelos investigadores em qualquer nível de experiência. Embora as medidas funcionais do RV usando a técnica de peito aberto (descrita aqui) não seja o método padrão-ouro no campo, ele tem a vantagem de que pode ser rapidamente aprendido e reproduzido com precisão até mesmo por um experimentador menos experiente.
Protocol
Representative Results
Discussion
Este protocolo descreve como modelar PH em camundongos combinando dois estímulos patológicos: hipoxia crônica e injeção de SU5416 (Hipóxia/SU5416)18. Na tentativa de correlacionar este modelo de mouse com a condição ph humana, inevitavelmente deve-se olhar para a classificação PH atual, mostrada na Tabela 1. A PH em quase todas as formas é caracterizada pela vasoconstrição pulmonar e proliferação aberrante de células musculares endoteliais e lisas. Isso leva a uma …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi apoiado por subsídios da American Heart Association (AHA- 17SDG33370112 e 18IPA34170258) e dos Institutos Nacionais de Saúde NIH K01 HL135474 a Y.S. O.B foi apoiado pela Deutsche Herzstiftung.
Materials
| Acetic acid glacial | Roth | 3738.1 | |
| Acetone, Histology Grade | The Lab Depot | VT110D | |
| ADVantage Pressure-Volume System | Transonic | ADV500 | |
| Bouin's solution | Sigma | Ht10132 | |
| Cautery System | Fine Science Tools | 18000-00 | |
| Connection tubing and valves | |||
| Cotton-Tipped Applicators | Covidien | 8884541300 | |
| Coverslips, 24 x50 mm | Roth | 1871 | |
| Data Acquisition and Analysis | Emka | iox2 | |
| Direct Red 80 | Sigma | 365548-5G | |
| DMSO (Dimethyl Sulfoxide) | Sigma Aldrich | 276855 | |
| Dry ice | |||
| Dumont # 5 forceps | Fine Science Tools | 11251-10 | |
| Dumont # 7 Fine Forceps | Fine Science Tools | 11274-20 | |
| Embedding molds | Sigma Aldrich | E-6032 | |
| Eosin Solution Aqueous | Sigma | HT110216 | |
| Ethanol, laboratory Grade | Carolina Biological Supply Company | 861285 | |
| Fast Green FCF | Sigma | F7252-5G | |
| Fine scissors | Fine Science Tools | 14090-09 | |
| Goat Serum | invitrogen | 16210-064 | |
| Heating pad | Gaymar | T/Pump | |
| Hematoxylin 2 | Thermo Scientific | 7231 | |
| Hypoxic chamber | Biospherix | A30274P | |
| Induction chamber | DRE Veterinary | 12570 | |
| Intubation catheter (i.v. catheter SurFlash (20 G x 1") ) | Terumo | SR*FF2025 | |
| Iris scissors | Fine Science Tools | 14084-08 | |
| Isoflurane | Baxter | NDC-10019-360-40 | |
| Isoflurane vaporizer | DRE Veterinary | 12432 | |
| Mice (C57BL/6) | Charles River | ||
| Needles 25 G x 5/8" | BD | 305122 | |
| OCT | Tissue Tek | 4583 | |
| PBS (Phosphate Buffered Saline) | Corning | 21-031-CV | |
| Piric Acid- Saturated Solution 1.3 % | Sigma | P6744-1GA | |
| Pressure volume catheter | Transonic | FTH-1212B-4018 | |
| Retractor | Kent Scientific | SURGI-5001 | |
| Static oxygen Controller ProOx 360 | Biospherix | P360 | |
| SU 5416 | Sigma Aldrich | S8442 | |
| Surgical Suture, black braided silk, 5.0 | Surgical Specialties Corp. | SP116 | |
| Surgical tape | 3M | 1527-1 | |
| Syringe 10 ml | BD | 303134 | |
| Syringes with needle 1 ml | BD | 309626 | |
| Sytox Green Nuclein Acid Stain | Thermo Scientific | S7020 | |
| Tenotomy scissors | Pricon | 60-521 | |
| Toluol | Roth | 9558.3 | |
| Ventilator | CWE | SAR-830/P | |
| WGA Alexa Fluor | Thermo Scientific | W11261 | |
| Xylene | Roth |
References
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Heart Journal. 37 (1), 67-119 (2016).
- Stenmark, K. R., Meyrick, B., Galie, N., Mooi, W. J., McMurtry, I. F. Animal models of pulmonary arterial hypertension: the hope for etiological discovery and pharmacological cure. American Journal of Physiology-Lung Cell Molecular Physiology. 297 (6), 1013-1032 (2009).
- Maarman, G., Lecour, S., Butrous, G., Thienemann, F., Sliwa, K. A comprehensive review: the evolution of animal models in pulmonary hypertension research; are we there yet. Pulmonary Circulation. 3 (4), 739-756 (2013).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. American Journal of Physiology-Lung Cell Molecular Physiology. 302 (10), 977-991 (2012).
- Ciuclan, L., et al. A novel murine model of severe pulmonary arterial hypertension. American Journal of Respiratory and Critical Care Medicine. 184 (10), 1171-1182 (2011).
- Taraseviciene-Stewart, L., et al. Inhibition of the VEGF receptor 2 combined with chronic hypoxia causes cell death-dependent pulmonary endothelial cell proliferation and severe pulmonary hypertension. FASEB Journal. 15 (2), 427-438 (2001).
- Vitali, S. H., et al. The Sugen 5416/hypoxia mouse model of pulmonary hypertension revisited: long-term follow-up. Pulmonary Circulation. 4 (4), 619-629 (2014).
- Breen, E. C., Scadeng, M., Lai, N. C., Murray, F., Bigby, T. D. Functional magnetic resonance imaging for in vivo quantification of pulmonary hypertension in the Sugen 5416/hypoxia mouse. Experimental Physiology. 102 (3), 347-353 (2017).
- Wang, Z., Schreier, D. A., Hacker, T. A., Chesler, N. C. Progressive right ventricular functional and structural changes in a mouse model of pulmonary arterial hypertension. Physiological Reports. 1 (7), 00184 (2013).
- Momcilovic, M., et al. Utilizing 18F-FDG PET/CT Imaging and Quantitative Histology to Measure Dynamic Changes in the Glucose Metabolism in Mouse Models of Lung Cancer. Journal of Visualized Experiment. (137), 57167 (2018).
- Guma, S. R., et al. Natural killer cell therapy and aerosol interleukin-2 for the treatment of osteosarcoma lung metastasis. Pediatric Blood Cancer. 61 (4), 618-626 (2014).
- Lattouf, R., et al. Picrosirius red staining: a useful tool to appraise collagen networks in normal and pathological tissues. Journal of Histochemistry and Cytochemistry. 62 (10), 751-758 (2014).
- Penumatsa, K. C., et al. Transglutaminase 2 in pulmonary and cardiac tissue remodeling in experimental pulmonary hypertension. American Journal of Physiology-Lung Cell Molecular Physiology. 313 (5), 752-762 (2017).
- Wang, Z., et al. Organ-level right ventricular dysfunction with preserved Frank-Starling mechanism in a mouse model of pulmonary arterial hypertension. Journal of Applied Physiology. 124 (5), 1244-1253 (2018).
- van de Veerdonk, M. C., Bogaard, H. J., Voelkel, N. F. The right ventricle and pulmonary hypertension. Heart Failure Reviews. 21 (3), 259-271 (2016).
- Emde, B., Heinen, A., Godecke, A., Bottermann, K. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction. European Journal of Histochemistry. 58 (4), 2448 (2014).
- Pena, S. D., Gordon, B. B., Karpati, G., Carpenter, S. Lectin histochemistry of human skeletal muscle. Journal of Histochemistry and Cytochemistry. 29 (4), 542-546 (1981).
- Bueno-Beti, C., Hadri, L., Hajjar, R. J., Sassi, Y. The Sugen 5416/Hypoxia Mouse Model of Pulmonary Arterial Hypertension. Methods in Molecular Biology. 1816, 243-252 (2018).
- Colvin, K. L., Yeager, M. E. Animal Models of Pulmonary Hypertension: Matching Disease Mechanisms to Etiology of the Human Disease. Journal of Pulmonary and Respiratory Medicine. 4 (4), (2014).
- Benza, R. L., et al. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation. 122 (2), 164-172 (2010).
- Jacob, S. W., Rosenbaum, E. E. The toxicology of dimethyl sulfoxide (DMSO). Headache. 6 (3), 127-136 (1966).
- Jacob, S. W., Wood, D. C. Dimethyl sulfoxide (DMSO). Toxicology, pharmacology, and clinical experience. American Journal of Surgery. 114 (3), 414-426 (1967).
- Abraham, D., Mao, L. Cardiac Pressure-Volume Loop Analysis Using Conductance Catheters in Mice. Journal of Visualized Experiment. (103), 52942 (2015).
- Ma, Z., Mao, L., Rajagopal, S. Hemodynamic Characterization of Rodent Models of Pulmonary Arterial Hypertension. Journal of Visualized Experiment. (110), 53335 (2016).
- Townsend, D. Measuring Pressure Volume Loops in the Mouse. Journal of Visualized Experiment. (111), 53810 (2016).
- Penumatsa, K. C., Warburton, R. R., Hill, N. S., Fanburg, B. L. CrossTalk proposal: The mouse SuHx model is a good model of pulmonary arterial hypertension. Journal of Physiology. 597 (4), 975-977 (2019).

