Utilisation de l'inégalité du modèle de course pour quantifier les effets de l'intégration multisensorielle comportementale
Summary
La présente étude vise à fournir un tutoriel étape par étape pour calculer l’ampleur des effets d’intégration multisensorielle dans un effort pour faciliter la production d’études de recherche translationnelle dans diverses populations cliniques.
Abstract
La recherche sur l’intégration multisensorielle étudie comment le cerveau traite l’information sensorielle simultanée. La recherche sur les animaux (principalement les chats et les primates) et les humains révèle que l’intégration multisensorielle intacte est cruciale pour le fonctionnement dans le monde réel, y compris les activités cognitives et physiques. Une grande partie de la recherche menée au cours des dernières décennies documente les effets d’intégration multisensorielle en utilisant diverses techniques psychophysiques, électrophysiologiques et neuroimaging. Bien que sa présence ait été signalée, les méthodes utilisées pour déterminer l’ampleur des effets d’intégration multisensorielle varient et font généralement l’objet de nombreuses critiques. Dans ce qui suit, les limites des études comportementales précédentes sont décrites et un tutoriel étape par étape pour calculer l’ampleur des effets d’intégration multisensorielle à l’aide de modèles de probabilité robustes est fourni.
Introduction
Les interactions entre les systèmes sensoriels sont essentielles pour les fonctions quotidiennes. Bien que les effets d’intégration multisensorielle soient mesurés dans un large éventail de populations à l’aide de combinaisons sensorielles assorties et de différentes approches en neurosciences [y compris, sans s’y limiter, la psychophysique, l’électrophysiologie et la neuroimagerie méthodologies]1,2,3,4,5,6,7,8,9, actuellement un étalon-or pour quantifier l’intégration multisensorielle fait défaut. Étant donné que les expériences multisensorielles contiennent généralement une composante comportementale, les données sur le temps de réaction (RT) sont souvent examinées pour déterminer l’existence d’un phénomène bien connu appelé effet signaux redondants10. Comme son nom l’indique, les signaux sensoriels simultanés fournissent des informations redondantes, qui donnent généralement des RT plus rapides. Les modèles de course et de co-activation sont utilisés pour expliquer l’effet de signaux redondants mentionné ci-dessus11. Sous les modèles de course, le signal unisensoriel qui est traité le plus rapidement est le vainqueur de la course et est responsable de la production de la réponse comportementale. Cependant, les preuves de la co-activation se produisent lorsque les réponses aux stimuli multisensoriels sont plus rapides que ce que les modèles de course prédisent.
Les versions antérieures du modèle de course sont intrinsèquement controversées12,13 comme ils sont désignés par certains comme trop conservateur14,15 et soi-disant contenir des limitations concernant l’indépendance entre les temps de détection unisensoriels constitutifs inhérents à la condition multisensorielle16. Dans un effort pour remédier à certaines de ces limitations, Colonius et Diederich16 ont mis au point un test de modèle de course plus conventionnel :
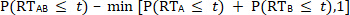 ,
,
lorsque les fréquences de distribution cumulatives (CDF) des conditions unisensorielles (p. ex., A et B; avec une limite supérieure d’un) sont comparées au CDF de la condition multisensorielle simultanée (p. ex. AB) pour une latence donnée (t)11, 16 Annonces , 17. En général, un FDC détermine la fréquence à laquelle une RT se produit, dans une gamme donnée de RT, divisée par le nombre total de présentations de stimulation (c.-à-d. les essais). Si le CDF de la 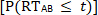 condition multisensorielle réelle est inférieur ou égal au CDF prévu dérivé des conditions unisensorielles
condition multisensorielle réelle est inférieur ou égal au CDF prévu dérivé des conditions unisensorielles
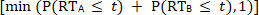 ,
,
alors le modèle de course est accepté et il n’y a aucune preuve pour l’intégration sensorielle. Cependant, lorsque le CDF multisensoriel est supérieur au CDF prévu dérivé des conditions unisensorielles, le modèle de course est rejeté. Le rejet du modèle de course indique que les interactions multisensorielles à partir de sources sensorielles redondantes se combinent d’une manière non linéaire, ce qui entraîne une accélération des RT (p. ex., la facilitation de la RT) aux stimuli multisensoriels.
L’un des principaux obstacles auxquels sont confrontés les chercheurs multisensoriels est de mieux quantifier les effets d’intégration. Par exemple, dans le cas du paradigme multisensoriel comportemental le plus fondamental, où les participants sont invités à effectuer une tâche simple de temps de réaction, des informations concernant l’exactitude et la vitesse sont recueillies. Ces données multisensorielles peuvent être utilisées à la valeur nominale ou manipulées à l’aide de diverses applications mathématiques, y compris, mais sans s’y limiter, l’estimation de probabilité maximale18,19, CDFs11, et diverses autres statistiques Approches. La majorité de nos études multisensorielles précédentes ont utilisé des approches quantitatives et probabilistes où les effets intégratifs multisensoriels ont été calculés en 1) soustrayant le temps de réaction moyen (RT) à un événement multisensoriel du temps de réaction moyen ( RT) à l’événement unisensoriel le plus court, et 2) en employant des CDF pour déterminer si la facilitation de RT a résulté des interactions synergiques facilitées par l’information sensorielle redondante8,20,21, 22 Ans , 23. Toutefois, l’ancienne méthodologie n’était probablement pas sensible aux différences individuelles dans les processus d’intégration et les chercheurs ont depuis émis l’hypothèse que la méthodologie ultérieure (c.-à-d. les FDC) pourrait fournir un meilleur indicateur de la quantification des effets intégratifs24.
Gondan et Minakata ont récemment publié un tutoriel sur la façon de tester avec précision l’inégalité du modèle de course (RMI) puisque les chercheurs font trop souvent d’innombrables erreurs au cours des étapes d’acquisition et de pré-traitement de la collecte et de la préparation des données RT25. Tout d’abord, les auteurs postulent qu’il est défavorable d’appliquer des procédures de rognage des données lorsque certaines limites minimales et maximales de RT ont été fixées. Ils recommandent que les réponses lentes et omises soient mises à l’infini, plutôt que exclues. Deuxièmement, étant donné que l’IMR peut être violé à n’importe quelle latence, plusieurs t-tests sont souvent utilisés pour tester le RMI à différents moments (c.-à-d., quantiles); malheureusement, cette pratique conduit à l’erreur accrue de type I et à une réduction substantielle de la puissance statistique. Pour éviter ces problèmes, il est recommandé que le RMI soit testé sur une plage de temps spécifique. Certains chercheurs ont suggéré qu’il est logique de tester le quartile de réponses le plus rapide (0-25 %)26 ou certaines fenêtres pré-identifiées (c.-à-d. 10-25 %)24,27, car les effets d’intégration multisensorielle sont généralement observés. pendant cet intervalle de temps; cependant, nous soutenons que la plage de centiles à tester doit être dictée par l’ensemble de données réel (voir La section protocole 5). Le problème avec le fait de s’appuyer sur les données publiées de jeunes adultes ou des simulations informatiques est que les personnes âgées manifestent des distributions de RT très différentes, probablement en raison des déclins liés à l’âge dans les systèmes sensoriels. Les tests d’importance du modèle de course ne devraient être testés que sur des parties violées (valeurs positives) de l’onde de différence moyenne du groupe entre les FDC réels et prévus de la cohorte de l’étude.
À cette fin, un effet protecteur de l’intégration multisensorielle chez les personnes âgées en bonne santé en utilisant le test conventionnel du modèle de course16 et les principes énoncés par Gondan et ses collègues25 a été démontré. En fait, une plus grande ampleur de l’IMC visuel-somatosensoriel (un proxy pour l’intégration multisensorielle) s’est avérée liée à une meilleure performance d’équilibre, à une probabilité plus faible de chutes d’incident et à une augmentation des performances de la démarche spatiale28,29.
L’objectif de l’expérience actuelle est de fournir aux chercheurs un tutoriel étape par étape pour calculer l’ampleur des effets d’intégration multisensorielle à l’aide du RMI, afin de faciliter l’augmentation de la production de diverses études de recherche translationnelle à travers populations cliniques différentes. Notez que les données présentées dans la présente étude proviennent d’expériences visuelles-somatosensorielles récemment publiées menées sur des personnes âgées en bonne santé28,29, mais cette méthodologie peut être appliquée à diverses cohortes à travers de nombreux différents conceptions expérimentales, en utilisant un large éventail de combinaisons multisensorielles.
Protocol
Representative Results
Discussion
L’objectif de la présente étude était de détailler le processus derrière l’établissement d’un phénotype d’intégration multisensorielle robuste. Ici, nous fournissons les étapes nécessaires et critiques nécessaires pour acquérir des effets d’intégration multisensorielle qui peuvent être utilisés pour prédire les résultats cognitifs et moteurs importants en s’appuyant sur des circuits neuronaux similaires. Notre objectif global était de fournir un tutoriel étape par étape pour calculer l’ampleur de l’in…
Disclosures
The authors have nothing to disclose.
Acknowledgements
L’ensemble actuel des travaux est soutenu par l’Institut national sur le vieillissement de l’Institut national de la santé (K01AG049813 à JRM). Un financement supplémentaire a été fourni par le Resnick Gerontology Center de l’Albert Einstein College of Medicine. Un merci spécial à tous les bénévoles et au personnel de recherche pour leur soutien exceptionnel dans ce projet.
Materials
| stimulus generator | Zenometrics, LLC; Peekskill, NY, USA | n/a | custom-built |
| Excel | Microsoft Corporation | spreadsheet program | |
| Eprime | Psychology Software Tools (PST) | stimulus presentation software |
References
- Foxe, J., et al. Auditory-somatosensory multisensory processing in auditory association cortex: an fMRI study. Journal of Neurophysiology. 88 (1), 540-543 (2002).
- Molholm, S., et al. Multisensory auditory-visual interactions during early sensory processing in humans: a high-density electrical mapping study. Brain Research: Cognitive Brain Research. 14 (1), 115-128 (2002).
- Murray, M. M., et al. Grabbing your ear: rapid auditory-somatosensory multisensory interactions in low-level sensory cortices are not constrained by stimulus alignment. Cerebral Cortex. 15 (7), 963-974 (2005).
- Molholm, S., et al. Audio-visual multisensory integration in superior parietal lobule revealed by human intracranial recordings. Journal of Neurophysiology. 96 (2), 721-729 (2006).
- Peiffer, A. M., Mozolic, J. L., Hugenschmidt, C. E., Laurienti, P. J. Age-related multisensory enhancement in a simple audiovisual detection task. Neuroreport. 18 (10), 1077-1081 (2007).
- Brandwein, A. B., et al. The development of audiovisual multisensory integration across childhood and early adolescence: a high-density electrical mapping study. Cerebral Cortex. 21 (5), 1042-1055 (2011).
- Girard, S., Collignon, O., Lepore, F. Multisensory gain within and across hemispaces in simple and choice reaction time paradigms. Experimental Brain Research. 214 (1), 1-8 (2011).
- Mahoney, J. R., Li, P. C., Oh-Park, M., Verghese, J., Holtzer, R. Multisensory integration across the senses in young and old adults. Brain Research. 1426, 43-53 (2011).
- Foxe, J. J., Ross, L. A., Molholm, S., Stein, B. E. Ch. 38. The New Handbook of Multisensory Processing. , 691-706 (2012).
- Kinchla, R. Detecting target elements in multielement arrays: A confusability model. Perception and Psychophysics. 15, 149-158 (1974).
- Miller, J. Divided attention: Evidence for coactivation with redundant signals. Cognitive Psychology. 14 (2), 247-279 (1982).
- Eriksen, C. W., Goettl, B., St James, J. D., Fournier, L. R. Processing redundant signals: coactivation, divided attention, or what?. Perception and Psychophysics. 45 (4), 356-370 (1989).
- Mordkoff, J. T., Yantis, S. An interactive race model of divided attention. Journal of Experimental Psychology: Human Perception and Performance. 17 (2), 520-538 (1991).
- Miller, J. Timecourse of coactivation in bimodal divided attention. Perception and Psychophysics. 40 (5), 331-343 (1986).
- Gondan, M., Lange, K., Rosler, F., Roder, B. The redundant target effect is affected by modality switch costs. Psychonomic Bulletin Review. 11 (2), 307-313 (2004).
- Colonius, H., Diederich, A. The race model inequality: interpreting a geometric measure of the amount of violation. Psychological Review. 113 (1), 148-154 (2006).
- Maris, G., Maris, E. Testing the race model inequality: A nonparametric approach. Journal of Mathematical Psychology. 47 (5-6), 507-514 (2003).
- Clark, J. J., Yuille, A. L. . Data Fusion for Sensory Information Processing Systems. , (1990).
- Ernst, M. O., Banks, M. S. Humans integrate visual and haptic information in a statistically optimal fashion. Nature. 415 (6870), 429-433 (2002).
- Mahoney, J. R., Verghese, J., Dumas, K., Wang, C., Holtzer, R. The effect of multisensory cues on attention in aging. Brain Research. 1472, 63-73 (2012).
- Mahoney, J. R., Holtzer, R., Verghese, J. Visual-somatosensory integration and balance: evidence for psychophysical integrative differences in aging. Multisensory Research. 27 (1), 17-42 (2014).
- Mahoney, J. R., Dumas, K., Holtzer, R. Visual-Somatosensory Integration is linked to Physical Activity Level in Older Adults. Multisensory Research. 28 (1-2), 11-29 (2015).
- Dumas, K., Holtzer, R., Mahoney, J. R. Visual-Somatosensory Integration in Older Adults: Links to Sensory Functioning. Multisensory Research. 29 (4-5), 397-420 (2016).
- Couth, S., Gowen, E., Poliakoff, E. Using race model violation to explore multisensory responses in older adults: Enhanced multisensory integration or slower unisensory processing. Multisensory Research. 31 (3-4), 151-174 (2017).
- Gondan, M., Minakata, K. A tutorial on testing the race model inequality. Attention, Perception & Psychophysics. 78 (3), 723-735 (2016).
- Gondan, M. A permutation test for the race model inequality. Behavior Research Methods. 42 (1), 23-28 (2010).
- Kiesel, A., Miller, J., Ulrich, R. Systematic biases and Type I error accumulation in tests of the race model inequality. Behavior Research Methods. 39 (3), 539-551 (2007).
- Mahoney, J., Cotton, K., Verghese, J. Multisensory Integration Predicts Balance and Falls in Older Adults. Journal of Gerontology: Medical Sciences. , (2018).
- Mahoney, J. R., Verghese, J. Visual-Somatosensory Integration and Quantitative Gait Performance in Aging. Frontiers in Aging Neuroscience. 10, 377 (2018).
- Yueh, B., et al. Long-term effectiveness of screening for hearing loss: the screening for auditory impairment–which hearing assessment test (SAI-WHAT) randomized trial. Journal of the American Geriatrics Society. 58 (3), 427-434 (2010).
- Galvin, J. E., et al. The AD8: a brief informant interview to detect dementia. Neurology. 65 (4), 559-564 (2005).
- Galvin, J. E., Roe, C. M., Xiong, C., Morris, J. C. Validity and reliability of the AD8 informant interview in dementia. Neurology. 67 (11), 1942-1948 (2006).
- Buschke, H., et al. Screening for dementia with the memory impairment screen. Neurology. 52 (2), 231-238 (1999).

