Formation de carbonate de calcium en présence d'additifs biopolymères
Summary
Nous décrivons un protocole pour la précipitation et la caractérisation des cristaux de carbonate de calcium qui se forment en présence de biopolymères.
Abstract
La biominéralisation est la formation de minéraux en présence de molécules organiques, souvent liées à des rôles fonctionnels et/ou structurels dans les organismes vivants. Il s’agit d’un processus complexe et, par conséquent, un système simple, in vitro, est nécessaire pour comprendre l’effet des molécules isolées sur le processus de biominéralisation. Dans de nombreux cas, la biominéralisation est dirigée par des biopolymères dans la matrice extracellulaire. Afin d’évaluer l’effet des biopolymères isolés sur la morphologie et la structure de la calcite in vitro, nous avons utilisé la méthode de diffusion de vapeur pour la précipitation du carbonate de calcium, la microscopie électronique à balayage et le micro Raman pour la caractérisation, et l’absorption ultraviolet-visible (UV/Vis) pour mesurer la quantité d’un biopolymère dans les cristaux. Dans cette méthode, nous exposons les biopolymères isolés, dissous dans une solution de chlorure de calcium, à l’ammoniac gazeux et au dioxyde de carbone qui proviennent de la décomposition du carbonate d’ammonium solide. Dans les conditions où le produit de solubilité du carbonate de calcium est atteint, le carbonate de calcium se précipite et des cristaux sont formés. Le carbonate de calcium a différents polymorphes qui diffèrent dans leur stabilité thermodynamique : carbonate de calcium amorphe, vaterite, aragonite et calcite. En l’absence de biopolymères, dans des conditions propres, le carbonate de calcium est principalement présent sous forme de calcite, qui est le polymorphe thermodynamiquement stable de carbonate de calcium. Cette méthode examine l’effet des additifs biopolymères sur la morphologie et la structure des cristaux de carbonate de calcium. Ici, nous démontrons le protocole par l’étude d’une protéine bactérienne extracellulaire, TapA, sur la formation de cristaux de carbonate de calcium. Plus précisément, nous nous concentrons sur la mise en place expérimentale, et les méthodes de caractérisation, telles que la microscopie optique et électronique ainsi que la spectroscopie Raman.
Introduction
La biominéralisation est la formation de minéraux en présence de molécules organiques, souvent liées à des rôles fonctionnels et/ou structurels dans les organismes vivants. La biominéralisation peut être intracellulaire, comme dans la formation de magnétite à l’intérieur des bactéries magnétotaxiques1, ou extracellulaires, comme dans la formation de carbonate de calcium dans les pointes d’oursins2, d’hydroxyapatite qui est liée au collagène dans os3 et de l’émail qui est associé à l’amélogénine dans les dents4. La biominéralisation est un processus complexe qui dépend de nombreux paramètres dans l’organisme vivant. Par conséquent, afin de simplifier le système à l’étude, il est nécessaire d’évaluer l’effet des composants distincts sur le processus. Dans de nombreux cas, la biominéralisation est induite par la présence de biopolymères extracellulaires. Le but de la méthode présentée ici est le suivant: (1) Pour former des cristaux de carbonate de calcium en présence de biopolymères isolés in vitro, en utilisant une méthode de diffusion de vapeur. (2) Étudier l’effet des biopolymères sur la morphologie et la structure du carbonate de calcium.
Trois méthodes principales pour précipiter le carbonate de calcium in vitro en présence d’additifs organiques sont utilisées5,6. La première méthode, que nous appellerons la méthode de solution, est basée sur le mélange d’un sel soluble de calcium (par exemple, CaCl2) avec un sel soluble de carbonate (par exemple, carbonate de sodium). Le processus de mélange peut être effectué de plusieurs façons: à l’intérieur d’un réacteur avec trois cellules qui sont séparées par des membranes poreuses7. Ici, chacune des cellules extérieures contient un sel soluble et la cellule centrale contient une solution avec l’additif à tester. Calcium et carbonate diffusent de l’extérieur à la cellule moyenne, ce qui entraîne la précipitation du carbonate de calcium moins soluble lorsque les concentrations de calcium et de carbonate dépassent leur produit de solubilité, Ksp -[Ca2′][CO 3) 2-]. Une méthode de mélange supplémentaire est la procédure de double-jet8. Dans cette méthode, chaque sel soluble est injecté à partir d’une seringue séparée à une solution agitée contenant l’additif, où le carbonate de calcium se précipite. Ici, l’injection et donc le taux de mixage est bien contrôlé, contrairement à la méthode précédente où le mélange est contrôlé par diffusion.
La deuxième méthode utilisée pour cristalliser CaCO3 est la méthode Kitano9. Cette méthode est basée sur l’équilibre carbonate/hydrogène carbonate (2HCO3– (aq) ‘ Ca 2‘ (aq) 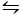 CaCO 3(s) ‘ CO 2(g) ‘ H2O (l)). Ici, le CO2 est regroupé dans une solution contenant CaCO3 sous une forme solide, déplaçant l’équilibre vers la gauche et dissolvant ainsi le carbonate de calcium. Le carbonate de calcium non dissous est filtré et les additifs désirés sont ajoutés à la solution riche en bicarbonate. Le CO2 est ensuite autorisé à s’évaporer, déplaçant ainsi la réaction vers la droite, formant du carbonate de calcium en présence des additifs.
CaCO 3(s) ‘ CO 2(g) ‘ H2O (l)). Ici, le CO2 est regroupé dans une solution contenant CaCO3 sous une forme solide, déplaçant l’équilibre vers la gauche et dissolvant ainsi le carbonate de calcium. Le carbonate de calcium non dissous est filtré et les additifs désirés sont ajoutés à la solution riche en bicarbonate. Le CO2 est ensuite autorisé à s’évaporer, déplaçant ainsi la réaction vers la droite, formant du carbonate de calcium en présence des additifs.
La troisième méthode de cristallisation du carbonate de calcium, que nous décrirarons ici, est la méthode de diffusion de vapeur10. Dans cette configuration, l’additif organique, dissous dans une solution de chlorure de calcium, est placé dans une chambre fermée près du carbonate d’ammonium sous forme de poudre. Lorsque la poudre de carbonate d’ammonium se décompose en dioxyde de carbone et en ammoniac, elle se diffuse dans la solution contenant des ions de calcium (p. ex. CaCl2), et le carbonate de calcium est précipité (voir la figure 1 pour illustrer). Les cristaux de carbonate de calcium peuvent se développer par des précipitations lentes ou par des précipitations rapides. Pour les précipitations lentes, une solution contenant l’additif dans la solution CaCl2 est placée dans un dessiccateur à côté de la poudre de carbonate d’ammonium. Dans les précipitations rapides, décrites en longueur dans le protocole, la solution additive et le carbonate d’ammonium sont rapprochés dans une plaque multi-puits. La méthode des précipitations lentes produira moins de centres de nucléation et de cristaux plus gros, et les précipitations rapides se traduiront par plus de centres de nucléation et de cristaux plus petits.
Les méthodes décrites ci-dessus diffèrent dans leur complexité technique, dans le niveau de contrôle et dans le taux du processus de précipitation. La méthode de mélange nécessite une configuration spéciale6 pour le double jet et le système à trois cellules. Dans la méthode de mélange, la présence d’autres contre-ions solubles (p. ex., Na,Cl–) 6 est inévitable, alors que dans la méthode Kitano, le calcium et le carbonate (bi) sont les seuls ions en solution et il n’implique pas la présence de contre ions (p. ex., Na,Cl–). En outre, la méthode de mélange nécessite des volumes relativement importants et, par conséquent, il n’est pas approprié pour travailler avec des biopolymères coûteux. L’avantage du double jet est qu’il est possible de contrôler le taux d’injection de solution et qu’il s’agit d’un processus rapide par rapport à d’autres méthodes.
L’avantage de la méthode Kitano et de la méthode de diffusion de vapeur est que la formation de carbonate de calcium est contrôlée par la diffusion du CO2 dans/hors d’une solution CaCl2, permettant ainsi de sonder des processus de nucléation et de précipitation plus lents 11 Ans, états-unis ( , 12. En outre, la formation de carbonate de calcium par diffusion du CO2 peut ressembler à des processus de calcification in vivo13,14,15. Dans cette méthode, des cristaux bien définis et séparés sont formés16. Enfin, l’effet d’un ou plusieurs biopolymères sur la formation de carbonate de calcium peut être testé. Cela permet une étude systématique de l’effet d’une série de concentrations additives sur la formation de carbonate de calcium ainsi qu’une étude des mélanges de biopolymères – tous effectués de manière contrôlée. Cette méthode est adaptée à une utilisation avec une large gamme de concentrations et de volumes d’additifs. Le volume minimal utilisé est d’environ 50 l et donc cette méthode est avantageuse lorsqu’il y a une quantité limitée de biopolymères disponibles. Le volume maximal dépend de l’accessibilité d’une plus grande plaque de puits, ou du dessiccateur dans lequel la plaque ou le bécher contenant CaCl2 doivent être insérés. La méthode décrite ci-dessous a été optimisée pour travailler dans une plaque de 96 puits avec un biopolymère choisi pour être la protéine TapA17.
Protocol
Representative Results
Discussion
La méthode décrite ici vise à former des cristaux de carbonate de calcium en présence d’additifs organiques et à évaluer l’effet des biopolymères organiques sur la morphologie et la structure des cristaux de carbonate de calcium in vitro. La méthode est basée sur la comparaison des cristaux formés en présence des additifs organiques aux cristaux de calcite formés dans l’expérience de contrôle. Nous avons montré comment utiliser la méthode de diffusion pour former les cristaux de carbonate de calcium, comm…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Les auteurs tient à remercier le professeur Lia Addadi, le professeur Jonathan Erez et le Dr Yael Politi pour leurs discussions fructueuses. Cette recherche a été soutenue par la Fondation israélienne pour la science (ISF), subvention 1150/14.
Materials
| Acetic acid | Gadot | 64-19-7 | |
| Ammonium carbonate | Sigma-Aldrich | 506-87-6 | |
| Calcium chloride dihydrate | Merck KGaA | 10035-04-8 | |
| Ethanol Absolute | Gadot | 64-17-5 | |
| Micro-Raman | Renishaw | inVia Reflex spectrometer coupled with an upright Leica optical microscope | |
| Microscope | Nikon | Eclipse 90i model | |
| Nis elements Br software | Nikon | For microscope imaging | |
| Scanning Electron Microscope | ThermoFisher Scientific | FEI Sirion microscope | |
| Spectrophotometer | JASCO | V-670 model | |
| Sputter coater | Polaron | SC7640 model |
References
- Blakemore, R. Magnetotactic bacteria. Science. 190 (4212), 377-379 (1975).
- Politi, Y., Arad, T., Klein, E., Weiner, S., Addadi, L. Sea Urchin Spine Calcite Forms via a Transient Amorphous Calcium Carbonate Phase. Science. 306 (5699), 1161-1164 (2004).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A. J. M., Sone, E. D. In vitro models of collagen biomineralization. Journal of Structural Biology. 183 (2), 258-269 (2013).
- Sigel, A., Sigel, H., Sigel, R. K. . Biomineralization: from nature to application. 12, (2008).
- Nielsen, M. H., Lee, J. R. I., De Yoreo, J. J. . Methods in Enzymology. 532, 209-224 (2013).
- Page, M. G., Cölfen, H. Improved Control of CaCO3 Precipitation by Direct Carbon Dioxide Diffusion: Application in Mesocrystal Assembly. Crystal Growth & Design. 6 (8), 1915-1920 (2006).
- Wang, H., Huang, W., Han, Y. Diffusion-reaction compromise the polymorphs of precipitated calcium carbonate. Particuology. 11 (3), 301-308 (2013).
- Sedlák, M., Antonietti, M., Cölfen, H. Synthesis of a new class of double-hydrophilic block copolymers with calcium binding capacity as builders and for biomimetic structure control of minerals. Macromolecular Chemistry and Physics. 199 (2), 247-254 (1998).
- Kitano, Y., Park, K., Hood, D. W. Pure aragonite synthesis. Journal of Geophysical Research. 67 (12), 4873-4874 (1962).
- Politi, Y., Mahamid, J., Goldberg, H., Weiner, S., Addadi, L. Asprich mollusk shell protein: in vitro experiments aimed at elucidating function in CaCO3 crystallization. CrystEngComm. 9 (12), 1171-1177 (2007).
- Gehrke, N., Cölfen, H., Pinna, N., Antonietti, M., Nassif, N. Superstructures of Calcium Carbonate Crystals by Oriented Attachment. Crystal Growth & Design. 5 (4), 1317-1319 (2005).
- Rudloff, J., et al. Double-Hydrophilic Block Copolymers with Monophosphate Ester Moieties as Crystal Growth Modifiers of CaCO3. Macromolecular Chemistry and Physics. 203 (4), 627-635 (2002).
- Boquet, E., Boronat, A., Ramos-Cormenzana, A. Production of Calcite (Calcium Carbonate) Crystals by Soil Bacteria is a General Phenomenon. Nature. 246, 527 (1973).
- Cohen, A. L., McConnaughey, T. A. Geochemical Perspectives on Coral Mineralization. Reviews in Mineralogy and Geochemistry. 54 (1), 151-187 (2003).
- Erez, J. Vital effect on stable-isotope composition seen in foraminifera and coral skeletons. Nature. 273, 199 (1978).
- Azulay, D. N., et al. Biopolymers from a Bacterial Extracellular Matrix Affect the Morphology and Structure of Calcium Carbonate Crystals. Crystal Growth & Design. 18 (9), 5582-5591 (2018).
- Abbasi, R., et al. The Bacterial Extracellular Matrix Protein TapA Is a Two-Domain Partially Disordered Protein. ChemBioChem. , (2018).
- Gauldie, R. W., Sharma, S. K., Volk, E. Micro-raman spectral study of vaterite and aragonite otoliths of the coho salmon, Oncorhynchus kisutch. Comparative Biochemistry and Physiology Part A: Physiology. 118 (3), 753-757 (1997).
- Gasteiger, E., et al. . The Proteomics Protocols Handbook. , 571-607 (2005).
- Gunasekaran, S., Anbalagan, G., Pandi, S. Raman and infrared spectra of carbonates of calcite structure. Journal of Raman Spectroscopy. 37 (9), 892-899 (2006).
- Trushina, D. B., Bukreeva, T. V., Kovalchuk, M. V., Antipina, M. N. CaCO3 vaterite microparticles for biomedical and personal care applications. Materials Science and Engineering: C. 45, 644-658 (2014).
- Weiss, I. M., Tuross, N., Addadi, L., Weiner, S. Mollusc larval shell formation: amorphous calcium carbonate is a precursor phase for aragonite. Journal of Experimental Zoology. 293 (5), 478-491 (2002).
- Yamamoto, Y., Nishimura, T., Saito, T., Kato, T. CaCO3/chitin-whisker hybrids: formation of CaCO3 crystals in chitin-based liquid-crystalline suspension. Polymer Journal. 42, 583 (2010).
- Magnabosco, G., et al. Insights on the interaction of calcein with calcium carbonate and its implications in biomineralization studies. CrystEngComm. 20 (30), 4221-4224 (2018).

