Formazione carbonato di calcio in presenza di additivi biopolimerici
Summary
Descriviamo un protocollo per la precipitazione e la caratterizzazione di cristalli di carbonato di calcio che si formano in presenza di biopolimeri.
Abstract
La biomineralizzazione è la formazione di minerali in presenza di molecole organiche, spesso correlate a ruoli funzionali e/o strutturali negli organismi viventi. Si tratta di un processo complesso e quindi è necessario un sistema semplice, in vitro, per comprendere l’effetto delle molecole isolate sul processo di biomineralizzazione. In molti casi, la biomineralizzazione è diretta da biopolimeri nella matrice extracellulare. Per valutare l’effetto dei biopolimeri isolati sulla morfologia e la struttura della calcite in vitro, abbiamo utilizzato il metodo di diffusione del vapore per la precipitazione del carbonato di calcio, la microscopia elettronica a scansione e il micro Raman per la caratterizzazione, e assorbimento visibile all’ultravioletto (UV/Vis) per misurare la quantità di un biopolimero nei cristalli. In questo metodo esponiamo i biopolimeri isolati, disciolti in una soluzione di cloruro di calcio, in ammoniaca gassosa e anidride carbonica che derivano dalla decomposizione del carbonato di ammonio solido. Nelle condizioni in cui viene raggiunto il prodotto di solubilità del carbonato di calcio, si formano precipitati e cristalli di carbonato di calcio. Il carbonato di calcio di calcio ha diversi polimorfi che differiscono nella loro stabilità termodinamica: carbonato di calcio amorfo, vaterite, aragonite e calcite. In assenza di biopolimeri, in condizioni pulite, il carbonato di calcio è presente principalmente nella forma di calcite, che è il polimorfo più termodinamicamente stabile del carbonato di calcio. Questo metodo esamina l’effetto degli additivi biopolimerici sulla morfologia e la struttura dei cristalli di carbonato di calcio. Qui, dimostriamo il protocollo attraverso lo studio di una proteina batterica extracellulare, TapA, sulla formazione di cristalli di carbonato di calcio. In particolare, ci concentriamo sull’impostazione sperimentale e sui metodi di caratterizzazione, come la microscopia ottica ed elettronica e la spettroscopia Raman.
Introduction
La biomineralizzazione è la formazione di minerali in presenza di molecole organiche, spesso correlate a ruoli funzionali e/o strutturali negli organismi viventi. La biomineralizzazione può essere intracellulare, come nella formazione di magnetite all’interno di batteri magnetotattici1, o extracellulare, come nella formazione di carbonato di calcio nei picchi di riccio di mare2, di idrossiapatite che è correlato con collagene in ossa3 e di smalto che è associato con amelogenin adenti4. La biomineralizzazione è un processo complesso che dipende da molti parametri nell’organismo vivente. Pertanto, al fine di semplificare il sistema in esame, è necessario valutare l’effetto di componenti separati sul processo. In molti casi, la biomineralizzazione è indotta dalla presenza di biopolimeri extracellulari. Lo scopo del metodo qui presentato è il seguente: (1) Formare cristalli di carbonato di calcio in presenza di biopolimeri isolati in vitro, utilizzando un metodo di diffusione del vapore. (2) Studiare l’effetto dei biopolimeri sulla morfologia e la struttura del carbonato di calcio.
Tre metodi principali per precipitare carbonato di calcio in vitro in presenza di additivi organici sono utilizzati5,6. Il primo metodo, che ci riferiremo come il metodo della soluzione, si basa sulla miscelazione di un sale solubile di calcio (ad esempio, CaCl2) con un sale di carbonato solubile (ad esempio, carbonato di sodio). Il processo di miscelazione può essere eseguito in diversi modi: all’interno di un reattore con tre cellule separate da membrane porose7. Qui, ciascuna delle cellule esterne contiene un sale solubile e la cella centrale contiene una soluzione con l’additivo da testare. Calcio e carbonato si diffondono dall’esterno alla cellula centrale, causando la precipitazione del carbonato di calcio meno solubile quando le concentrazioni di calcio e carbonato superano il loro prodotto di sobrietà, Ksp 2-]. Un ulteriore metodo di miscelazione è la procedura a doppio getto8. In questo metodo, ogni sale solubile viene iniettato da una siringa separata a una soluzione mescolata contenente l’additivo, dove precipita il carbonato di calcio. Qui, l’iniezione e quindi il tasso di miscelazione è ben controllato, in contrasto con il metodo precedente in cui la miscelazione è controllata dalla diffusione.
Il secondo metodo utilizzato per cristallizzare CaCO3 è il metodo Kitano9. Questo metodo si basa sull’equilibrio carbonato/idrogeno carbonato (2HCO3– (aq) – Ca2′(aq) 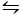 CaCO 3(s) – CO 2(g) – H2O (l)). Qui, CO2 viene bollato in una soluzione contenente CaCO3 in una forma solida, spostando l’equilibrio a sinistra e quindi sciogliendo il carbonato di calcio. Il carbonato di calcio non disciolto viene filtrato e gli additivi desiderati vengono aggiunti alla soluzione ricca di bicarbonato. Co2 è quindi lasciato evaporare, spostando così la reazione a destra, formando carbonato di calcio in presenza degli additivi.
CaCO 3(s) – CO 2(g) – H2O (l)). Qui, CO2 viene bollato in una soluzione contenente CaCO3 in una forma solida, spostando l’equilibrio a sinistra e quindi sciogliendo il carbonato di calcio. Il carbonato di calcio non disciolto viene filtrato e gli additivi desiderati vengono aggiunti alla soluzione ricca di bicarbonato. Co2 è quindi lasciato evaporare, spostando così la reazione a destra, formando carbonato di calcio in presenza degli additivi.
Il terzo metodo di cristallizzazione carbonata di calcio, che descriveremo qui, è il metodo di diffusione del vapore10. In questo set-up, l’additivo organico, sciolto in una soluzione di cloruro di calcio, viene posto in una camera chiusa vicino al carbonato di ammonio in forma di polvere. Quando la polvere di carbonato di ammonio si decompone in anidride carbonica e ammoniaca, si diffondono nella soluzione contenente ioni di calcio (ad esempio, CaCl2), e il carbonato di calcio è precipitato (vedere la figura 1 a illustrazione). I cristalli di carbonato di calcio possono crescere da precipitazioni lente o da precipitazioni veloci. Per la lenta precipitazione, una soluzione contenente l’additivo nella soluzione CaCl2 viene posta in un desiccatore accanto alla polvere di carbonato di ammonio. Nella precipitazione veloce, descritta in lunghezza nel protocollo, sia la soluzione additiva che il carbonato di ammonio vengono posizionati più vicini in una piastra multi-bene. Il metodo di precipitazione lenta produrrà meno centri di nucleazione e cristalli più grandi, e la precipitazione veloce si tradurrà in più centri di nucleazione e cristalli più piccoli.
I metodi sopra descritti differiscono nella loro complessità tecnica, nel livello di controllo e nella velocità del processo di precipitazione. Il metodo di miscelazione richiede un set-up speciale6 sia per il doppio getto che per il sistema a tre celle. Nel metodo di miscelazione, la presenza di altri controioni solubili (ad es., Na,Cl–)6 è inevitabile, mentre nel metodo Kitano, il calcio e il (bi) carbonato sono gli unici ioni in soluzione e non comporta la presenza di ulteriori ioni contatore (ad es., Na,Cl–). Inoltre, il metodo di miscelazione richiede volumi relativamente grandi e quindi non è adatto per lavorare con biopolimeri costosi. Il vantaggio del doppio getto è che è possibile controllare la velocità di iniezione della soluzione e che si tratta di un processo rapido rispetto ad altri metodi.
Il vantaggio del metodo Kitano e del metodo di diffusione del vapore è che la formazione di carbonato di calcio è controllata dalla diffusione di CO2 in una soluzione CaCl2, permettendo così di sondare processi di nucleazione e precipitazioni più lenti 11 Del sistema di , 12. Inoltre, la formazione di carbonato di calcio per diffusione di CO2 può assomigliare ai processi di calcificazione in vivo13,14,15. In questo metodo, i cristalli ben definiti e separati sono formati16. Infine, è possibile testare l’effetto di biopolimeri singoli o multipli sulla formazione di carbonato di calcio. Ciò consente uno studio sistematico dell’effetto di una serie di concentrazioni additive sulla formazione di carbonato di calcio, nonché uno studio di miscele di biopolimeri – il tutto eseguito in modo controllato. Questo metodo è adatto per l’uso con una vasta gamma di concentrazioni e volumi di additivi. Il volume minimo utilizzato è di circa 50 gradi e quindi questo metodo è vantaggioso quando c’è una quantità limitata di biopolimeri disponibili. Il volume massimo dipende dall’accessibilità di un pozzo più grande o dal desiccatore in cui devono essere inseriti la piastra o il becher contenente CaCl 2. Il metodo descritto di seguito è stato ottimizzato per lavorare in una piastra di 96 pozze con un biopolimero scelto per essere la proteina TapA17.
Protocol
Representative Results
Discussion
Il metodo qui descritto è volto a formare cristalli di carbonato di calcio in presenza di additivi organici e a valutare l’effetto dei biopolimeri organici sulla morfologia e la struttura dei cristalli di carbonato di calcio in vitro. Il metodo si basa sul confronto dei cristalli formati in presenza degli additivi organici ai cristalli di calcite formati nell’esperimento di controllo. Abbiamo dimostrato come utilizzare il metodo di diffusione per formare i cristalli di carbonato di calcio, come caratterizzare la loro mo…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Gli autori ringraziano il professor Lia Addadi, il professor Jonathan Erez e il dr. Yael Politi per le fruttuose discussioni. Questa ricerca è stata sostenuta dalla Israeli Science Foundation (ISF), sovvenzione 1150/14.
Materials
| Acetic acid | Gadot | 64-19-7 | |
| Ammonium carbonate | Sigma-Aldrich | 506-87-6 | |
| Calcium chloride dihydrate | Merck KGaA | 10035-04-8 | |
| Ethanol Absolute | Gadot | 64-17-5 | |
| Micro-Raman | Renishaw | inVia Reflex spectrometer coupled with an upright Leica optical microscope | |
| Microscope | Nikon | Eclipse 90i model | |
| Nis elements Br software | Nikon | For microscope imaging | |
| Scanning Electron Microscope | ThermoFisher Scientific | FEI Sirion microscope | |
| Spectrophotometer | JASCO | V-670 model | |
| Sputter coater | Polaron | SC7640 model |
References
- Blakemore, R. Magnetotactic bacteria. Science. 190 (4212), 377-379 (1975).
- Politi, Y., Arad, T., Klein, E., Weiner, S., Addadi, L. Sea Urchin Spine Calcite Forms via a Transient Amorphous Calcium Carbonate Phase. Science. 306 (5699), 1161-1164 (2004).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A. J. M., Sone, E. D. In vitro models of collagen biomineralization. Journal of Structural Biology. 183 (2), 258-269 (2013).
- Sigel, A., Sigel, H., Sigel, R. K. . Biomineralization: from nature to application. 12, (2008).
- Nielsen, M. H., Lee, J. R. I., De Yoreo, J. J. . Methods in Enzymology. 532, 209-224 (2013).
- Page, M. G., Cölfen, H. Improved Control of CaCO3 Precipitation by Direct Carbon Dioxide Diffusion: Application in Mesocrystal Assembly. Crystal Growth & Design. 6 (8), 1915-1920 (2006).
- Wang, H., Huang, W., Han, Y. Diffusion-reaction compromise the polymorphs of precipitated calcium carbonate. Particuology. 11 (3), 301-308 (2013).
- Sedlák, M., Antonietti, M., Cölfen, H. Synthesis of a new class of double-hydrophilic block copolymers with calcium binding capacity as builders and for biomimetic structure control of minerals. Macromolecular Chemistry and Physics. 199 (2), 247-254 (1998).
- Kitano, Y., Park, K., Hood, D. W. Pure aragonite synthesis. Journal of Geophysical Research. 67 (12), 4873-4874 (1962).
- Politi, Y., Mahamid, J., Goldberg, H., Weiner, S., Addadi, L. Asprich mollusk shell protein: in vitro experiments aimed at elucidating function in CaCO3 crystallization. CrystEngComm. 9 (12), 1171-1177 (2007).
- Gehrke, N., Cölfen, H., Pinna, N., Antonietti, M., Nassif, N. Superstructures of Calcium Carbonate Crystals by Oriented Attachment. Crystal Growth & Design. 5 (4), 1317-1319 (2005).
- Rudloff, J., et al. Double-Hydrophilic Block Copolymers with Monophosphate Ester Moieties as Crystal Growth Modifiers of CaCO3. Macromolecular Chemistry and Physics. 203 (4), 627-635 (2002).
- Boquet, E., Boronat, A., Ramos-Cormenzana, A. Production of Calcite (Calcium Carbonate) Crystals by Soil Bacteria is a General Phenomenon. Nature. 246, 527 (1973).
- Cohen, A. L., McConnaughey, T. A. Geochemical Perspectives on Coral Mineralization. Reviews in Mineralogy and Geochemistry. 54 (1), 151-187 (2003).
- Erez, J. Vital effect on stable-isotope composition seen in foraminifera and coral skeletons. Nature. 273, 199 (1978).
- Azulay, D. N., et al. Biopolymers from a Bacterial Extracellular Matrix Affect the Morphology and Structure of Calcium Carbonate Crystals. Crystal Growth & Design. 18 (9), 5582-5591 (2018).
- Abbasi, R., et al. The Bacterial Extracellular Matrix Protein TapA Is a Two-Domain Partially Disordered Protein. ChemBioChem. , (2018).
- Gauldie, R. W., Sharma, S. K., Volk, E. Micro-raman spectral study of vaterite and aragonite otoliths of the coho salmon, Oncorhynchus kisutch. Comparative Biochemistry and Physiology Part A: Physiology. 118 (3), 753-757 (1997).
- Gasteiger, E., et al. . The Proteomics Protocols Handbook. , 571-607 (2005).
- Gunasekaran, S., Anbalagan, G., Pandi, S. Raman and infrared spectra of carbonates of calcite structure. Journal of Raman Spectroscopy. 37 (9), 892-899 (2006).
- Trushina, D. B., Bukreeva, T. V., Kovalchuk, M. V., Antipina, M. N. CaCO3 vaterite microparticles for biomedical and personal care applications. Materials Science and Engineering: C. 45, 644-658 (2014).
- Weiss, I. M., Tuross, N., Addadi, L., Weiner, S. Mollusc larval shell formation: amorphous calcium carbonate is a precursor phase for aragonite. Journal of Experimental Zoology. 293 (5), 478-491 (2002).
- Yamamoto, Y., Nishimura, T., Saito, T., Kato, T. CaCO3/chitin-whisker hybrids: formation of CaCO3 crystals in chitin-based liquid-crystalline suspension. Polymer Journal. 42, 583 (2010).
- Magnabosco, G., et al. Insights on the interaction of calcein with calcium carbonate and its implications in biomineralization studies. CrystEngComm. 20 (30), 4221-4224 (2018).

