Динамические цифровые биомаркеры двигательных и когнитивных функций при болезни Паркинсона
Summary
Этот протокол предлагает оцифровку части традиционных клинических задач, обычно используемых для измерения познания и двигательного контроля при болезни Паркинсона. Клинические задачи оцифровываются, в то время как биофизические ритмы регистрируются из различных функциональных уровней нервной системы, начиная от добровольных, спонтанных, автоматических до вегетативных.
Abstract
Поскольку болезнь Паркинсона (PD) является неоднородным расстройством, персонализированная медицина действительно требуется для оптимизации ухода. В их нынешнем виде, стандартные баллы из бумаги и карандаша симптом-меры традиционно используются для отслеживания прогрессирования заболевания слишком грубые (дискретные), чтобы захватить детализации клинических явлений, рассматриваемых, в условиях огромного симптома Разнообразия. По этой причине датчики, носимые устройства и мобильные устройства все чаще включаются в исследования и рутинную помощь в области PD. Эти цифровые меры, хотя и более точные, дают данные, которые менее стандартизированы и интерпретируются по мимо традиционных мер, и, следовательно, эти два типа данных остаются в значительной степени разрозненными. Оба эти вопроса являются барьерами для широкого клинического применения наиболее точных инструментов оценки на местах. Этот протокол решает обе проблемы. Используя традиционные задачи для измерения познания и управления двигателем, мы тестируем участника, в то время как совместное регистрация биофизических сигналов ненавязчиво с использованием носимых. Затем мы интегрируем оценки из традиционных бумажных и карандашных методов с цифровыми данными, которые мы постоянно регистрируем. Мы предлагаем новый стандартизированный тип данных и объединяющую статистическую платформу, которая позволяет динамическое отслеживание изменений в стохастической подписи человека в различных условиях, которые зондируют различные функциональные уровни нейромоторного контроля, начиная от добровольный к вегетативным. Протокол и стандартизированная статистическая основа предлагают динамические цифровые биомаркеры физической и когнитивной функции в PD, которые соответствуют проверенным клиническим масштабам, значительно повышая их точность.
Introduction
Точность медицины (PM) (Рисунок 1) стала мощной платформой для разработки персонализированных целевых методов лечения. В области исследований рака, эта модель была очень успешной и ее принципы обязаны революционизировать медицинской области в ближайшем будущем1. PM сочетает в себе несколько уровней знаний, начиная от самоотчетов пациентов и конъюнционизмом. Интеграция информации во всех этих слоях приводит к персонализированной оценке, которая позволяет интерпретировать данные и более точные рекомендации по лечению, направленные на рассмотрение всех аспектов жизни человека.
Есть несколько проблем при попытке адаптировать платформу PM к нейропсихиатрическим и неврологическим расстройствам нервной системы2,3, и эти проблемы недавно были озвучены4. К их числу относятся различия в полученных данных, а именно дискретные оценки от клинических методов карандаша и бумаги, управляемых наблюдением, и непрерывные биофизические данные, физически полученные из нервной системы (например, с использованием биосенсоров). Данные из клинических оценок, как правило, предполагают одноразмерную все статическую модель, которая обеспечивает соблюдение одной (теоретической) функции распределения вероятностей (PDF). Это априорное предположение налагается на данные без надлежащей эмпирической проверки, поскольку нормативные данные не были получены и не охарактеризованы в первую очередь. Таким образом, нет надлежащего сходства-метрических критериев, описывающих нейротипичные матурациональные состояния нервной системы человека, как здоровый человек стареет и вероятностные пространства, используемые для отбрасывая эти параметры изменения сдвиг с определенной скоростью. Без нормативных данных и надлежащих метрик сходства невозможно измерить отклонения от типичных состояний, поскольку они динамически меняются по всей жизни человека. Также невозможно предсказать сенсорные последствия предстоящих изменений.
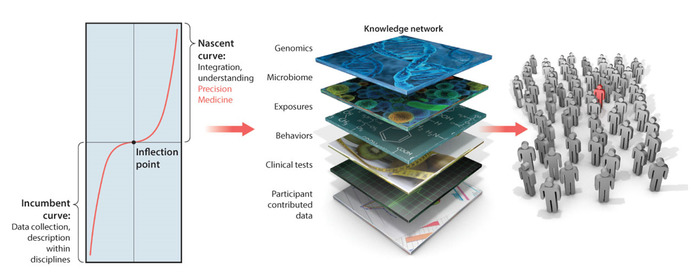
Рисунок 1: Платформа точной медицины: Заполнение разрыва между поведением и геномикой, чтобы обеспечить целенаправленное развитие лечения в персонализированной медицине, переведенном на неврологические и нейропсихиатрические расстройства нервной системы. Платформа точной медицины для разработки персонализированного целевого лечения может быть переведена для диагностики и лечения неврологических и нейропсихиатрических расстройств нервной системы. Однако в сети знаний уровень поведенческого анализа нуждается в смене парадигмы для интеграции новых новых цифровых исходов из биофизических данных с более традиционными клиническими критериями. Перед нами стоит задача обеспечить статистически обоснованные методы и новые интуитивно понятные инструменты визуализации для такой интеграции, поощряя при этом использование цифровых показателей результатов врачами, пациентами и воспитателями. Эта цифра была изменена с Hawgood и др.1 с разрешения Американской ассоциации содействия развитию науки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Текущий подход«большой усреднения»сглаживается как шум стохасических колебаний индивидуума в данных, т.е. вариабельность сигнала, которая проявляется по мере естественного возраста человека, по мере развития расстройства, и как нервные системы человека получать и реагировать на лечение. Отсутствие нормативных данных (т.е. оценка больших сечений и продольных частей здорового населения) мешает нам понять нейротипическую динамику здорового старения. Таким образом, это становится проблемой, чтобы знать, как в целом предвидеть последствия данной патологии, так как эта патология начинает системно проявляться в человеке. Прогностические подходы имеют решающее значение для разработки регенеративных методов лечения и / или нейропротекторных методов лечения, которые замедляют дегенеративный процесс. Болезнь Паркинсона является хорошим примером патологий, при которых проявлениям расстройства предшествуют многие другие измеримые симптомы. Мы знаем сегодня, что видимые двигательные расстройства предшествовали менее заметные сенсорные проблемы, такие как уменьшение обонятельной функции5,6, изменения в речевых моделях, быстрое движение глаз (REM) сон7, и другие немоторные симптомы, связанные с функционированием энтерической нервной системы8. К тому времени, расстройство проявляется, уже существует высокая дофаминергическое истощение в системе; но немоторные симптомы могли бы спрогнозировать некоторые из видимых двигательных нарушений, с помощью которых расстройство в настоящее время в первую очередь оценивается.
Необходимо изменить существующие аналитические модели и рассмотреть важность правильной характеристики эмпирических данных на всех уровнях нервной системы, в результате чего биоритмические движения проявляются и могут быть динамически использованы в виде временных рядов совместно зарегистрированных с множеством датчиков. Данные движения в более общем смысле не должны ограничиваться движениями и нарушениями, которые они транслируют. Цифровые данные из всех биоритмов нервной системы (включая недвигательные волны) предлагают потенциал прогнозирования, который нам может понадобиться, чтобы помочь предотвратить или замедлить быструю нейродегенерацию. Тем не менее, по мере расширения нашего репертуара типов данных, мы должны избегать присущих параметрических линейных моделей для статистического анализа и интерпретации, используемых в настоящее время для анализа таких данных. Крайне важно оценить адекватность таких линейных моделей для типов высоколинейных проблем, которые мы изучаем при патологиях нервной системы, подверженных стохасическим сдвигам и динамическим изменениям. Пещеры в текущих петлях трубопровода предположений-анализа присутствуют в обоих типах данных, используемых: те из дискретных клинических оценок и из непрерывных цифровых биофизических волновых форм. Хотя они по-прежнему отключены, важно разработать новые рамки, которые позволят обеспечить надлежащую интеграцию обоих типов данных таким образом, чтобы привести цифровые исходы в соответствие с клиническими критериями для облегчения использования пациентов новых цифровых технологий, воспитатели и врачи.
Чтобы преодолеть некоторые из этих проблем, мы недавно адаптировали платформу PM на рисунке 1 для обеспечения точности фенотипирования для неврологических и нейропсихиатрических состояний3. С этой целью мы разработали новый способ сбора, анализа и интерпретации поведенческих данных в тандеме с традиционными клиническими скоринговых тестами, которые устанавливают сложные отношения между когнитивными и двигательными явлениями. Точнее, мы оцифровали карандашно-бумажные методы. Данные только от таких методов слишком грубы, чтобы захватить важную информацию, ускользающую невооруженным глазом. Но их использование в сочетании с цифровыми данными от биофизических датчиков предлагает новый путь для подключения новых новых цифровых технологий с клиническими критериями, поддающимися поощрению клиницистов принять их в ближайшем будущем.
Здесь мы вводим использование цифровых данных в контексте клинических оценок. А именно, как человек выполняет клиническую задачу, например, рисунок часы в Монреале когнитивной оценки (MoCA) тест, биоритмы вывода нервной системы совместно зарегистрированы в различных функциональных слоев. К ним относятся электроэнцефалография (ЭЭГ), электрокардиография (ЭКГ или ЭКГ), голосовые узоры и кинематики из тела, а также кинематический выход из ручной ручки, которую человек использует, чтобы нарисовать часы на оцифрованном планшете. Мы также собираем видео данные с лица, как человек рисует, для выполнения анализа чувств прогнозирования эмоциональных состояний. Эти данные затем анализируются с помощью оптики новой статистической платформы для индивидуального поведенческого анализа (SPIBA) и интерпретируются в соответствии с клиническими критериями, лежащими в основе таких тестов. Более конкретно, дискретные оценки используются для среднего ранга когорты пациентов и таким образом, стратифицировать группу на основе этих клинических критериев. Затем мы можем изучить непрерывные биофизические данные групп, идентифицированных таким образом, в поисках стохастических критериев, которые принципиально отделяют одно подмножество пациентов от другого, в более чем одном параметрическом измерении. Кроме того, изучая непрерывные биофизические данные в своем собственном праве, в соответствии с присущими колебаниям каждого человека в когорте и ослепленных от клинических критериев, мы можем искать самовозникающие кластеры в когорте, и сравнить степени, в которой такие кластеры карту на те, что подтипы, информируется клинических критериев показали.
Этот подход предлагает новый способ определения параметров в богатстве биофизических цифровых данных, что наиболее эффективно захватить различия между подтипами и делает эти различия в качестве потенциально хороших кандидатов для расслоения пациентов с болезнью Паркинсона болезни (PWP) в слепых, т.е. через случайные обратить от населения в целом. Актуальность этого метода двоякая. Мы действительно можем персонализировать методы лечения, при этом правильно интегрируя разрозненные типы данных из биосенсоров и клинических критериев; т.е. непрерывные цифровые биофизические данные в виде временных рядов и дискретные клинические оценки традиционных тестов.
Хотя это общий подход, применимый ко всем нарушениям нервной системы, мы рамкировать работу в контексте PWP и предлагаем новые способы сделать статистические выводы о непрерывных цифровых данных, зарегистрированных во время выполнения таких клинические испытания с учетом дискретной клинической системы скоринга. Таким образом, работа позволяет клинической интерпретации цифровых результатов, которые могут быть использоваться в клинических условиях. Наконец, мы предоставляем рекомендации, чтобы начать разработку новых способов визуализации таких индивидуальных результатов для встраивания в новые приложения для удобства использования в домашних и клинических условиях пациентов, воспитателей и клинического персонала, так.
Protocol
Representative Results
Discussion
Эта работа вводит новый протокол, который позволяет интегрировать традиционные клинические тесты с цифровыми данными из биофизических сигналов, выдавливихся нервной системой, когда человек выполняет такие тесты. Мы внедряем использование SPIBA и MMS в качестве объединяющей платформы для объединения разрозненных типов данных, таких как дискретные оценки от карандашно-бумажных методов наблюдения и непрерывные цифровые данные с биофизических датчиков. Методы иллюстрируются с использованием когорты PWP и возрастных и половых элементов управления, с дополнительным молодым контролем в качестве идеального здорового эталона для сравнения. Мы показываем, что традиционные клинические испытания (например, те, которые могут быть частью MoCA и MDS-UPDRS) могут быть использованы для медианного ранга когорты и автоматически извлечь, из присущей изменчивости оценки группы, информации, которая стратифицирует данные в цифровом области в соответствии с клинически определенными уровнями тяжести. Такие уровни хорошо согласуются с уровнями клинической MDS-UPDRS и когнитивной / памяти тест производительности. На другом уровне реализации мы исследуем биоритмы нервной системы, запряженные из слоев ЦНС, PNS и ANS, тем самым характеризуя различные уровни автономности и контроля. Мы предоставляем выборочные данные и стохастические сигнатуры, полученные из таких данных, исследуемые с помощью оптики клинических критериев. При таком подходе мы можем отличать пациентов от здорового контроля; и с помощью цифровых биоритмов, дифференцировать в рамках PWP, на их клинически определенных уровней тяжести.
Выравнивая таким образом биофизические цифровые данные с клиническими критериями, мы предоставляем интерпретируемый набор критериев, которые могут более динамично отслеживать индивидуальные сдвиги в исходах. Мы формулируем эти новые результаты динамических цифровых биомаркеров, потому что они основаны на цифровых данных, но они обеспечивают интерпретируемые результаты в соответствии с хорошо установленными и проверенными клиническими критериями. Они являются производными от временных рядов процессов нервной системы, и они захватывают динамический характер таких. В частности, мы можем использовать как двигательные, так и немоторные критерии. Таким образом, мы можем начать количественно немоторных аспектов PD, которые в настоящее время известно, предшествуют ухудшению двигательных симптомов, которые обычно определили расстройство до сих пор. Например, анализ лица, такие как представленные здесь, может быть использован для изучения спонтанных микро-жестов лица во время сна REM, чтобы построить репертуар тех, которые могли бы предсказать ухудшение двигательной активности. Аналогичным образом, мы могли бы использовать эти методы для изучения уровня боли во время повседневной деятельности и оценить их потенциальные коррелирует с деятельностью во время времени сна REM. Это важно, потому что как REM сна и боли дисрегуляции, как известно, предшествуют двигательных вопросов позже определения уровня тяжести PD5,6,7. Используя нашу оцифровку различных традиционных клинических задач, другие немоторные действия, встроенные в клинические задачи, используемые для зондирования когнитивных и память способностей были охарактеризованы здесь, и индексы такой деятельности отображаются на двигательные симптомы. Эти методы поддаются для подключения фундаментальных исследований и клинической практики в болезни Паркинсона. Они также могут быть распространены на другие расстройства нервной системы.
Кроме того, двигатель выход из лица, во время сна REM, мы можем изучить лицевые жесты во время естественных социальных ситуаций в рамках самочувствия или кинестетической реафференции для оценки уровня reafferent обратной связи мозга пациента, скорее всего, получает. Здесь, несмотря на очень тонкие различия в микро-жестах по зонам лица, соответствующим тройничным афферентным областям V1, V2, V3, можно было определить в репрезентативном участнике, в какой области лица максимально сместился стохастические подписи при переходе между нейтральными и естественно улыбающимися состояниями. Это говорит о том, что с помощью SPIBA и MMS мы сможем оценить другие немоторные (сенсорные) аспекты PD, связанные с трудностями с сенсорным ввозам из кинестетических сенсорных каналов. Они были признаны проблематичным в PD, даже на ранних стадиях расстройства24. Потому что сенсорные и двигатель идут рука об руку, эта информация может помочь нам прогнозировать более очевидные проблемы двигателя наплавки позже в прогрессии этого расстройства1,7. Мы считаем, что эти кинестетические каналы вдоль тройничных областей лица может также помочь нам разъединить различные виды боли дисрегуляции, в том числе связанные с изменениями сна5,6.
Современные методы обеспечивают новый способ изучения биофизических сигналов, полученных из центральной, периферической и вегетативной нервной системы в тандеме, в различных условиях, требующих различных когнитивных навыков и различных уровней автономии и нейромоторный контроль. Используя рамки SPIBA, где стохастический анализ и парный сетевой анализ применяются на стандартизированных данных MMS, можно также объективно охарактеризовать когнитивную деятельность. Пятнадцать задач, которые были использованы в этом эксперименте, требуют различных типов когнитивных навыков (например, висуо-констративные навыки, зрительная память, навыки сканирования восприятия) и различные уровни когнитивного контроля (например, намеренно темп указывая скорость, темп дыхания, как указано). По этой причине стохастичность и модели подключения информации CNS-PNS-ANS, проявляющиеся в ходе выполнения этих задач, могут использоваться для характеристики различных уровней когнитивных нагрузок и их влияния на двигательную мощность.
Подчеркивая преимущества наших новых аналитических методов и протоколов, мы также отмечаем оговорки и практические ограничения, которые следует учитывать при принятии нашей платформы записи для синхронного сбора данных. Это потому, что в этой настройке, Есть несколько типов записи программного обеспечения потокового на одном компьютере для целей синхронизации, требуя вычислительной мощности компьютера, чтобы быть высоким, иначе можно было бы понести потерю данных, замораживание компьютера и / или избыток Шум. В текущем дизайне два потокового программного обеспечения (EEG и захват движения) и LSL были запущены на одном компьютере. Таким образом, мы должны были помнить о обработке перегрузки и возможного замораживания компьютера. Это было одной из причин, почему мы использовали один из каналов ЭЭГ для извлечения сигналов ЭКГ. Компьютеры с более высокой емкостью памяти и более быстрыми процессорами могут обрабатывать отдельное программное обеспечение ЭКГ одновременно потоковой передачи с ЭЭГ и датчик сетки кинематики. Эти вопросы носят практический характер и не зависят от аналитических методов (SPIBA) и стандартных типов данных (MMS), которые мы предлагаем. Тем не менее, мы считаем важным предупредить конечного пользователя о необходимости оценки вычислительной мощности перед разработкой протокола для совместной регистрации данных из нескольких потоков.
Еще одно предостережение, которое мы уток видим, состоит в том, что 15 задач, иллюстрированных в протоколе, представляют собой подмножество того, что может быть использовано для разработки динамических цифровых биомаркеров. Для целей настоящего документа мы ограничились несколькими задачами из-за ограниченности пространства и выбрали те, которые включали различные уровни контроля и движения тела, и действительно, мы можем добавить другие задачи, не включенные в этот документ. Наша цель состоит в том, чтобы получить меньший подмножество задач, которые потребуют меньше времени и усилий. В самом деле, из нашей лаборатории, указывая задачи (задачи 10 х 12) представляют собой набор задач, которые мы обнаружили, чтобы быть эффективным и эффективным способом охарактеризовать стохастические подписи биоритмов варьируются от различных уровней добровольного контроля и неврологических расстройств, в том числе PD 24 , 30.
Репрезентативные результаты, показанные в этом исследовании, представляют собой небольшое подмножество того, что можно сделать с наборами данных MMS, полученных из биосенсоров волновых форм и подписи к движению камер, с использованием методов SPIBA. Для иллюстративных целей, мы рассмотрели MMS в амплитуде и сосредоточены на колебаниях в линейной амплитуда скорости, полученных из COM человека. COM представляет собой сводный сигнал от всех 17 датчиков тела сетки, которые мы совместно зарегистрированы. Однако мы могли бы распространить анализ на другие параметры вращения, а также на другие кинетические переменные (например, силы и давление), которые генерируют временные ряды колеблющихся параметров (например, как это было с данными лица). Кроме того, из-за ограничения пространства, мы только проиллюстрировали анализ данных ЭЭГ на основе информации об амплитуде головы, но мы также можем применить эти аналитики к данным, полученным из исходного пространства31. Для всех режимов данных, мы могли бы также изучить stochasticity времени между пиками (вместо пиковой амплитуды), которые также генерируют временные ряды. Другие временные ряды параметров могут быть получены из таких волновых форм, и их MMS могут быть использованы для установления сплоченности и подключения от сети, которая была построена32,33,34. Кроме того, эти анализы могут быть также расширены до области частоты 34. В дополнение к взаимному анализу информационной сети, мы могли бы сосредоточиться на других топологических особенностях сети, чтобы дифференцировать PWP и элементы управления и расслоить PWP. Для целей настоящего документа мы сосредоточимся на полезности этих аналитиков в качестве инструмента, но с помощью такого рода характеристик мы получим знания, чтобы обеспечить клинически информированные интерпретации цифровых данных, которые предоставляют эти аналитические инструменты.
Современные методы, описанные в данном исследовании, служат для внедрения некоторых из многих возможных способов применения SPIBA и MMS для клинической и цифровой интеграции данных. Мы предлагаем эту объединяющую платформу, стандартизированный тип данных и экспериментальный протокол в надежде, наконец, информировать цифровые данные о клинических критериях, а также добавить больше точности от цифровых данных к традиционным карандашом и бумагой методов. Такое улучшение будет 1) позволяют более точное отслеживание изменения симптомов в ответ на лечение, 2) повысить понимание естественной прогрессии PD с течением времени, и 3) способствовать стратификации PD симптом аттериции (которые могут диктовать уникальные клинические рекомендации для каждой подгруппы). Таким образом, мы надеемся применить эти методы для дальнейших исследований в PD, но и увидеть полезность в клиническом применении, а также. Используя коммерческие устройства, такие как мобильные телефоны, биофизические данные могут быть получены для выполнения аналитики, которую мы проиллюстрировали в настоящей статье. В настоящее время предпринимаются усилия по сбору таких цифровых данных в более широком масштабе, таких как исследование приложения mPower из Рочестерского университета (https://parkinsonmpower.org) и Kaggle. Действительно, используя эти хранилища данных с открытым доступом, мы смогли сотвили PD и нормальных возрастных людей из данных акселерометра, полученных с мобильных телефонов, и автоматически классифицировать деятельность, которая встроена в клинические тесты, представленные здесь 35.
В качестве следующего шага мы стремимся собрать больше данных от более широкого круга населения PWP и их соответствующих участников управления и записать их в разные моменты времени, чтобы иметь возможность выполнять как поперечный, так и продольный анализ с помощью наших методов. Мы предвидим, что такие собранные цифровые данные будут предлагать гораздо больше, чем сумма их частей, и действительно реализовать принципы точной медицины в неврологии и психиатрии.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Это исследование финансируется частично Ратгерс Discovery Informatics институт JR, Ратгерский университет TechAdvance фонды EBT и СП, Нью-Джерси губернатора Совета по исследованиям и лечению аутизма в EBT и Майкл J Fox Фонда RD.
Materials
| Enobio 32 | NE Neuroelectrics | NE006WF | wearable, wireless electrophysiology sensor system for the recording of EEG. |
| Inking Pen | Wacom | KP1302 | tablet pen |
| Intuos Pro | Wacom | PTH451 | pen tablet |
| Lab Stream Layer System | n/a | n/a | open source software to synchronize different devices |
| Microphone | Zaffiro | B07BDFP6XC | computer microphone |
| MovAlyzeR | Neuroscript | Version 6.1.0.0. | pen movement caption software |
| MTw Awinda wireless motion tracker | Xsens | MTw Awinda | motion capture system |
| MVN Analyze | Xsens | Version 2019 | motion-tracking software |
| NIC 2.0 | NE Neuroelectrics | NE001SW2 | Neuroelectrics Instrument Controller (NIC) EEG streaming software |
| OpenPose | n/a | n/a | open source machine learning software to extract facial information |
References
- Hawgood, S., Hook-Barnard, I. G., O’Brien, T. C., Yamamoto, K. R. Precision medicine: Beyond the inflection point. Science Translational Medicine. 7 (300), 300ps317 (2015).
- Torres, E. B., Whyatt, C. . Autism: The Movement Sensing Perspective. , (2018).
- Torres, E. B., et al. Toward Precision Psychiatry: Statistical Platform for the Personalized Characterization of Natural Behaviors. Frontiers in Neurology. 7, 8 (2016).
- Espay, A. J., et al. Technology in Parkinson’s disease: Challenges and opportunities. Movement Disorders. 31 (9), 1272-1282 (2016).
- Ponsen, M. M., Stoffers, D., Wolters, E. C., Booij, J., Berendse, H. W. Olfactory testing combined with dopamine transporter imaging as a method to detect prodromal Parkinson’s disease. Journal of Neurology, Neurosurgery & Psychiatry. 81 (4), 396-399 (2010).
- Ponsen, M. M., et al. Idiopathic hyposmia as a preclinical sign of Parkinson’s disease. Annals of Neurology: Official Journal of the American Neurological Association and the Child Neurology Society. 56 (2), 173-181 (2004).
- Oudre, L., Jakubowicz, J., Bianchi, P., Simon, C. Classification of periodic activities using the Wasserstein distance. IEEE Transactions on Biomedical Engineering. 59 (6), 1610-1619 (2012).
- Derkinderen, P., et al. Parkinson disease: the enteric nervous system spills its guts. Neurology. 77 (19), 1761-1767 (2011).
- Roetenberg, D., Luinge, H., Slycke, P. Xsens MVN: Full 6DOF human motion tracking using miniature inertial sensors. Xsens Motion Technologies BV, Tech. Rep. 1, (2009).
- Possin, K. L., Laluz, V. R., Alcantar, O. Z., Miller, B. L., Kramer, J. H. Distinct neuroanatomical substrates and cognitive mechanisms of figure copy performance in Alzheimer’s disease and behavioral variant frontotemporal dementia. Neuropsychologia. 49 (1), 43-48 (2011).
- Army, U. Army individual test battery. Manual of Directions and Scoring. , (1944).
- Nasreddine, Z. S., et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. Journal of the American Geriatrics Society. 53 (4), 695-699 (2005).
- Beekly, D. L., et al. The National Alzheimer’s Coordinating Center (NACC) database: the uniform data set. Alzheimer Disease & Associated Disorders. 21 (3), 249-258 (2007).
- Torres, E. B. . Objective Biometric Methods for the Diagnosis and Treatment of Nervous System Disorders. , (2018).
- Ryu, J., Torres, E. B. . Fourth International Symposium on Movement and Computing, MOCO’17. , 1-8 (2017).
- Torres, E. B., Donnellan, A. M. . Autism: The movement perspective. , (2015).
- Torres, E. B., Vero, J., Rai, R. Statistical Platform for Individualized Behavioral Analyses Using Biophysical Micro-Movement Spikes. Sensors (Basel). 18 (4), (2018).
- Torres, E. B., Denisova, K. Motor noise is rich signal in autism research and pharmacological treatments. Scientific Reports. 6, (2016).
- Shannon, C. A mathematical theory of communication. Bell System Technical Journal. 27, 379-423 (1948).
- Silverstein, S. M., Wibral, M., Phillips, W. A. Implications of information theory for computational modeling of schizophrenia. Computational Psychiatry. 1, 82-101 (2017).
- Jeong, J., Gore, J. C., Peterson, B. S. Mutual information analysis of the EEG in patients with Alzheimer’s disease. Clinical Neurophysiology. 112 (5), 827-835 (2001).
- Torres, E. B., et al. Autism: the micro-movement perspective. Frontiers in Integrative Neuroscience. 7, 32 (2013).
- Von Holst, E., Mittelstaedt, H., Dodwell, P. C. . Perceptual Processing: Stimulus equivalence and pattern recognition. , 41-72 (1950).
- Torres, E. B., Cole, J., Poizner, H. Motor output variability, deafferentation, and putative deficits in kinesthetic reafference in Parkinson’s disease. Frontiers in Human Neuroscience. 8, 823 (2014).
- Yanovich, P., Isenhower, R. W., Sage, J., Torres, E. B. Spatial-orientation priming impedes rather than facilitates the spontaneous control of hand-retraction speeds in patients with Parkinson’s disease. PLoS One. 8 (7), e66757 (2013).
- Torres, E. B. The rates of change of the stochastic trajectories of acceleration variability are a good predictor of normal aging and of the stage of Parkinson’s disease. Frontiers in Integrative Neuroscience. 7, 50 (2013).
- Torres, E. B., Heilman, K. M., Poizner, H. Impaired endogenously evoked automated reaching in Parkinson’s disease. Journal of Neuroscience. 31 (49), 17848-17863 (2011).
- Nguyen, J., Majmudar, U., Papathomas, T. V., Silverstein, S. M., Torres, E. B. Schizophrenia: The micro-movements perspective. Neuropsychologia. 85, 310-326 (2016).
- Torres, E. B. Atypical signatures of motor variability found in an individual with ASD. Neurocase. 19 (2), 150-165 (2013).
- Torres, E. B. Signatures of movement variability anticipate hand speed according to levels of intent. Behavioral Brain Functions. 9, 10 (2013).
- Lai, M., Demuru, M., Hillebrand, A., Fraschini, M. A comparison between scalp-and source-reconstructed EEG networks. Scientific Reports. 8 (1), 12269 (2018).
- Sporns, O. . Networks of the Brain. , (2010).
- Rubinov, M., Sporns, O. Complex network measures of brain connectivity: uses and interpretations. Neuroimage. 52 (3), 1059-1069 (2010).
- Kalampratsidou, V., Torres, E. B. Peripheral Network Connectivity Analyses for the Real-Time Tracking of Coupled Bodies in Motion. Sensors (Basel). 18 (9), 3117 (2018).
- Torres, E. The rates of change of the stochastic trajectories of acceleration variability are a good predictor of normal aging and of the stage of Parkinson’s disease. Frontiers in Integrative Neuroscience. 7 (50), (2013).

