파킨슨 병의 운동 및 인지 기능의 동적 디지털 바이오 마커
Summary
이 프로토콜은 파킨슨 병에서 인지 및 운동 제어를 측정하는 데 일반적으로 사용되는 전통적인 임상 작업의 일부를 디지털화합니다. 임상 과제는 디지털화되고 생물물리학적 리듬은 자발적, 자발적, 자동에서 자율주행에 이르기까지 신경계의 다양한 기능적 수준에서 공동 등록됩니다.
Abstract
파킨슨 병 (PD)은 이기종 장애이기 때문에 치료를 최적화하기 위해 개인화 된 의학이 진정으로 필요합니다. 그들의 현재 양식에서, 종이와 연필 현상-측정에서 표준 점수는 질병 진행을 추적하기 위하여 전통적으로 이용된 측정은 엄청나게 현상의 얼굴에 고려중인 임상 현상의 세분성을 붙잡기 위하여 너무 거칠다 (이산) 다양성. 이러한 이유로 센서, 웨어러블 및 모바일 장치는 PD 연구 및 일상적인 관리에 점점 더 통합되고 있습니다. 이러한 디지털 측정은 기존의 측정값보다 표준화가 덜하고 해석 가능한 보다 정밀하고 산출가능한 데이터를 산출하는 반면, 결과적으로 두 가지 유형의 데이터는 대부분 격리된 상태로 유지됩니다. 이 두 가지 문제는 모두 현장에서 가장 정밀한 평가 도구의 광범위한 임상 적용에 장벽을 제시합니다. 이 프로토콜은 두 가지 문제를 모두 해결합니다. 기존의 작업을 사용하여 인지 및 모터 제어를 측정하면서 참가자를 테스트하고 웨어러블을 사용하여 생체 물리학 신호를 눈에 띄지 않게 공동 등록합니다. 그런 다음 기존의 종이 및 연필 방법의 점수를 지속적으로 등록하는 디지털 데이터와 통합합니다. 우리는 새로운 표준화 된 데이터 유형과 통합 통계 플랫폼을 제공하여 다양한 조건하에서 사람의 스토스 시그니처의 변화를 동적으로 추적 할 수 있게해주며, 신경 운동 제어의 다양한 기능 수준을 조사합니다. 자율에 자발적으로. 프로토콜 및 표준화된 통계 프레임워크는 검증된 임상 척도에 해당하는 PD의 물리적 및 인지 기능의 동적 디지털 바이오마커를 제공하면서 정밀도를 크게 향상시뜨습니다.
Introduction
정밀의학(PM)(그림 1)은 맞춤형 표적 치료제를 개발할 수 있는 강력한 플랫폼으로 부상하고 있습니다. 암 연구 분야에서, 이 모형은 아주 성공적이었고 그것의 신조는 가까운 장래에 의학 분야를혁명하기 위하여 구속됩니다 1. PM은 환자의 자기 보고에서 유전체학에 이르기까지 여러 층의 지식을 결합합니다. 이러한 모든 계층에 걸쳐 정보를 통합하면 데이터를 해석하고 사람의 삶의 모든 측면을 고려하기위한 보다 정확한 치료 권장 사항을 가능하게하는 개인화 된 평가가 가능합니다.
신경계의 신경정신과 및 신경장애에 PM 플랫폼을 적용하려고 할 때 몇가지 과제가있으며,이러한 과제는 최근4. 그 중에는 획득되는 데이터의 차이, 즉 관찰에 의해 유도되는 임상 연필 및 종이 방법에서 의한 이산 점수, 그리고 신경계 출력으로부터 물리적으로 획득한 연속 생물물리학 데이터(예: 바이오 센서 사용)가 있습니다. 임상 점수의 데이터는 단일(이론적) 확률 분포 함수(PDF)를 적용하는 모든 정적 모델에 맞는 단일 크기로 가정하는 경향이 있습니다. 규범적 데이터가 처음에 획득되고 특성화되지 않았기 때문에 적절한 경험적 검증없이 데이터에 우선 순위가 가정됩니다. 이와 같이, 건강한 사람이 나이및 이 매개변수 변이를 캐스팅하는 데 사용되는 확률 공간이 어느 정도 속도로 이동함에 따라, 인간 신경계의 신경 전형적인 성교 상태를 설명하는 적절한 유사성 메트릭 기반 기준이 없다. 규범적 데이터와 적절한 유사성 메트릭이 없으면 사람의 수명 전반에 걸쳐 동적으로 변화하므로 일반적인 상태의 이탈을 측정할 수 없습니다. 또한 다가오는 변화의 감각적 결과를 예측할 수 없습니다.
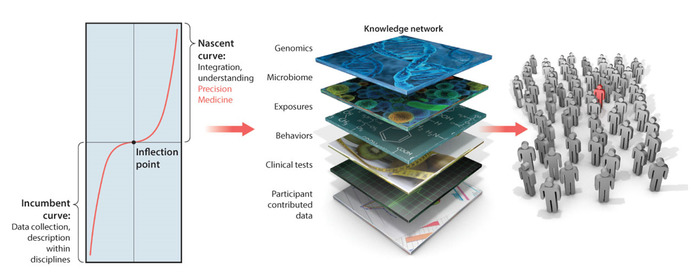
그림 1: 정밀 의학 플랫폼: 신경계의 신경 및 신경 정신 장애로 번역된 맞춤형 의학에서 표적 치료 개발을 가능하게 하기 위해 행동과 유전체학 사이의 격차를 메웁니다. 개인화된 표적 치료의 개발을 위한 정밀 의학 플랫폼은 신경계의 신경및 신경정신장애를 진단하고 치료하기 위해 번역될 수 있다. 그러나 지식 네트워크에서 행동 분석 계층은 생물 물리학 데이터에서 새로운 새로운 디지털 결과를 보다 전통적인 임상 기준과 통합하기 위한 패러다임의 전환이 필요합니다. 앞으로 의제, 환자 및 간병인의 디지털 결과 측정을 장려하면서 통계적으로 건전한 방법과 이러한 통합을위한 새로운 직관적 인 시각화 도구를 제공하는 것입니다. 이 수치는 미국 과학 진보 협회의 허가를 받아 Hawgood 등 1에서 수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
현재 “그랜드평균화”접근법은 개인의 데이터 에서 의과상 변동, 즉 장애가 진행됨에 따라 자연스럽게 노화됨에 따라 나타나는 신호 가변성, 그리고 사람의 신경계로 소음으로 부드럽게 합니다. 치료를 받고 반응할 수 있습니다. 규범적 데이터의 부족 (즉, 건강한 인구의 큰 단면 및 세로 부분을 평가)는 건강한 노화의 신경 전형적인 역학을 이해하는 것을 방지합니다. 이와 같이, 병리학이 개인에게 체계적으로 나타나기 시작하기 때문에 주어진 병리학의 결과를 보다 일반적으로 예측하는 방법을 아는 것이 도전이됩니다. 예측 접근은 퇴행성 과정을 감속하는 재생 요법 및/또는 신경 보호 요법을 설계하는 데 중요합니다. 파킨슨 병은 병리학의 좋은 예이며, 그로 인해 장애의 증상이 다른 많은 측정 가능한 증상이 선행됩니다. 우리는 눈에 보이는 모터 무질서가 감소된 후각 기능 5,6,음성 패턴에 있는 변경, 급속한 눈 운동 (REM) 잠7및 그밖 비 모터와 같은 보다 적게 눈에 띄는 감각 문제점에 선행되었다는 것을 오늘 알고 있습니다 장신경계의 기능과 관련된 증상8. 장애가 나타날 때까지 시스템에 이미 높은 도파민성 고갈이 있습니다. 그러나 비 모터 현상은 무질서가 현재 1 차적으로 평가되는 가시적인 모터 손상의 일부를 예측할 수 있었습니다.
현재의 분석 모델을 변경하고 생체 리듬 운동이 명시하고 타임 시리즈의 형태로 동적으로 활용 될 수있는 신경계의 모든 수준에 걸쳐 경험적 데이터를 적절하게 특성화의 중요성을 고려할 필요가있다 다수의 센서와 공동 등록. 보다 일반적인 의미에서 모션 데이터는 방송하는 움직임과 장애에 국한되어서는 안됩니다. 신경계의 모든 생체 리듬 (비 운동 파형 포함)의 디지털 데이터는 우리가 예방하거나 빠른 신경 변성을 늦추는 데 도움이 필요할 수 있습니다 예측 잠재력을 제공합니다. 그러나 데이터 형식의 레퍼토리를 보강함에 따라 현재 이러한 데이터를 분석하는 데 사용 중인 통계적 추론 및 해석을 위해 파라메트릭 선형 모델의 고유한 가정을 피해야 합니다. 우리가 경층 적 변화와 동적 변화에 따라 신경계 병리학에서 연구하는 매우 비선형 문제의 유형에 대한 이러한 선형 모델의 타당성을 평가하는 것이 중요 할 것이다. 현재 가정 분석 파이프라인 루프의 주의 사항은 이산 임상 점수와 연속적인 디지털 생물물리파형의 데이터 유형 모두에서 존재합니다. 그들은 연결이 끊어진 상태로 유지되지만, 환자에 의해 새로운 디지털 기술의 사용을 용이하게하기 위해 임상 기준에 디지털 결과를 정렬하는 방식으로 두 가지 유형의 데이터를 적절하게 통합 할 수있는 새로운 프레임 워크를 설계하는 것이 중요합니다. 간병인과 임상의.
이러한 과제 중 일부를 극복하기 위해 최근 그림 1의 PM 플랫폼을 조정하여 신경 및 신경 정신과 조건에 대한 정밀 한 자형질 을 제공합니다3. 이를 위해 인지 현상과 운동 현상 사이의 복잡한 관계를 확인하는 전통적인 임상 채점 테스트와 함께 행동 데이터를 수집, 분석 및 해석하는 새로운 방법을 설계했습니다. 더 정확하게는 연필과 종이 방법을 디지털화했습니다. 이러한 방법만으로는 육안으로 벗어나는 중요한 정보를 포착하기에는 너무 거칠습니다. 그러나 생물 물리학 센서의 디지털 데이터와 결합하여 사용하는 것은 임상 적 기준과 새로운 새로운 디지털 기술을 연결하는 새로운 길을 제공하여 임상의가 가까운 장래에 이를 채택하도록 장려할 수 있습니다.
여기에서는 임상 평가의 맥락에서 디지털 데이터의 사용을 소개합니다. 즉, 사람이 임상 과제를 수행함에 따라, 예를 들어 몬트리올 인지 평가(MoCA) 시험에서 시계를 그리는 동안, 신경계에 의한 생체 리듬 출력은 상이한 기능적 층에 걸쳐 공동 등록된다. 여기에는 뇌전도(EEG), 심전도(ECG 또는 EKG), 신체의 음성 패턴 및 운동학, 사람이 디지털화된 태블릿에서 시계를 그리는 데 사용하는 휴대용 펜의 운동학 출력이 포함됩니다. 우리는 또한 사람이 그릴 때 얼굴에서 비디오 데이터를 수집하여 감정 상태를 예측하는 감정 분석을 수행합니다. 이 데이터는 개별화된 행동 분석 (SPIBA)를 위한 새로운 통계적인 플랫폼의 광학을 통해 그 때 분석하고 그 같은 시험의 기초에 임상 기준에 따라 해석됩니다. 보다 구체적으로, 이산 점수는 환자의 코호트를 중앙값으로 순위를 매기고, 이러한 방식으로, 그 임상 기준에 기초하여 그룹을 계층화하는 데 사용된다. 그런 다음, 하나 이상의 파라메트릭 차원에 걸쳐 환자의 한 하위 집합을 다른 환자의 하위 집합을 근본적으로 분리하는 디지털 기반 의전성 기준을 찾기 위해 확인된 그룹의 지속적인 생물물리학 데이터를 조사할 수 있습니다. 더욱이, 그 자체로 연속적인 생물물리학 데이터를 검토함으로써, 코호트 내의 각 사람의 고유 변동에 따라 임상 기준에서 눈을 멀게 함으로써, 우리는 코호트 내의 자기 신흥 클러스터를 검색하고, 그러한 군집이 임상 기준에 의해 통보된 아류형이 밝혀진 그 위에 매핑되는 정도.
이 접근법은 생물 물리학 디지털 데이터의 부내에서 매개 변수를 식별하는 새로운 방법을 제공, 가장 효과적으로 아류형에 걸쳐 차이를 캡처하고 파킨슨 병 환자를 계층화 잠재적으로 좋은 후보로 그 차이를 렌더링 맹인의 질병(PWP), 즉 일반 인구로부터 무작위로 추첨을 통해 이 방법의 관련성은 두 가지입니다. 우리는 바이오 센서 및 임상 기준에서 서로 다른 데이터 유형을 적절하게 통합하면서 치료를 진정으로 개인화 할 수 있습니다. 즉, 타임 시리즈의 형태로 지속적인 디지털 생물 물리학 데이터, 기존의 테스트에서 개별 임상 점수.
이것은 신경계의 모든 장애에 적용되는 일반적인 접근법이지만, 우리는 PWP의 맥락 내에서 작업을 구성하고 그러한 성능 동안 공동 으로 등록 된 연속 디지털 데이터에 대한 통계적 추론을 할 수있는 새로운 방법을 제공합니다. 이산 임상 채점 시스템을 고려한 임상 시험. 이와 같이, 이 작업은 임상 설정에서 사용하는 디지털 결과의 임상 해석을 가능하게 합니다. 마지막으로, 우리는 환자, 간병인 및 임상 인력에 의해 가정 및 임상 설정에서 사용의 용이성을 위해 새로운 앱에 포함 할 수있는 개별 결과를 시각화할 수있는 새로운 방법을 설계하기 위한 권장 사항을 제공합니다.
Protocol
Representative Results
Discussion
이 작품은 사람이 그 같은 시험을 수행할 때 신경계에 의해 출력된 생물물리학 신호에서 디지털 데이터와 전통적인 임상 시험의 통합을 가능하게 하는 새로운 프로토콜을 소개합니다. SPIBA와 MMS를 통합 플랫폼으로 사용하여 연필 및 종이 관측 방법의 이산 점수 및 생물 물리학 센서의 연속 디지털 데이터와 같은 이질적인 유형의 데이터를 결합합니다. 이 방법은 PWP 와 연령 및 성별 일치 컨트롤의 코호트를 사용하여 설명되며, 비교를 위한 이상적인 건강한 기준으로 추가적인 젊은 대조군을 사용한다. 우리는 전통적인 임상 시험 (예를 들어, MoCA 및 MDS-UPDRS의 일부일 수 있음)이 집단의 순위를 중앙값으로 지정하고 자동으로 추출하는 데 사용될 수 있음을 보여 주며, 그룹의 점수의 고유 변동성, 디지털 데이터의 계층화 정보를 추출할 수 있습니다. 임상적으로 정의된 심각도 수준에 따라 영역을 볼 수 있습니다. 이러한 수준은 임상 MDS-UPDRS 및 인지/메모리 테스트 성능의 수준과 잘 일치합니다. 구현의 또 다른 층에서, 우리는 따라서 자율성과 제어의 다른 수준을 특성화, CNS, PNS 및 ANS 층에서 활용 신경계의 생체 리듬을 검사합니다. 당사는 임상 기준의 광학을 통해 검사된 이러한 데이터에서 파생된 샘플 데이터 및 스토카스틱 시그니처를 제공합니다. 이러한 접근 하에 환자를 건강한 대조군과 구별 할 수 있습니다. 그리고 디지털 생체 리듬을 통해, PWP 내에서 차별화, 심각도의 임상 정의 수준에.
이러한 방식으로 생물물리학적 디지털 데이터를 임상 기준과 일치시킴으로써, 우리는 결과의 개별화된 변화를 보다 동적으로 추적할 수 있는 해석 가능한 기준 세트를 제공합니다. 우리는 디지털 데이터를 기반으로하기 때문에 동적 디지털 바이오 마커를 측정하는 새로운 결과를 동전, 아직 잘 확립되고 검증 된 임상 기준에 따라 해석 가능한 결과를 제공합니다. 그들은 신경계 과정의 타임 시리즈에서 파생되며 그러한 동적 특성을 포착합니다. 특히, 우리는 모터 와 비 모터 기준을 모두 사용할 수 있습니다. 이와 같이, 우리는 PD의 비모터 양상을 정량화하기 시작할 수 있으며, 이는 종래에 장애를 정의한 운동 증상의 악화를 선행하는 것으로 알려져 있다. 예를 들면, 여기에 제시된 것과 같은 안면 분석은 운동 활동의 악화를 예측할 수 있던 사람들의 레퍼토리를 건설하기 위하여 REM 잠 도중 자발적인 안면 마이크로 제스처를 검토하기 위하여 이용될 수 있었습니다. 마찬가지로, 우리는 매일 활동 도중 고통의 수준을 검토하고 REM 수면 시간 도중 활동과 그들의 잠재적인 상관관계를 평가하기 위하여 이 방법을 사용할 수 있었습니다. 이는 REM 수면과 통증조절이 모두 나중에 PD5,6,7의심각도수준을 정의하는 모터 문제를 선행하는 것으로 알려져 있기 때문에 중요하다. 다양한 전통적인 임상 작업의 디지털화를 사용하여 인지 및 기억 능력을 조사하는 데 사용되는 임상 작업에 내장 된 다른 비 운동 활동이 여기에서 특징지어졌으며, 이러한 활동의 색인은 운동 증상에 매핑되었습니다. 이 방법은 파킨슨 병의 기본 연구 및 임상 관행을 연결할 수 있습니다. 그(것)들은 또한 신경계의 그밖 무질서로 확장될 수 있습니다.
얼굴에서 모터 출력 외에, REM 수면 중, 우리는 자기 감지 또는 운동 반응의 프레임 내에서 자연 사회 상황 동안 얼굴 제스처를 검사 할 수 있습니다 환자의 뇌가 가장 가능성이 얻는 reafferent 피드백의 수준을 측정. 여기서, 삼차 구심성 영역 V1, V2, V3에 대응하는 얼굴 영역에 걸쳐 마이크로 제스처의 매우 미묘한 차이에도 불구하고, 얼굴의 어느 부위가 최대로 이동한 대표적인 참가자를 정확히 파악할 수 있었다. 중립 상태와 자연스럽게 웃는 상태 사이를 전환할 때 과장된 시그니처를 클릭합니다. 이는 SPIBA 및 MMS를 사용하여 운동 용 터치 채널의 감각 입력과 관련된 PD의 다른 비 모터 (감각) 측면을 평가 할 수 있음을 시사합니다. 이들은 무질서24의초기 단계에서조차 PD에서 문제가 있는 것으로 판명되었습니다. 감각과 모터가 손에 손을 이동하기 때문에,이 정보는 우리가이 장애의 진행에 나중에 표면 더 명백한 모터 문제를 예측하는 데 도움이 될 수있습니다1,7. 우리는 얼굴의 삼차 영역을 따라 이러한 운동 채널은 또한 우리가 수면 변경과 관련된 사람들을 포함하여 통증 dysregulation의 다른유형을 해리 도움이 될 수 있음을 자세 5,6.
현재의 방법은 서로 다른 인지 능력과 자율성의 다른 수준을 요구하는 다른 조건하에서, 동시에 중앙, 말초 및 자율 신경계에서 얻은 생물 물리학 신호를 검사하는 새로운 방법을 제공하고, 신경 운동 제어. 표준화된 MMS 데이터에 스토커분석과 쌍별 네트워크 분석이 적용되는 SPIBA 프레임워크를 사용하여 인지 활동을 객관적으로 특성화할 수도 있습니다. 이 실험에 사용된 15개의 과제는 다양한 유형의 인지 능력(예: visuo-construction 기술, 시각 기억, 지각 스캐닝 기술)과 다양한 수준의 인지 제어(예: 의도적으로 가리키는 속도)를 필요로 합니다. 속도, 지시에 따라 호흡 속도 속도). 이러한 이유로, 이러한 작업 중에 전시된 생물물리학 적 신호의 CNS-PNS-ANS 정보 전송의 스토시시티 및 연결 패턴은 다양한 수준의 인지 부하와 모터 출력에 미치는 영향을 특성화하는 데 사용될 수 있다.
새로운 분석 방법 및 프로토콜의 장점을 강조하지만, 동기 데이터 수집을 위해 레코딩 플랫폼을 채택할 때 고려해야 할 주의 사항과 실질적인 한계를 지적합니다. 이 설정에서는 동기화를 위해 단일 컴퓨터에서 스트리밍하는 여러 기록 소프트웨어 유형이 있기 때문에 컴퓨터의 계산 능력이 높거나 데이터 손실, 컴퓨터 동결 및/또는 초과 가 발생할 수 있기 때문입니다. 소음. 현재 설계에서는 두 개의 스트리밍 소프트웨어(EEG 및 모션 캡처)와 LSL이 단일 컴퓨터에서 실행되었습니다. 따라서 과부하 및 컴퓨터 동결 을 처리하는 것을 염두에 두어야했습니다. 이것은 우리가 EEG 채널 중 하나를 사용하여 ECG 신호를 추출하는 이유 중 하나였습니다. 메모리 용량이 높고 프로세서 속도가 빠른 컴퓨터는 운동학의 EEG 및 센서 그리드와 동시에 스트리밍되는 별도의 ECG 소프트웨어를 처리할 수 있습니다. 이러한 문제는 본질적으로 실용적이며 당사가 제공하는 분석 방법(SPIBA) 및 표준 데이터 유형(MMS)과는 무관합니다. 그러나 여러 스트림에서 데이터 공동 등록을 위한 프로토콜을 설계하기 전에 컴퓨팅 성능을 평가해야 할 필요성을 최종 사용자에게 알리는 것이 중요하다고 생각합니다.
우리가 지적하는 또 다른 주의사항은 프로토콜에 설명된 15개의 태스크가 동적 디지털 바이오마커를 개발하는 데 사용할 수 있는 부분 집합이라는 것입니다. 이 백서에서는 공간 제약으로 인해 몇 가지 작업을 제한하고 다양한 수준의 제어 및 신체 모션을 포함하는 작업을 선택했으며 실제로이 백서에 포함되지 않은 다른 작업을 추가 할 수 있습니다. 우리의 목표는 적은 시간과 노력을 필요로 하는 작업의 작은 하위 집합을 파생 하는 것입니다. 사실, 우리의 실험실에서, 포인팅 작업 (작업 10−12)은 우리가 PD를 포함하여 자발적 제어 및 신경 장애의 다른 수준에 의해 변화 생물 리듬의 스토스 서명을 특성화하는 효과적이고 효율적인 방법이 될 것으로 나타났습니다 작업의 집합입니다 24세 , 30.
이 연구에서 나타난 대표적인 결과는 SPIBA 방법을 사용하여 바이오 센서 파형 및 카메라의 모션 캡션에서 파생된 MMS 데이터 세트로 수행할 수 있는 작은 하위 집합입니다. 설명을 위해 MMS를 진폭으로 검사하고 사람의 COM에서 파생된 선형 속도 진폭의 변동에 중점을 두어 기울였습니다. COM은 우리가 공동 등록한 17개의 바디 센서 그리드의 요약 신호입니다. 그러나 해석을 다른 회전 매개변수및 변동하는 매개변수의 시간계를 생성하는 다른 운동 변수(예: 힘 및 압력)로 확장할 수 있습니다(예: 면 데이터와 마찬가지로). 또한, 공간 제약으로 인해, 우리는 단지 그 두피 진폭 정보를 기반으로 EEG 데이터의 분석을 예시하지만, 우리는 또한 소스 공간(31)에서파생 된 데이터에 이러한 분석을 적용 할 수 있습니다. 모든 데이터 모드에 대해 타임계를 생성하는 피크(피크 진폭 대신)사이의 시간의 연속성을 검사할 수도 있습니다. 파라미터의 다른 타임시리즈는 이러한 파형으로부터 유래될 수 있으며, 그들의 MMS는32,33,34로구성된 네트워크로부터 응집력 및 연결을 확인하는데 사용될 수 있다. 더욱이, 이들 분석은 또한 주파수도메인(34)까지확장될 수 있다. 상호 정보 네트워크 분석 외에도 PWP와 제어를 차별화하고 PWP를 계층화하기 위해 네트워크의 다른 위상학적 기능에 집중할 수 있었습니다. 이 백서에서는 이러한 분석이 도구로서의 유용성에 초점을 맞추고 있지만 이러한 유형의 특성화를 통해 이러한 분석 도구가 제공하는 디지털 데이터에 대한 임상 적 정보에 입각한 해석을 제공하는 지식을 얻게 됩니다.
본 연구에서 설명하는 현재의 방법은 SPIBA 및 MMS가 임상 및 디지털 데이터 통합에 적용될 수 있는 여러 가지 가능한 방법 중 일부를 소개하는 역할을 합니다. 우리는 이 통합 플랫폼, 표준화된 데이터 유형 및 실험 프로토콜을 제공하여 최종적으로 임상 기준의 디지털 데이터를 알리고 디지털 데이터에서 전통적인 연필 및 종이 방법에 대한 정밀도를 더 할 수 있기를 희망합니다. 이러한 개선은 1) 치료에 대한 반응으로 증상 변화를 보다 정확하게 추적할 수 있게 하고, 2) 시간이 지남에 따라 자연 PD 진행에 대한 이해를 높이고, 3) PD 증상 프리젠테이션의 계층화를 용이하게 할 것입니다(이는 고유한 임상을 지시할 수 있음) 각 하위 그룹에 대한 권장 사항)을 참조하십시오. 이와 같이, 우리는 PD에 있는 추가 연구에 이 방법을 적용하기 위하여 희망합니다, 그러나 또한 임상 신청에 있는 유용성을 또한 봅을. 휴대 전화와 같은 상용 등급 장치를 사용하여 이 백서에서 설명한 분석을 수행하기 위해 생물 물리학 데이터를 얻을 수 있습니다. 현재 로체스터 대학교(https://parkinsonmpower.org)와 Kaggle의 mPower 앱 스터디와 같은 대규모 디지털 데이터를 수집하는 노력이 있습니다. 실제로 이러한 오픈 액세스 데이터 리포지토리를 사용하여 휴대폰에서 얻은 가속도계 데이터에서 PD 및 정상 노화 개인을 계층화하고 여기에 제시된 임상 시험에 포함된 활동을 자동으로 분류할 수 있었습니다. 35.
다음 단계로, 우리는 PWP 인구의 넓은 범위와 그들의 일치하는 제어 참가자에서 더 많은 데이터를 수집하고 우리의 방법을 사용하여 단면 및 세로 분석을 모두 수행 할 수 있도록 서로 다른 시점에서 기록하는 것을 목표로하고 있습니다. 우리는 수집 된 디지털 데이터가 부분의 합보다 훨씬 더 많은 것을 제공 할 것으로 예상하며 신경학 및 정신과에서 정밀 의학의 신조를 진정으로 실현합니다.
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 연구는 JR에 럿거스 디스커버리 정보학 연구소에 의해 부분적으로 투자된다, EBT와 JV에 럿거스 대학 기술 사전 기금, EBT에 자폐증의 연구 및 치료를위한 뉴저지 주지사위원회 와 RD에 마이클 J 폭스 재단.
Materials
| Enobio 32 | NE Neuroelectrics | NE006WF | wearable, wireless electrophysiology sensor system for the recording of EEG. |
| Inking Pen | Wacom | KP1302 | tablet pen |
| Intuos Pro | Wacom | PTH451 | pen tablet |
| Lab Stream Layer System | n/a | n/a | open source software to synchronize different devices |
| Microphone | Zaffiro | B07BDFP6XC | computer microphone |
| MovAlyzeR | Neuroscript | Version 6.1.0.0. | pen movement caption software |
| MTw Awinda wireless motion tracker | Xsens | MTw Awinda | motion capture system |
| MVN Analyze | Xsens | Version 2019 | motion-tracking software |
| NIC 2.0 | NE Neuroelectrics | NE001SW2 | Neuroelectrics Instrument Controller (NIC) EEG streaming software |
| OpenPose | n/a | n/a | open source machine learning software to extract facial information |
References
- Hawgood, S., Hook-Barnard, I. G., O’Brien, T. C., Yamamoto, K. R. Precision medicine: Beyond the inflection point. Science Translational Medicine. 7 (300), 300ps317 (2015).
- Torres, E. B., Whyatt, C. . Autism: The Movement Sensing Perspective. , (2018).
- Torres, E. B., et al. Toward Precision Psychiatry: Statistical Platform for the Personalized Characterization of Natural Behaviors. Frontiers in Neurology. 7, 8 (2016).
- Espay, A. J., et al. Technology in Parkinson’s disease: Challenges and opportunities. Movement Disorders. 31 (9), 1272-1282 (2016).
- Ponsen, M. M., Stoffers, D., Wolters, E. C., Booij, J., Berendse, H. W. Olfactory testing combined with dopamine transporter imaging as a method to detect prodromal Parkinson’s disease. Journal of Neurology, Neurosurgery & Psychiatry. 81 (4), 396-399 (2010).
- Ponsen, M. M., et al. Idiopathic hyposmia as a preclinical sign of Parkinson’s disease. Annals of Neurology: Official Journal of the American Neurological Association and the Child Neurology Society. 56 (2), 173-181 (2004).
- Oudre, L., Jakubowicz, J., Bianchi, P., Simon, C. Classification of periodic activities using the Wasserstein distance. IEEE Transactions on Biomedical Engineering. 59 (6), 1610-1619 (2012).
- Derkinderen, P., et al. Parkinson disease: the enteric nervous system spills its guts. Neurology. 77 (19), 1761-1767 (2011).
- Roetenberg, D., Luinge, H., Slycke, P. Xsens MVN: Full 6DOF human motion tracking using miniature inertial sensors. Xsens Motion Technologies BV, Tech. Rep. 1, (2009).
- Possin, K. L., Laluz, V. R., Alcantar, O. Z., Miller, B. L., Kramer, J. H. Distinct neuroanatomical substrates and cognitive mechanisms of figure copy performance in Alzheimer’s disease and behavioral variant frontotemporal dementia. Neuropsychologia. 49 (1), 43-48 (2011).
- Army, U. Army individual test battery. Manual of Directions and Scoring. , (1944).
- Nasreddine, Z. S., et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. Journal of the American Geriatrics Society. 53 (4), 695-699 (2005).
- Beekly, D. L., et al. The National Alzheimer’s Coordinating Center (NACC) database: the uniform data set. Alzheimer Disease & Associated Disorders. 21 (3), 249-258 (2007).
- Torres, E. B. . Objective Biometric Methods for the Diagnosis and Treatment of Nervous System Disorders. , (2018).
- Ryu, J., Torres, E. B. . Fourth International Symposium on Movement and Computing, MOCO’17. , 1-8 (2017).
- Torres, E. B., Donnellan, A. M. . Autism: The movement perspective. , (2015).
- Torres, E. B., Vero, J., Rai, R. Statistical Platform for Individualized Behavioral Analyses Using Biophysical Micro-Movement Spikes. Sensors (Basel). 18 (4), (2018).
- Torres, E. B., Denisova, K. Motor noise is rich signal in autism research and pharmacological treatments. Scientific Reports. 6, (2016).
- Shannon, C. A mathematical theory of communication. Bell System Technical Journal. 27, 379-423 (1948).
- Silverstein, S. M., Wibral, M., Phillips, W. A. Implications of information theory for computational modeling of schizophrenia. Computational Psychiatry. 1, 82-101 (2017).
- Jeong, J., Gore, J. C., Peterson, B. S. Mutual information analysis of the EEG in patients with Alzheimer’s disease. Clinical Neurophysiology. 112 (5), 827-835 (2001).
- Torres, E. B., et al. Autism: the micro-movement perspective. Frontiers in Integrative Neuroscience. 7, 32 (2013).
- Von Holst, E., Mittelstaedt, H., Dodwell, P. C. . Perceptual Processing: Stimulus equivalence and pattern recognition. , 41-72 (1950).
- Torres, E. B., Cole, J., Poizner, H. Motor output variability, deafferentation, and putative deficits in kinesthetic reafference in Parkinson’s disease. Frontiers in Human Neuroscience. 8, 823 (2014).
- Yanovich, P., Isenhower, R. W., Sage, J., Torres, E. B. Spatial-orientation priming impedes rather than facilitates the spontaneous control of hand-retraction speeds in patients with Parkinson’s disease. PLoS One. 8 (7), e66757 (2013).
- Torres, E. B. The rates of change of the stochastic trajectories of acceleration variability are a good predictor of normal aging and of the stage of Parkinson’s disease. Frontiers in Integrative Neuroscience. 7, 50 (2013).
- Torres, E. B., Heilman, K. M., Poizner, H. Impaired endogenously evoked automated reaching in Parkinson’s disease. Journal of Neuroscience. 31 (49), 17848-17863 (2011).
- Nguyen, J., Majmudar, U., Papathomas, T. V., Silverstein, S. M., Torres, E. B. Schizophrenia: The micro-movements perspective. Neuropsychologia. 85, 310-326 (2016).
- Torres, E. B. Atypical signatures of motor variability found in an individual with ASD. Neurocase. 19 (2), 150-165 (2013).
- Torres, E. B. Signatures of movement variability anticipate hand speed according to levels of intent. Behavioral Brain Functions. 9, 10 (2013).
- Lai, M., Demuru, M., Hillebrand, A., Fraschini, M. A comparison between scalp-and source-reconstructed EEG networks. Scientific Reports. 8 (1), 12269 (2018).
- Sporns, O. . Networks of the Brain. , (2010).
- Rubinov, M., Sporns, O. Complex network measures of brain connectivity: uses and interpretations. Neuroimage. 52 (3), 1059-1069 (2010).
- Kalampratsidou, V., Torres, E. B. Peripheral Network Connectivity Analyses for the Real-Time Tracking of Coupled Bodies in Motion. Sensors (Basel). 18 (9), 3117 (2018).
- Torres, E. The rates of change of the stochastic trajectories of acceleration variability are a good predictor of normal aging and of the stage of Parkinson’s disease. Frontiers in Integrative Neuroscience. 7 (50), (2013).

