Avaliação funcional das variantes BRCA1 usando editores de base mediados pelo CRISPR
Summary
Pessoas com mutações BRCA1 têm maior risco de desenvolver câncer, o que garante uma avaliação precisa da função das variantes BRCA1. Aqui, descrevemos um protocolo para avaliação funcional das variantes BRCA1 usando editores de base de citosina mediados pelo CRISPR que permitem a conversão de C:G para T:A direcionada em células vivas.
Abstract
Estudos recentes têm investigado os riscos associados às mutações genéticas BRCA1 usando vários métodos de avaliação funcional, como ensaios de repórteres fluorescentes, ensaios de viabilidade de células-tronco embrionárias e ensaios de sensibilidade à base de drogas terapêuticas. Embora tenham esclarecido muitas variantes brca1, estes ensaios envolvendo o uso de variantes BRCA1 exogenously expressas estão associados a questões de superexpressão e não podem ser aplicados à regulação pós-transcrição. Para resolver essas limitações, relatamos anteriormente um método de análise funcional das variantes BRCA1 através do editor de base de citosina mediada pelo CRISPR que induz a substituição de nucleotídeos direcionados em células vivas. Usando este método, identificamos variantes cujas funções permanecem ambíguas, incluindo c.-97C>T, c.154C>T, c.3847C>T, c.5056C>T e c.4986+5G>A, e confirmaram que os editores de base mediados pelo CRISPR são ferramentas úteis para reclassificar as variantes de significado incerto no BRCA1. Aqui, descrevemos um protocolo para análise funcional das variantes BRCA1 usando o editor base de citosina baseado em CRISPR. Este protocolo fornece diretrizes para a seleção de locais-alvo, análise funcional e avaliação das variantes BRCA1.
Introduction
O gene de suscetibilidade do câncer de mama tipo 1 (BRCA1) é um gene supressor de tumor amplamente conhecido. Como o gene BRCA1 está relacionado à reparação de danos no DNA, mutações nesse gene levariam a um maior risco de desenvolvimento de câncer em um indivíduo1. Câncer de mama, ovário, próstata e pâncreas estão ligados a mutações herdadas de perda de função (LOF) do gene BRCA1 2. A avaliação funcional e identificação das variantes BRCA1 podem ajudar na prevenção e diagnóstico das diversas doenças. Para abordar a função das variantes BRCA1, vários métodos foram desenvolvidos e amplamente utilizados para investigar a patogenicidade das variantes BRCA1, como ensaios de viabilidade de células-tronco embrionárias, ensaios de repórteres fluorescentes e ensaios de sensibilidade à base de drogas terapêuticas3,4,5,6. Embora esses métodos tenham avaliado a função de muitas variantes BRCA1, os métodos que envolvem variantes BRCA1 exogenousamente expressas apresentam limitações em termos de superexpressão que podem afetar a regulação a jusante, a dosagem genética e a dobra deproteínas 7. Além disso, esses ensaios não podem ser aproveitados para a regulamentação pós-transcrição, como emenda mRNA, estabilidade da transcrição e efeito da região não traduzida8,9.
O sistema CRISPR-Cas9 permite a edição de genomas direcionados em células vivas e organismos10. Através de um RNA de guia único, o Cas9 pode induzir quebras de dois fios (DSBs) no DNA cromossômico em loci genômicos específicos, a fim de ativar duas vias de reparaçãode DNA: caminho de junção final nonhomologous propensa a erros (NHEJ) e caminho de reparo direcionado por eliseução não-11 (HDR) sem erros . HDR é um mecanismo de reparo preciso; no entanto, os DSBs induzidos por nuclease Cas9 para HDR muitas vezes resulta em inserção indesejada e supressão (indel) mutação. Além disso, precisa de modelos de DNA de doadores homólogos para reparar danos de DNA e tem relativamente baixa eficiência. Recentemente, cas9 nickase (nCas9) foram fundidos com domínios de deaminase cytidina para direcionar substituições C:G a T:A, sem a necessidade de modelos de DNA homólogos e quebras de cadeia dupla de DNA12,13,14,15. Utilizando o editor base de citosina, desenvolvemos um novo método de análise funcional das variantes BRCA116.
Neste estudo, utilizou-se o editor de base de citosina mediada pelo CRISPR, BE314, que induz mutações eficientes de C:G a T:A point, para a implementação da avaliação funcional das variantes BRCA1 e identificou com sucesso as funções de várias variantes BRCA1 (Figura 1).
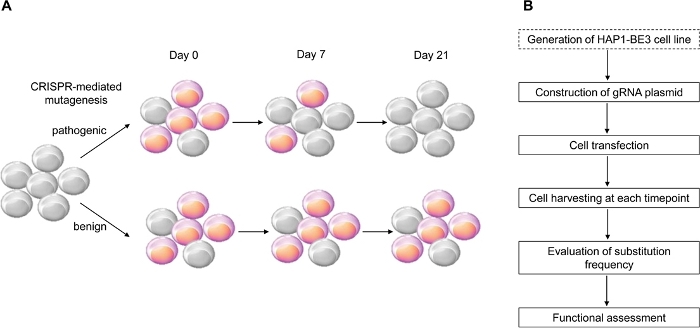
Figura 1: Uma visão geral do fluxo de trabalho para avaliação funcional. (A) Esquema mostrando a avaliação funcional do BRCA1. Como o LOF do BRCA1 afeta a viabilidade celular, quando a mutação BRCA1 é patogênica, as células morrem à medida que o número de passagem aumenta. (B) Etapas da avaliação funcional do BRCA1. A caixa pontilhada é opcional. Pode ser substituído por co-transfecção de gRNA expressando e BE3 expressando DNA de plasmídeos. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Este protocolo descreve um método simples para avaliações funcionais das variantes BRCA1 usando o editor base de citosina meditada por CRISPR. O protocolo descreve métodos para o desenho de gRNAs no lócus alvo e construção dos DNAs plasmídeos dos quais são expressos. Os editores de base de citosina induzem a conversão de nucleotídeos em uma janela ativa (no caso de BE3, nucleotídeos 4-8 na extremidade PAM-distal das sequências de alvo gRNA). O pesquisador deve escolher cuidadosamente sequências de …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi apoiado pela Fundação Nacional de Pesquisa da Coreia (bolsas 2017M3A9B4062419, 2019R1F1F1057637 e 2018R1A5A20732 a Y.K.).
Materials
| BamHI | NEB | R3136 | Restriction enzyme |
| Blasticidin | Thermo Fisher Scientific | A1113903 | Drug for selecting transduced cells |
| BsaI | NEB | R0535 | Restriction enzyme |
| DNeasy Blood & Tissue Kit | Qiagen | 69504 | Genomic DNA prep. kit |
| Dulbecco’s modified Eagle’s medium | Gibco | 11965092 | Medium for HEK293T/17 cells |
| Fetal bovine serum | Gibco | 16000036 | Supplemetal for cell culture |
| FuGENE HD Transfection Reagent | Promega | E2311 | Transfection reagent |
| Gibson Assembly Master Mix | NEB | E2611L | Gibson assembly kit |
| Iscove’s modified Dulbecco’s medium | Gibco | 12440046 | Medium for HAP1 cells |
| lentiCas9-Blast | Addgene | 52962 | Plasmids DNA for lentiBE3 cloning |
| Lipofectamine 2000 | Thermo Fisher Scientific | 11668027 | Transfection reagent |
| Opti-MEM | Gibco | 31985070 | Transfection materials |
| pCMV-BE3 | Addgene | 73021 | Plasmids DNA for lentiBE3 cloning |
| Penicillin-Streptomycin | Gibco | 15140 | Supplemetal for cell culture |
| Phusion High-Fidelity DNA Polymerase | NEB | M0530SQ | High-fidelity polymerase |
| pMD2.G | Addgene | 12259 | Plasmids DNA for virus prep. |
| pRG2 | Addgene | 104174 | gRNA cloning vector |
| psPAX2 | Addgene | 12260 | Plasmids DNA for virus prep. |
| QIAprep Spin Miniprep kit | Qiagen | 27106 | Plasmid DNA prep. Kit |
| QIAquick Gel extraction Kit | Qiagen | 28704 | Gel extraction kit |
| QIAquick PCR Purification Kit | Qiagen | 28104 | PCR product prep. kit |
| Quick Ligation Kit | NEB | M2200 | Ligase for gRNA cloning |
| T7 Endonuclease I | NEB | M0302 | Materials for T7E1 assay |
| XbaI | NEB | R0145 | Restriction enzyme |
References
- Roy, R., Chun, J., Powell, S. N. BRCA1 and BRCA2: different roles in a common pathway of genome protection. Nature Reviews Cancer. 12 (1), 68-78 (2011).
- Kuchenbaecker, K. B., et al. Risks of Breast, Ovarian, and Contralateral Breast Cancer for BRCA1 and BRCA2 Mutation Carriers. Journal of the American Medical Association. 317 (23), 2402-2416 (2017).
- Millot, G. A., et al. A guide for functional analysis of BRCA1 variants of uncertain significance. Human Mutation. 33 (11), 1526-1537 (2012).
- Santos, C., et al. Pathogenicity evaluation of BRCA1 and BRCA2 unclassified variants identified in Portuguese breast/ovarian cancer families. Journal of Molecular Diagnostics. 16 (3), 324-334 (2014).
- Starita, L. M., et al. A Multiplex Homology-Directed DNA Repair Assay Reveals the Impact of More Than 1,000 BRCA1 Missense Substitution Variants on Protein Function. American Journal of Human Genetics. 103 (4), 498-508 (2018).
- Anantha, R. W., et al. Functional and mutational landscapes of BRCA1 for homology-directed repair and therapy resistance. Elife. 6, (2017).
- Gibson, T. J., Seiler, M., Veitia, R. A. The transience of transient overexpression. Nature Methods. 10 (8), 715-721 (2013).
- Quann, K., Jing, Y., Rigoutsos, I. Post-transcriptional regulation of BRCA1 through its coding sequence by the miR-15/107 group of miRNAs. Frontiers in Genetics. 6, 242 (2015).
- Saunus, J. M., et al. Posttranscriptional regulation of the breast cancer susceptibility gene BRCA1 by the RNA binding protein HuR. 암 연구학. 68 (22), 9469-9478 (2008).
- Knott1, G. J., Doudna, J. A. CRISPR-Cas guides the future of genetic engineering. Science. 361, 866-869 (2018).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nature Biotechnology. 32 (4), 347-355 (2014).
- Hess, G. T., et al. Directed evolution using dCas9-targeted somatic hypermutation in mammalian cells. Nature Methods. 13 (12), 1036-1042 (2016).
- Kim, K., et al. Highly efficient RNA-guided base editing in mouse embryos. Nature Biotechnology. 35 (5), 435-437 (2017).
- Komor, A. C., Kim, Y. B., Packer, M. S., Zuris, J. A., Liu, D. R. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature. 533 (7603), 420-424 (2016).
- Park, D. S., et al. Targeted Base Editing via RNA-Guided Cytidine Deaminases in Xenopus laevis Embryos. Molecules and Cells. 40 (11), 823-827 (2017).
- Kweon, J., et al. A CRISPR-based base-editing screen for the functional assessment of BRCA1 variants. Oncogene. 39 (1), 30-35 (2020).
- Gibson, D. G. Enzymatic assembly of overlapping DNA fragments. Methods in Enzymology. 498, 349-361 (2011).
- Nageshwaran, S., et al. CRISPR Guide RNA Cloning for Mammalian Systems. Journal of Visualized Experiments. (140), (2018).
- Findlay, G. M., et al. Accurate classification of BRCA1 variants with saturation genome editing. Nature. 562 (7726), 217-222 (2018).
- Kweon, J., Kim, D. E., Jang, A. H., Kim, Y. CRISPR/Cas-based customization of pooled CRISPR libraries. PLoS One. 13 (6), 0199473 (2018).
- Kim, Y., et al. A library of TAL effector nucleases spanning the human genome. Nature Biotechnology. 31 (3), 251-258 (2013).
- Sayers, E. W., et al. GenBank. Nucleic Acids Research. 47 (1), 94-99 (2019).
- Hwang, G. H., et al. Web-based design and analysis tools for CRISPR base editing. BMC Bioinformatics. 19 (1), 542 (2018).
- Kim, D., Kim, D. E., Lee, G., Cho, S. I., Kim, J. S. Genome-wide target specificity of CRISPR RNA-guided adenine base editors. Nature Biotechnology. 37 (4), 430-435 (2019).
- Clement, K., et al. CRISPResso2 provides accurate and rapid genome editing sequence analysis. Nature Biotechnology. 37 (3), 224-226 (2019).
- Hu, J. H., et al. Evolved Cas9 variants with broad PAM compatibility and high DNA specificity. Nature. 556 (7699), 57-63 (2018).
- Nishimasu, H., et al. Engineered CRISPR-Cas9 nuclease with expanded targeting space. Science. 361 (6408), 1259-1262 (2018).
- Walton, R. T., Christie, K. A., Whittaker, M. N., Kleinstiver, B. P. Unconstrained genome targeting with near-PAMless engineered CRISPR-Cas9 variants. Science. , (2020).
- Kim, D., et al. Genome-wide target specificities of CRISPR RNA-guided programmable deaminases. Nature Biotechnology. 35 (5), 475-480 (2017).
- Zuo, E., et al. Cytosine base editor generates substantial off-target single-nucleotide variants in mouse embryos. Science. 364 (6437), 289-292 (2019).
- Jin, S., et al. Cytosine, but not adenine, base editors induce genome-wide off-target mutations in rice. Science. 364 (6437), 292-295 (2019).
- Grunewald, J., et al. Transcriptome-wide off-target RNA editing induced by CRISPR-guided DNA base editors. Nature. 569 (7756), 433-437 (2019).
- Doman, J. L., Raguram, A., Newby, G. A., Liu, D. R. Evaluation and minimization of Cas9-independent off-target DNA editing by cytosine base editors. Nature Biotechnology. 38 (5), 620-628 (2020).
- Gaudelli, N. M., et al. Programmable base editing of A*T to G*C in genomic DNA without DNA cleavage. Nature. 551 (7681), 464-471 (2017).
- Anzalone, A. V., et al. Search-and-replace genome editing without double-strand breaks or donor DNA. Nature. 576 (7785), 149-157 (2019).

