Imagem de células vivas ROS durante o desenvolvimento neuronal
Summary
Este protocolo descreve o uso de um peróxido de hidrogênio geneticamente codificado (H2O2)-biosensor em neurônios e larvas de zebrafish cultivados para avaliar os papéis de sinalização fisiológica de H2O2 durante o desenvolvimento do sistema nervoso. Pode ser aplicado a diferentes tipos de células e modificado com tratamentos experimentais para estudar espécies reativas de oxigênio (ROS) no desenvolvimento geral.
Abstract
Espécies reativas de oxigênio (ROS) são moléculas de sinalização bem estabelecidas, que são importantes no desenvolvimento normal, homeostase e fisiologia. Entre os diferentes ROS, o peróxido de hidrogênio (H2O2) é melhor caracterizado em relação aos papéis na sinalização celular. H2O2 foi implicado durante o desenvolvimento em várias espécies. Por exemplo, um aumento transitório em H2O2 foi detectado em embriões de zebrafish durante os primeiros dias após a fertilização. Além disso, o esgotamento de uma importante fonte celular H2O2, NADPH oxidase (NOX), prejudica o desenvolvimento do sistema nervoso, como a diferenciação, o crescimento axonal e a orientação das células de gânglios retinianos (RGCs) tanto in vivo quanto in vitro. Aqui, descrevemos um método para imagem intracelular H2O2 níveis em neurônios de zebrafish cultivados e larvas inteiras durante o desenvolvimento usando o biosensor específico H2O2geneticamente codificado, roGFP2-Orp1. Esta sonda pode ser transitória ou stably expressa em larvas de zebrafish. Além disso, a leitura ratiométrica diminui a probabilidade de detectar artefatos devido à expressão genética diferencial ou efeitos de volume. Primeiro, demonstramos como isolar e cultivar RGCs derivados de embriões de zebrafish que expressam transitoriamente roGFP2-Orp1. Então, usamos larvas inteiras para monitorar os níveis de H2O2 no nível do tecido. O sensor foi validado pela adição de H2O2. Além disso, essa metodologia poderia ser usada para medir os níveis de H2O2 em tipos e tecidos celulares específicos, gerando animais transgênicos com expressão biosensora específica do tecido. Como os zebrafish facilitam manipulações genéticas e de desenvolvimento, a abordagem aqui demonstrada poderia servir como um pipeline para testar o papel de H2O2 durante o desenvolvimento neuronal e geral embrionário em vertebrados.
Introduction
A sinalização reativa da espécie oxigênio (ROS) regula o desenvolvimento e o funcionamento do sistema nervoso1. Uma importante fonte ros celular são as oxidases NADPH (NOX), que são proteínas transmembranas que geram superóxido e peróxido de hidrogênio (H2O2)2. Enzimas NOX são encontradas em todo o sistema nervoso central (CNS), e ros derivado do NOX contribuem para o desenvolvimento neuronal3,4,5,6. A manutenção e diferenciação das células-tronco neurais, o estabelecimento da polaridade neuronal, do crescimento do neurite e da plasticidade sináptica têm sido mostrados como necessários níveis adequados de ROS7,8,9,10,11. Por outro lado, a produção descontrolada de ROS por NOXes contribui para distúrbios neurodegenerativos, incluindo doença de Alzheimer, esclerose múltipla e lesão cerebral traumática12,13,14. Por isso, a produção de ROS fisiologicamente relevante é fundamental para a manutenção de condições saudáveis.
O desenvolvimento de biosensores geneticamente codificados facilitou muito a detecção de ROS celular. Uma vantagem importante dos biosensores geneticamente codificados é o aumento da resolução temporal e espacial do sinal ROS, pois esses sensores podem ser especificamente direcionados a locais distintos. O GFP sensível ao redox (roGFP) é um tipo desses biosensores ROS. A variante roGFP2-Orp1 detecta especificamente H2O2 através de seu domínio Orp1, que é uma proteína geneatoxitina de glutationa peroxiredoxina a partir da levedura15,16. A oxidação da proteína Orp1 é transferida para roGFP2 para alterar sua conformação (Figura 1A). A sonda exibe dois picos de excitação perto de 405 nm e 480 nm, e um único pico de emissão de 515 nm. Após a oxidação, a intensidade da fluorescência em torno dos picos de excitação muda: enquanto a excitação de 405 nm aumenta, a excitação de 480 nm diminui. Assim, roGFP2-Orp1 é um biosensor ratiométrico, e osníveisde H2O 2 são detectados pela razão de intensidades de fluorescência animadas em dois comprimentos de onda diferentes(Figura 1B). No geral, roGFP2-Orp1 é uma ferramenta versátil para imagens ROS que pode ser utilizada de forma eficiente in vivo.
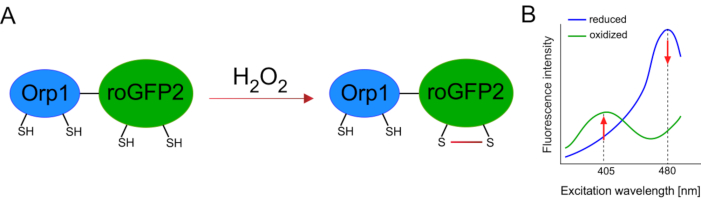
Figura 1: Espectros de representação e excitação esquemática de roGFP2-Orp1. (A) A transferência oxidante ocorre entre Orp1 e roGFP2 em resposta a H2O2, levando a alterações conformais no roGFP2. (B) O espectro de excitação do roGFP2-Orp1 exibe dois picos de excitação de 405 nm e 480 nm e pico de emissão única de 515 nm. Após a oxidação por H2O2,a excitação de 405 nm aumenta enquanto a excitação de 480 nm diminui. Isso resulta em uma leitura ratiométrica para a presença de H2O2. O número foi modificado de Bilan e Belousov (2017)16 e Morgan et al. (2011)25. Clique aqui para ver uma versão maior desta figura.
O sistema modelo Danio rerio (zebrafish) tem várias vantagens para aplicar biosensores geneticamente codificados. A transparência óptica dos embriões e larvas permite imagens in vivo não invasivas. Novas ferramentas de imagem estão sendo desenvolvidas para alcançar maior resolução e penetração mais profunda17. Além disso, existem ferramentas estabelecidas para manipulação genética (expressão ectópica mRNA, transgênese Tol2, etc.) e edição de genomas (TALENs, CRISPR/Cas9, etc.), que promove a geração de animais transgênicos18. À medida que os embriões de zebrafish se desenvolvem fora da mãe, este sistema permite ainda mais acesso e manipulação dos embriões. Por exemplo, injeções de estágio de uma célula e tratamentos medicamentosos podem ser facilmente feitos.
Aqui, usamos zebrafish para expressar transitoriamente o biosensor H2O2-específico roGFP2-Orp1 injetando mRNA in vitro transcrito. Esses embriões podem ser usados tanto para imagens in vitro de neurônios cultivados quanto para imagens in vivo (Figura 2). Descrevemos um protocolo para dissecar e emplacar células de gânglios de retina (RGCs) de embriões de zebrafish seguidos pela avaliação dos níveis de H2O2em neurônios cultivados. Em seguida, apresentamos um método para imagens in vivo de embriões e larvas que expressam roGFP2-Orp1 usando microscopia confocal. Esta abordagem não só permite determinar os níveis fisiológicos H2O2,mas também possíveis mudanças ocorridas em diferentes estágios ou condições de desenvolvimento. No geral, este sistema fornece um método confiável para detectar H2O2 em células vivas e animais para estudar o papel de H2O2 no desenvolvimento, saúde e doenças.
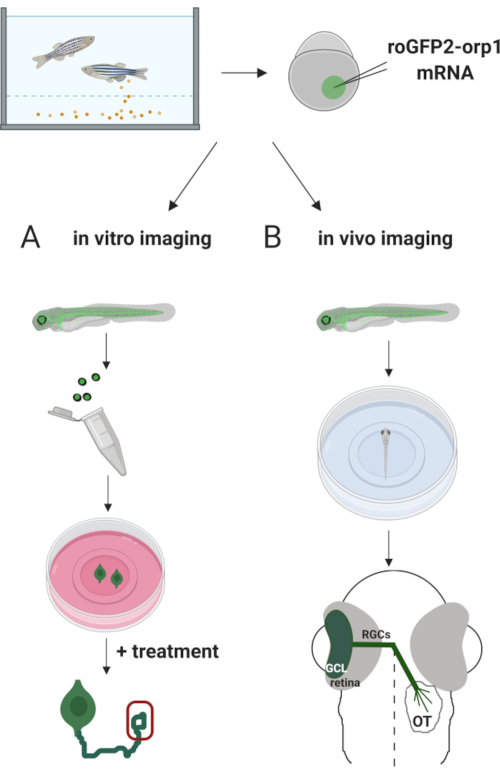
Figura 2. Esboço da abordagem experimental. Brevemente, após a coleta de embriões, roGFP2-Orp1 mRNA é injetado na gema de embriões de zebrafish estágio de uma célula. Embriões em desenvolvimento podem ser usados paraimagens in vitro ein vivo . ( A )Osembriões GFP positivos são usados para dissecar retinas para coleta de RGC a 34 hpf. Os RGCs dissociados são emplacados em tampas revestidas de PDL/laminina na mídia ZFCM (+). A imagem do cone de crescimento pode ser conduzida à medida que os RGCs estendem seus axônios após 6-24 h de revestimento. As células podem ser submetidas a diferentes tratamentos para medir as possíveis mudanças nos níveis de H2O2. Aqui, medimos h2O2 -níveisnos cones de crescimento de RGCs (vermelho). (B) Os embriões positivos GFP são utilizados para imagens in vivo. Na idade desejada, os embriões podem ser anestesiados e montados em pratos de fundo de vidro de 35 mm para imagens confocal. Aqui, os embriões são montados ventrally para imagem da retina. Esquema mostra desenvolvimento de retina em zebrafish. Os RGCs formam camada de células de glion (GCL), que é a camada mais interna da retina. Os axônios RGC desenvolvem-se em nervo óptico para cruzar a linha média, formando quiasmo óptico. Em seguida, os axônios RGC crescem dorsais para fazer sinapses no tectum óptico no cérebro médio. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Existem várias etapas críticas que precisam de atenção ao longo deste protocolo. Acreditamos que considerando esses pontos melhorará o fluxo experimental. Para a cultura primária do RGC, a esterilidade do ZFCM(-) é muito importante, uma vez que esta mídia cultural não contém antibióticos e a contaminação pode ocorrer antes ou durante a imagem. Para evitá-lo, aconselhamos preparar e usar ZFCM(-) somente dentro de um gabinete de biossegurança e fazer novas mídias ZFCM(-) regularmente (Passo 1.5). Além diss…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi apoiado pelos Institutos Nacionais de Saúde (Grant R01NS117701), National Science Foundation (Grant 1146944-IOS), Indiana Traumatic Spinal Cord and Brain Injury Research Fund (Grant 20000289), Purdue Research Foundation (Grant 209911) e pelo Escritório do Vice-Presidente Executivo de Pesquisa e Parcerias da Universidade Purdue (Grant 210362). Agradecemos ao Dr. Cory J. Weaver e Haley Roeder por estabelecerem o protocolo de cultura RGC de zebrafish. Agradecemos a Haley Roeder adicionalmente por fornecer os dados da Figura 4. Agradecemos a Leah Biasi e Kenny Nguyen pela ajuda com a cultura do RGC. Agradecemos a Gentry Lee por editar o texto. Agradecemos ao Dr. Tobias Dick por fornecer roGFP2-Orp1 e Dr. Qing Deng para o vetor pCS2+ contendo roGFP2-Orp1. A Figura 2 é criada com Biorender.com.
Materials
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
References
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).

