从预成型微气泡生产膜过滤相移十氟丁烷纳米滴
Summary
该协议描述了一种使用探针尖端超声处理产生大量脂质封装的十氟丁烷微气泡的方法,然后使用高压挤出和机械过滤将它们冷凝成相移纳米滴。
Abstract
有许多方法可用于生产用于成像和治疗的可蒸发相移液滴。每种方法都使用不同的技术,并且在价格,材料和目的方面有所不同。许多这些制造方法导致具有不均匀激活阈值的多分散群体。此外,控制液滴大小通常需要稳定的全氟碳液体,其高活化阈值在体内是不切实际的。使用低沸点气体产生均匀的液滴尺寸将有利于体内成像和治疗实验。本文介绍了一种简单而经济的方法,用于形成具有低沸点十氟丁烷(DFB)的尺寸过滤脂质稳定的相移纳米滴。描述了产生脂质微气泡的常用方法,以及一种在单个步骤中用高压挤出冷凝它们的新方法。该方法旨在节省时间,最大限度地提高效率,并使用许多生物实验室中的常见实验室设备为各种应用生成更大体积的微气泡和纳米滴解决方案。
Introduction
超声造影剂(UCA)在成像和治疗应用中迅速普及。微气泡是最初的UCAs,目前是临床诊断应用中使用的主流药物。微气泡是充满气体的球体,通常直径为1-10μm,周围是脂质、蛋白质或聚合物壳1。然而,它们的大小和体内稳定性会限制它们在许多应用中的功能。相移纳米滴含有过热的液芯,由于其尺寸更小,循环寿命更高,因此可以克服其中一些限制2。当暴露于热或声能时,过热的液芯蒸发形成气体微气泡2,3,4,5。由于汽化阈值与液滴大小5,6直接相关,因此配制大小均匀的液滴悬浮液对于实现一致的活化阈值是非常理想的。产生均匀液滴尺寸的配方方法通常复杂且成本高昂,而更具成本效益的方法则会产生多分散解决方案7。另一个限制是能够产生具有低沸点全氟化碳(PFC)气体的稳定相移液滴,这对于体内高效活化至关重要8。在这份手稿中,描述了一种方案,用于产生稳定的过滤的低沸点可汽化相移液滴,用于体内成像和治疗应用。
生产单分散亚微米相移液滴的方法有很多7。控制尺寸的最可靠方法之一是使用微流体装置。这些设备可能成本高昂,液滴产生速度慢(约104-106滴/秒)7,并且需要广泛的培训。微流体装置通常还需要高沸点气体,以避免系统自发汽化和堵塞7。然而,de Gracia Lux等人最近的一项研究表明,如何使用低沸点十氟丁烷(DFB)或八氟丙烷(OFP)冷却微流体来产生高浓度的亚微米相移(1010-1012 / mL)。
通常,低沸点气体(如DFB或OFP)使用预制气泡更容易处理。前体脂质稳定的气泡可以通过使用低温和高压冷凝气体来产生可蒸发的液滴5,10。使用该方法产生的液滴浓度取决于前体微气泡浓度和气泡转化为液滴的效率。据报道,从接近1010 MB / mL11的尖端超声处理 >中报告了浓缩微气泡,而另一项研究报告了来自冷凝的OFP和DFP气泡的约1-3 x1011 液滴浓度12。当单分散液滴不是问题时,冷凝方法是使用低沸点PFC产生脂质稳定相移液滴的最直接,成本最低的方法。在冷凝前产生均匀尺寸气泡的方法可以帮助创建更多的单分散液滴群。然而,产生单分散的前体气泡也很困难,需要更昂贵的方法,如微流体或重复的差异离心技术11。最近发表了一种使用脂质体中液滴的自发成核来生产DFB和OFB纳米滴的替代方法13。这种方法利用”茴香烈酒”效应,是一种产生低沸点PFC液滴的简单方法,无需冷凝气泡。PFC液滴的大小分布可以通过精细滴定和混合用于启动液滴成核的PFC,脂质和乙醇组分来控制。同样值得注意的是,全氟化合物的混合可用于控制纳米滴的稳定性和活化阈值14,15。Shakya等人最近的工作证明了如何通过乳化碳氢化合物内骨骼中的高沸点PFC来调节纳米液滴活化,以促进液滴核心内的异质成核16,这是一种可以与其他形式的液滴尺寸过滤一起考虑的方法。
一旦形成,相移液滴可以在形成后挤出,以产生更多的单分散种群。事实上,Kopechek等人之前已经发表了与这里描述的方法类似的协议,使用 高沸点十二氟戊烷(DDFP)作为液滴核心。希望使用具有高沸点全氟化碳(在室温下稳定)的相移液滴的读者应参考上述文章。产生和挤出具有低沸点气体的液滴(如DFB和OFP)更为复杂,最好通过冷凝预制气泡来处理。
在该协议中,描述了使用探针尖端超声处理用DFB气芯生成预制脂质微气泡的常用方法。接下来,使用商用挤出机将预制的微气泡冷凝成亚微滴(图1)。然后,产生的液滴可以通过热和超声波激活。与传统的缩合方法相比,该方法可以产生更大体积的纳米滴溶液,具有更窄的尺寸分布,而无需昂贵的微流体装置。生产具有窄尺寸分布的纳米滴溶液可能会产生更均匀的汽化阈值。这将最大限度地发挥它们在成像、消融、药物递送和栓塞等众多应用中的潜力1,3,4,6。
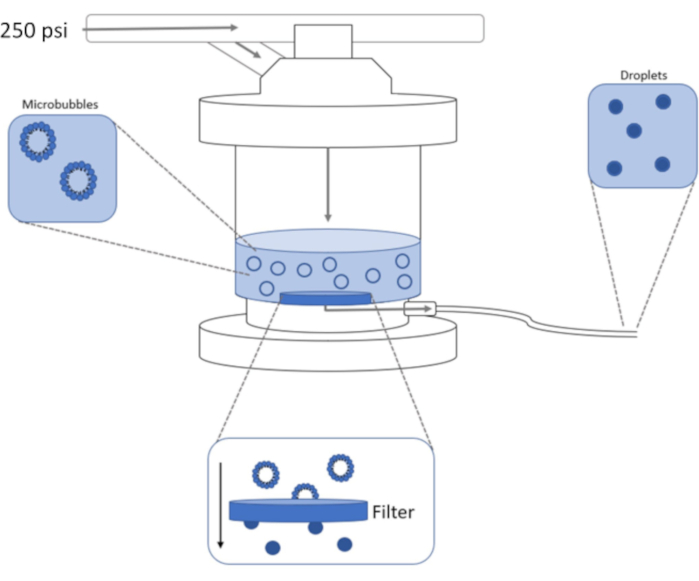
图1:用于将预制微气泡冷凝成相移纳米滴的高压挤出装置示意图。 微气泡溶液被添加到挤出机腔室中并包含在挤出机腔室中,并且从氮气罐中通过腔室进气阀施加250 psi。氮气将推动微气泡溶液通过腔室底部的过滤器,将样品冷凝成纳米滴。溶液最终通过样品出口管被挤出机推出并收集。 请点击此处查看此图的放大版本。
Protocol
Representative Results
Discussion
有一套全面的文献,讨论了微气泡和相移液滴在体内成像和治疗中的配方、物理原理和潜在应用。该讨论明确涉及产生脂质微气泡,并使用低沸点DFB气体和高压挤出将其转化为亚微米相移液滴。这里概述的方法旨在通过将先前的微气泡缩合方法与液滴挤出相结合,提供一种相对简单的生产大量脂质微气泡和DFB相移液滴的方法。这种方法具有产生高浓度气泡的优点,用于形成基于过滤器选择的具有?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
我们要感谢Ken Hoyt博士实验室的Dominique James为可蒸发的相移纳米滴提供TRSP分析。
Materials
| 15 mL Centrifuge Tubes | Falcon | 352095 | Collecting and centrifuging droplets |
| 200 nm polycarbonate filter | Whatman | 110606 | Extruder filters |
| 2-methylbutane | Fisher Chemical | 03551-4 | Rapid precooling of microbubble solution prior to extrusion |
| 3-prong clamps X2 | Fisher | 02-217-002 | Holding scintilation vials in place for probe tip sonication |
| 400W Analog Probe Tip Sonicator with Horn | Branson | 101-063-198R | Used to generate lipid microbubbles from lipid solution |
| Bath Sonicator | Fisher Scientific | 15337402 | Used to help breakdown liposomes into unilamellar vesicles |
| Chloroform | Fisher Bioreagents | C298-4 | Used to make lipid film for microbubble preperation |
| Decafluorobutane (Perfluorobutane) Gas | FluoroMed L.P. | 1 kg | generating microbubbles via probe tip sonication |
| Dry Ice | – | – | Rapid precooling of microbubble solution prior to extrusion |
| DSPC Lipid Powder | NOF America | COATSOME MC-8080 | Component of lipid film |
| DSPE-PEG-2K Lipid Powder | NOF America | SUNBRIGHT DSPE-020CN | Component of lipid film |
| General Thermometer | – | – | Used to measure ice bath temperature and 2-methylbutane temperature ( needs to accommodate -20C temperatures) |
| Glass Syringes | Hamilton | 81139 | Used to mix lipids in chloroform |
| Glycerol | Fisher Bioreagents | BP229-1 | Reduces freezing temperature of PBS solution |
| Heating Block | VWR Scientific Products | Heating lipid films and vaporizing droplets | |
| Lipex 10 mL Extruder | Evonik | Commercial high-pressure extrusion system | |
| Mini Vortex Mixer | Fisher brand | 14-955-151 | Used to remove excess chloroform from lipid films |
| Nitrogen Tank | – | – | Used to operate extruder |
| Phosphate Buffer Saline | Fisher Scientific | Hydrate lipid films and washing droplets | |
| Polyester Drain Disk | Whatman | 230600 | Provides support for polycarbonate filter |
| Polypropylene Caps | Fisher Scientific | 298417 | Used for solution storage |
| Propylene Glycol | Fisher Chemical | P355-1 | Reduces freezing temperature of PBS solution |
| Scintiliation Vials | DWK Life Sciences Wheaton | 986532 | Used for lipid films and microbubble generation |
| Small hammer | – | – | Used to break apart dry ice for cooling methylbutane |
| Sonicator Microtip Attachment | Branson | 101148070 | Used to generate microbubbles from lipid solution |
| Steel Container | Medegen | 79310 | Rapid precooling of microbubble solution prior to extrusion ( any container rated to -20C will work) |
| Vacuume Dessicator | Bel-Art SP Scienceware | 08-648-100 | Removes excess chloroform from lipid films |
| 2mL Centrifuge Tube | Fisher | 02682004 | Used for concentrating nanodroplets |
References
- Sirsi, S., Borden, M. Microbubble compositions, properties and biomedical applications. Bubble Science Engineering and Technology. 1 (1-2), 3-17 (2009).
- Sheeran, P. S., Dayton, P. A. Phase-change contrast agents for imaging and therapy. Current Pharmaceutical Design. 18 (15), 2152-2165 (2012).
- Mountford, P. A., Smith, W. S., Borden, M. A. Fluorocarbon nanodrops as acoustic temperature probes. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (39), 10656-10663 (2015).
- Mountford, P. A., Thomas, A. N., Borden, M. A. Thermal activation of superheated lipid-coated perfluorocarbon drops. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (16), 4627-4634 (2015).
- Sheeran, P. S., Luois, S., Dayton, P. A., Matsunaga, T. O. Formulation and acoustic studies of a new phase-shift agent for diagnostic and therapeutic ultrasound. Langmuir: The ACS Journal of Surfaces and Colloids. 27 (17), 10412-10420 (2011).
- Sheeran, P. S., Dayton, P. A. Improving the performance of phase-change perfluorocarbon droplets for medical ultrasonography: current progress, challenges, and prospects. Scientifica. 2014, 579684 (2014).
- Sheeran, P. S., et al. Methods of generating submicrometer phase-shift perfluorocarbon droplets for applications in medical ultrasonography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 64 (1), 252-263 (2017).
- Sheeran, P. S., et al. Decafluorobutane as a phase-change contrast agent for low-energy extravascular ultrasonic imaging. Ultrasound in Medicine & Biology. 37 (9), 1518-1530 (2011).
- de Gracia Lux, C., et al. Novel method for the formation of monodisperse superheated perfluorocarbon nanodroplets as activatable ultrasound contrast agents. RSC Advances. 7 (77), 48561-48568 (2017).
- Mountford, P. A., Sirsi, S. R., Borden, M. A. Condensation phase diagrams for lipid-coated perfluorobutane microbubbles. Langmuir: The ACS Journal of Surfaces and Colloids. 30 (21), 6209-6218 (2014).
- Feshitan, J. A., Chen, C. C., Kwan, J. J., Borden, M. A. Microbubble size isolation by differential centrifugation. Journal of Colloid and Interface Science. 329 (2), 316-324 (2009).
- Wu, S. -. Y., et al. Focused ultrasound-facilitated brain drug delivery using optimized nanodroplets: vaporization efficiency dictates large molecular delivery. Physics in Medicine and Biology. 63 (3), 035002 (2018).
- Li, D. S., et al. Spontaneous Nucleation of stable perfluorocarbon emulsions for ultrasound contrast agents. Nano Letters. 19 (1), 173-181 (2019).
- Sheeran, P. S., Luois, S. H., Mullin, L. B., Matsunaga, T. O., Dayton, P. A. Design of ultrasonically-activatable nanoparticles using low boiling point perfluorocarbons. Biomaterials. 33 (11), 3262-3269 (2012).
- Kawabata, K., Sugita, N., Yoshikawa, H., Azuma, T., Umemura, S. Nanoparticles with multiple perfluorocarbons for controllable ultrasonically induced phase shifting. Japanese Journal of Applied Physics. 44 (6), 4548-4552 (2005).
- Shakya, G., et al. Vaporizable endoskeletal droplets via tunable interfacial melting transitions. Science Advances. 6 (14), 7188 (2020).
- Kopechek, J. A., Zhang, P., Burgess, M. T., Porter, T. M. Synthesis of phase-shift nanoemulsions with narrow size distributions for acoustic droplet vaporization and bubble-enhanced ultrasound-mediated ablation. Journal of Visualized Experiments: JoVE. (67), e4308 (2012).

