Production de nanogouttelettes de décafluorobutane à déphasage filtrées par membrane à partir de microbulles préformées
Summary
Ce protocole décrit une méthode de génération de grands volumes de microbulles de décafluorobutane encapsulées par lipides en utilisant la sonication de la pointe de la sonde, puis de les condenser en nanogouttelettes à déphasage à l’aide d’une extrusion à haute pression et d’une filtration mécanique.
Abstract
Il existe de nombreuses méthodes qui peuvent être utilisées pour la production de gouttelettes à déphasage vaporisables pour l’imagerie et la thérapie. Chaque méthode utilise des techniques différentes et varie en prix, en matériaux et en objectif. Bon nombre de ces méthodes de fabrication aboutissent à des populations polydispersées avec des seuils d’activation non uniformes. De plus, le contrôle de la taille des gouttelettes nécessite généralement des liquides perfluorocarbures stables avec des seuils d’activation élevés qui ne sont pas pratiques in vivo. La production de gouttelettes uniformes à l’aide de gaz à faible point d’ébullition serait bénéfique pour les expériences d’imagerie et de thérapie in vivo. Cet article décrit une méthode simple et économique pour la formation de nanogouttelettes à déphasage stabilisées par lipides filtrées avec du décafluorobutane à point d’ébullition bas (DFB). Une méthode courante de génération de microbulles lipidiques est décrite, en plus d’une nouvelle méthode de condensation par extrusion à haute pression en une seule étape. Cette méthode est conçue pour gagner du temps, maximiser l’efficacité et générer de plus grands volumes de solutions de microbulles et de nanogouttelettes pour une grande variété d’applications utilisant des équipements de laboratoire courants trouvés dans de nombreux laboratoires biologiques.
Introduction
Les agents de contraste à ultrasons (UCA) gagnent rapidement en popularité pour les applications d’imagerie et de thérapie. Les microbulles, les UCA originales, sont actuellement les agents courants utilisés dans les applications de diagnostic clinique. Les microbulles sont des sphères remplies de gaz, généralement de 1 à 10 μm de diamètre, entourées de lipides, de protéines ou de coquilles de polymères1. Cependant, leur taille et leur stabilité in vivo peuvent limiter leur fonctionnalité dans de nombreuses applications. Les nanogouttelettes à déphasage, qui contiennent un noyau liquide surchauffé, peuvent surmonter certaines de ces limitations en raison de leur plus petite taille et de leur durée de vie améliorée2. Lorsqu’il est exposé à la chaleur ou à l’énergie acoustique, le noyau liquide surchauffé se vaporise pour former une microbulle de gaz2,3,4,5. Étant donné que le seuil de vaporisation est directement lié à la taille des gouttelettes5,6, il serait hautement souhaitable de formuler des suspensions de gouttelettes de taille uniforme pour atteindre des seuils d’activation cohérents. Les méthodes de formulation qui produisent des tailles de gouttelettes uniformes sont souvent complexes et coûteuses, tandis que les approches plus rentables aboutissent à des solutions polydispersées7. Une autre limitation est la capacité de générer des gouttelettes à déphasage stables avec des gaz perfluorocarbonés (PFC) à faible point d’ébullition, ce qui est essentiel pour une activation efficace in vivo8. Dans ce manuscrit, un protocole est décrit pour générer des gouttelettes de déphasage vaporisables à point d’ébullition filtrées stables pour des applications d’imagerie et de thérapie in vivo.
Il existe de nombreuses méthodes de production de gouttelettes à déphasage submicroniques monodispersées7. L’une des méthodes les plus robustes de contrôle de la taille est l’utilisation de dispositifs microfluidiques. Ces appareils peuvent être coûteux, avoir des taux de production de gouttelettes lents (~104-106 gouttelettes/s)7, et nécessiter une formation approfondie. Les dispositifs microfluidiques nécessitent également généralement des gaz à point d’ébullition élevé pour éviter la vaporisation spontanée et le colmatage du système7. Cependant, une étude récente de de Gracia Lux et al.9 démontre comment le refroidissement d’un microfluidisateur peut être utilisé pour générer des concentrations élevées de déphasage submicronique (1010-1012 / mL) en utilisant du décafluorobutane à point d’ébullition bas (DFB) ou de l’octafluoropropane (OFP).
En général, les gaz à point d’ébullition bas tels que le DFB ou l’OFP sont plus faciles à manipuler à l’aide de bulles de gaz préformées. Des gouttelettes vaporisables peuvent être produites à partir de bulles stabilisées par les lipides précurseurs en condensant le gaz à basse température et à pression élevée5,10. La concentration de gouttelettes produites à l’aide de cette méthode dépend de la concentration en microbulles précurseurs et de l’efficacité de la conversion des bulles en gouttelettes. Des microbulles concentrées ont été rapportées à partir d’une sonication de pointe approchant > 1010 MB / mL11, tandis qu’une étude distincte a rapporté des concentrations de gouttelettes allant de ~ 1-3 x1011 gouttelettes / mL de bulles condensées OFP et DFP12. Lorsque les gouttelettes monodispersées ne sont pas préoccupantes, les méthodes de condensation sont les méthodes les plus simples et les moins coûteuses pour générer des gouttelettes à déphasage stabilisées par les lipides à l’aide de PFC à point d’ébullition bas. Les méthodes de génération de bulles de taille uniforme avant la condensation peuvent aider à créer des populations de gouttelettes plus monodispersées. Cependant, la génération de bulles précurseurs monodispersées est également difficile, nécessitant des approches plus coûteuses telles que la microfluidique ou les techniques de centrifugation différentielle répétée11. Une approche alternative pour produire des nanogouttelettes DFB et OFB a récemment été publiée en utilisant la nucléation spontanée de gouttelettes dans les liposomes13. Cette méthode, utilisant un effet « Ouzo », est un moyen simple de générer des gouttelettes de PFC à faible point d’ébullition sans avoir besoin de condenser des bulles. La distribution granulométrique des gouttelettes de PFC peut être contrôlée par un titrage délicat et un mélange de composants PFC, lipidiques et éthanol utilisés pour initier la nucléation des gouttelettes. Il convient également de noter que le mélange de perfluorocarbures peut être utilisé pour contrôler la stabilité et les seuils d’activation des nanogouttelettes14,15. Des travaux plus récents de Shakya et al. démontrent comment l’activation des nanogouttelettes peut être réglée en émulsionnant des PFC à point d’ébullition élevé dans un endosquelette d’hydrocarbures pour faciliter la nucléation hétérogène dans le noyau de gouttelettes16, ce qui est une approche qui peut être envisagée avec d’autres formes de filtration de la taille des gouttelettes.
Une fois formées, les gouttelettes à déphasage peuvent être extrudées après la formation pour créer des populations plus monodispersées. En fait, un protocole similaire à la méthode décrite ici a été publié précédemment par Kopechek et al.17 en utilisant le dodécofluorpentane à point d’ébullition élevé (DDFP) comme noyau de gouttelettes. Les lecteurs qui cherchent à utiliser des gouttelettes à déphasage avec des perfluorocarbures à point d’ébullition élevé (stables à température ambiante) devraient plutôt se référer à l’article ci-dessus. La génération et l’extrusion de gouttelettes avec des gaz à faible point d’ébullition, tels que DFB et OFP, sont plus compliquées et sont mieux approchées en condensant des bulles de gaz préformées.
Dans ce protocole, une méthode courante de génération de microbulles lipidiques préformées avec un noyau de gaz DFB à l’aide de la sonication de la pointe de la sonde est décrite. Ensuite, une extrudeuse commerciale est utilisée pour condenser des microbulles préformées en nanogouttelettes à déphasage submicroniques (Figure 1). Les gouttelettes résultantes sont ensuite activables par la chaleur et les ultrasons. Cette méthode peut produire de plus grands volumes de solution de nanogouttelettes que les méthodes de condensation conventionnelles avec des distributions de taille plus étroites sans avoir besoin de dispositifs microfluidiques coûteux. La production de solutions de nanogouttelettes avec des distributions de taille étroite peut probablement générer des seuils de vaporisation plus uniformes. Cela maximisera leur potentiel pour de nombreuses applications telles que l’imagerie, l’ablation, l’administration de médicaments et l’embolisation1,3,4,6.
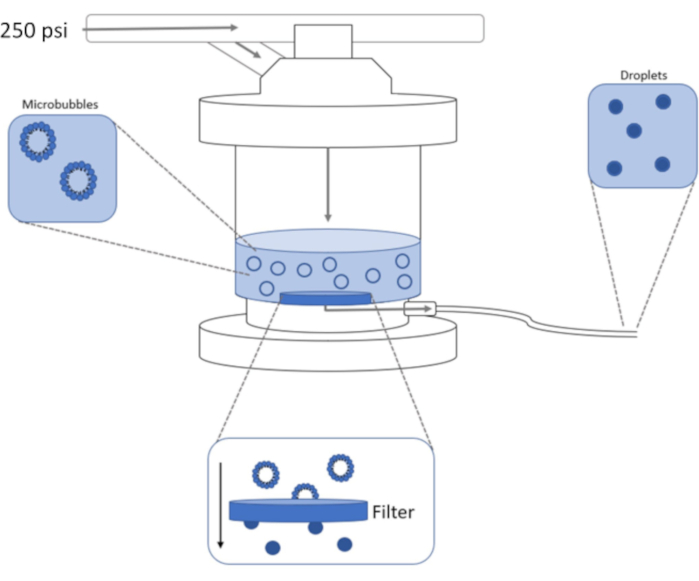
Figure 1 : Schéma de la configuration d’extrusion à haute pression pour la condensation de microbulles préformées en nanogouttelettes à déphasage. Une solution de microbulles est ajoutée et contenue dans la chambre d’extrusion, et 250 psi, à partir du réservoir d’azote, sont appliqués à travers la vanne d’entrée de la chambre. L’azote gazeux poussera la solution de microbulles à travers le filtre à la base de la chambre, condensant l’échantillon en nanogouttelettes. La solution est finalement poussée hors de l’extrudeuse à travers le tube de sortie de l’échantillon et collectée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Un corpus complet de littérature est disponible qui traite de la formulation, de la physique et des applications potentielles des microbulles et des gouttelettes à déphasage pour l’imagerie et la thérapie in vivo. Cette discussion porte explicitement sur la génération de microbulles lipidiques et leur conversion en gouttelettes à déphasage submicroniques à l’aide d’un gaz DFB à faible point d’ébullition et d’une extrusion à haute pression. La méthode décrite ici vise à fournir une méthode relati…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nous tenons à remercier Dominique James dans le laboratoire du Dr Ken Hoyt d’avoir fourni une analyse TRSP de nanogouttelettes à déphasage vaporisables
Materials
| 15 mL Centrifuge Tubes | Falcon | 352095 | Collecting and centrifuging droplets |
| 200 nm polycarbonate filter | Whatman | 110606 | Extruder filters |
| 2-methylbutane | Fisher Chemical | 03551-4 | Rapid precooling of microbubble solution prior to extrusion |
| 3-prong clamps X2 | Fisher | 02-217-002 | Holding scintilation vials in place for probe tip sonication |
| 400W Analog Probe Tip Sonicator with Horn | Branson | 101-063-198R | Used to generate lipid microbubbles from lipid solution |
| Bath Sonicator | Fisher Scientific | 15337402 | Used to help breakdown liposomes into unilamellar vesicles |
| Chloroform | Fisher Bioreagents | C298-4 | Used to make lipid film for microbubble preperation |
| Decafluorobutane (Perfluorobutane) Gas | FluoroMed L.P. | 1 kg | generating microbubbles via probe tip sonication |
| Dry Ice | – | – | Rapid precooling of microbubble solution prior to extrusion |
| DSPC Lipid Powder | NOF America | COATSOME MC-8080 | Component of lipid film |
| DSPE-PEG-2K Lipid Powder | NOF America | SUNBRIGHT DSPE-020CN | Component of lipid film |
| General Thermometer | – | – | Used to measure ice bath temperature and 2-methylbutane temperature ( needs to accommodate -20C temperatures) |
| Glass Syringes | Hamilton | 81139 | Used to mix lipids in chloroform |
| Glycerol | Fisher Bioreagents | BP229-1 | Reduces freezing temperature of PBS solution |
| Heating Block | VWR Scientific Products | Heating lipid films and vaporizing droplets | |
| Lipex 10 mL Extruder | Evonik | Commercial high-pressure extrusion system | |
| Mini Vortex Mixer | Fisher brand | 14-955-151 | Used to remove excess chloroform from lipid films |
| Nitrogen Tank | – | – | Used to operate extruder |
| Phosphate Buffer Saline | Fisher Scientific | Hydrate lipid films and washing droplets | |
| Polyester Drain Disk | Whatman | 230600 | Provides support for polycarbonate filter |
| Polypropylene Caps | Fisher Scientific | 298417 | Used for solution storage |
| Propylene Glycol | Fisher Chemical | P355-1 | Reduces freezing temperature of PBS solution |
| Scintiliation Vials | DWK Life Sciences Wheaton | 986532 | Used for lipid films and microbubble generation |
| Small hammer | – | – | Used to break apart dry ice for cooling methylbutane |
| Sonicator Microtip Attachment | Branson | 101148070 | Used to generate microbubbles from lipid solution |
| Steel Container | Medegen | 79310 | Rapid precooling of microbubble solution prior to extrusion ( any container rated to -20C will work) |
| Vacuume Dessicator | Bel-Art SP Scienceware | 08-648-100 | Removes excess chloroform from lipid films |
| 2mL Centrifuge Tube | Fisher | 02682004 | Used for concentrating nanodroplets |
References
- Sirsi, S., Borden, M. Microbubble compositions, properties and biomedical applications. Bubble Science Engineering and Technology. 1 (1-2), 3-17 (2009).
- Sheeran, P. S., Dayton, P. A. Phase-change contrast agents for imaging and therapy. Current Pharmaceutical Design. 18 (15), 2152-2165 (2012).
- Mountford, P. A., Smith, W. S., Borden, M. A. Fluorocarbon nanodrops as acoustic temperature probes. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (39), 10656-10663 (2015).
- Mountford, P. A., Thomas, A. N., Borden, M. A. Thermal activation of superheated lipid-coated perfluorocarbon drops. Langmuir: The ACS Journal of Surfaces and Colloids. 31 (16), 4627-4634 (2015).
- Sheeran, P. S., Luois, S., Dayton, P. A., Matsunaga, T. O. Formulation and acoustic studies of a new phase-shift agent for diagnostic and therapeutic ultrasound. Langmuir: The ACS Journal of Surfaces and Colloids. 27 (17), 10412-10420 (2011).
- Sheeran, P. S., Dayton, P. A. Improving the performance of phase-change perfluorocarbon droplets for medical ultrasonography: current progress, challenges, and prospects. Scientifica. 2014, 579684 (2014).
- Sheeran, P. S., et al. Methods of generating submicrometer phase-shift perfluorocarbon droplets for applications in medical ultrasonography. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 64 (1), 252-263 (2017).
- Sheeran, P. S., et al. Decafluorobutane as a phase-change contrast agent for low-energy extravascular ultrasonic imaging. Ultrasound in Medicine & Biology. 37 (9), 1518-1530 (2011).
- de Gracia Lux, C., et al. Novel method for the formation of monodisperse superheated perfluorocarbon nanodroplets as activatable ultrasound contrast agents. RSC Advances. 7 (77), 48561-48568 (2017).
- Mountford, P. A., Sirsi, S. R., Borden, M. A. Condensation phase diagrams for lipid-coated perfluorobutane microbubbles. Langmuir: The ACS Journal of Surfaces and Colloids. 30 (21), 6209-6218 (2014).
- Feshitan, J. A., Chen, C. C., Kwan, J. J., Borden, M. A. Microbubble size isolation by differential centrifugation. Journal of Colloid and Interface Science. 329 (2), 316-324 (2009).
- Wu, S. -. Y., et al. Focused ultrasound-facilitated brain drug delivery using optimized nanodroplets: vaporization efficiency dictates large molecular delivery. Physics in Medicine and Biology. 63 (3), 035002 (2018).
- Li, D. S., et al. Spontaneous Nucleation of stable perfluorocarbon emulsions for ultrasound contrast agents. Nano Letters. 19 (1), 173-181 (2019).
- Sheeran, P. S., Luois, S. H., Mullin, L. B., Matsunaga, T. O., Dayton, P. A. Design of ultrasonically-activatable nanoparticles using low boiling point perfluorocarbons. Biomaterials. 33 (11), 3262-3269 (2012).
- Kawabata, K., Sugita, N., Yoshikawa, H., Azuma, T., Umemura, S. Nanoparticles with multiple perfluorocarbons for controllable ultrasonically induced phase shifting. Japanese Journal of Applied Physics. 44 (6), 4548-4552 (2005).
- Shakya, G., et al. Vaporizable endoskeletal droplets via tunable interfacial melting transitions. Science Advances. 6 (14), 7188 (2020).
- Kopechek, J. A., Zhang, P., Burgess, M. T., Porter, T. M. Synthesis of phase-shift nanoemulsions with narrow size distributions for acoustic droplet vaporization and bubble-enhanced ultrasound-mediated ablation. Journal of Visualized Experiments: JoVE. (67), e4308 (2012).

