Количественный анализ визуализации in vitro для фагоцитоза мертвых клеток нейробластомы iPSC-макрофагами
Summary
Нейродегенеративные заболевания связаны с дисрегулируемыми функциями микроглии. В данной статье описан анализ in vitro фагоцитоза клеток нейробластомы iPSC-макрофагами. Количественные показания микроскопии описаны как для покадровой визуализации живых клеток, так и для визуализации с высоким содержанием в фиксированных клетках.
Abstract
Микроглия организует нейроиммунные реакции при нескольких нейродегенеративных заболеваниях, включая болезнь Паркинсона и болезнь Альцгеймера. Микроглия очищает мертвые и умирающие нейроны через процесс эффероцитоза, специализированной формы фагоцитоза. Функция фагоцитоза может быть нарушена экологическими или генетическими факторами риска, которые влияют на микроглию. В данной работе представлен быстрый и простой протокол микроскопии in vitro для изучения эффероцитоза микроглии в модели микроглии индуцированных плюрипотентных стволовых клеток (iPSC) с использованием клеточной линии нейробластомы человека (SH-SY5Y), помеченной pH-чувствительным красителем для фагоцитарного груза. Процедура приводит к высокому выходу мертвых клеток нейробластомы, которые отображают поверхностный фосфатидилсерин, распознаваемый фагоцитами как сигнал «съесть меня». 96-скважинный пластинчатый анализ подходит для покадровой визуализации живых клеток, или пластина может быть успешно зафиксирована перед дальнейшей обработкой и количественно определена с помощью микроскопии с высоким содержанием. Микроскопия с высоким содержанием фиксированных клеток позволяет масштабировать анализ для скрининга ингибиторов малых молекул или оценки фагоцитарной функции генетических вариантов линий iPSC. Хотя этот анализ был разработан для изучения фагоцитоза целых мертвых клеток нейробластомы iPSC-макрофагами, анализ может быть легко адаптирован для других грузов, имеющих отношение к нейродегенеративным заболеваниям, таких как синаптосомы и миелин, а также другие типы фагоцитарных клеток.
Introduction
Микроглия является макрофагами- резидентами ткани мозга, и их функции включают иммунный надзор, координацию воспалительных реакций на травму / инфекцию, синаптическое ремоделирование и фагоцитоз мертвых клеток, миелина, белковых агрегатов и патогенов. Фагоцитоз — это процесс, с помощью которого микроглия распознает груз с поверхностными рецепторами и реорганизует их цитоскелет, чтобы поглотить объект в фагосому, которая затем сливается с лизосомами для деградации груза. Здоровая микроглия фагоцитозы апоптотических клеток мозга удаляет их до того, как они станут некротическими1. Фагоцитоз апоптотических клеток также известен как эффероцитоз и требует отображения сигнала фосфатидилсерина «съесть меня» умирающей клеткой2. Многочисленные рецепторы микроглии напрямую связываются с фосфатидилсерином, включая TIM-4, BAI1, Stabilin-2 и TREM2. Микроглиальные TAM-рецепторы (например, MERTK) и интегрины косвенно связываются с фосфатидилсерином, используя вспомогательные белки GAS6 или MFG-E8 соответственно. Другие сигналы «съесть меня» могут быть необходимы для распознавания умирающих клеток, к ним относятся изменения гликозилирования или заряда поверхностных белков; экспрессия внутриклеточных белков ICAM3, калретикулина, аннексина-I на поверхности клетки; окисленные ЛПНП; или покрытие апоптотической клетки микроглией, продуцируемым комплементом C1q1,2.
Нейродегенеративные заболевания, включая болезнь Паркинсона, болезнь Альцгеймера, лобно-височную деменцию и боковой амиотрофический склероз, были связаны с нарушением функции микроглии, включая накопление продуктов жизнедеятельности мозга, таких как мертвые клетки, фрагменты миелина и белковые агрегаты, и преувеличенные воспалительные реакции на эти стимулы3. Фагоцитоз может быть нарушен при нейродегенеративных заболеваниях и способствовать патологии, обусловленной сочетанием старения, воспаления или специфических вариантов генетического риска4,5. С другой стороны, есть также данные из животных моделей нейродегенеративных заболеваний, что микроглия может ненадлежащим образом фагоцитозировать жизнеспособные нейроны или синапсы6,7,8. Механизм, вероятно, будет спровоцирован фосфатидилсериновой дисплеем поврежденных нейритов, который непосредственно ощущается рецепторами фагоцитоза микроглии TREM2 или GPR56 или косвенно ощущается растворимым комплементом C1q, покрывающий обогащенную фосфатидилсерином мембрану, что приводит к CR3-опосредованный фагоцитоз9,10,11.
In vitro анализы функции фагоцитоза, например, для оценки фенотипического воздействия варианта генетического риска в микроглии, часто выполняются с использованием нефизиологических грузов, таких как латексные шарики4. Также используются флуоресцентно меченые бактерии и зимозан, которые являются физиологическими, но не имеют отношения к нейродегенеративным заболеваниям. Нефизиологические фагоцитарные грузы могут быть использованы для обнаружения дефектов в основном механизме фагоцитарного поглощения, но не могут точно смоделировать первый шаг «распознавания» в фагоцитозе апоптотических нейронов. Размер, форма, жесткость и тип груза также диктуют внутриклеточные сигнальные пути, которые активируются, что приводит к различным результатам состояния активации микроглии. Например, бактерии E.coli маленькие и жесткие, в отличие от клеток человека, а липополисахариды на их поверхности распознаются Toll-подобным рецептором 4 (TLR4), который активирует фагоцитоз и провоспалительные сигнальные пути2,12.
В контексте исследований нейродегенеративных заболеваний более релевантный фагоцитарный груз будет иметь фосфатидилсерин на плазматических мембранах млекопитающих и в идеале будет человеческим и нейронным, включая сигналы, с которыми может столкнуться микроглия. Для этого протокола фагоцитоза клеточная линия нейробластомы человека SH-SY5Y была выбрана в качестве модели нейрона, которую легко культивировать. Постоянный поверхностный дисплей фосфатидилсерина был искусственно индуцирован параформальдегидом, который, как было ранее показано, вызывает фосфатидилсериновый дисплей тромбоцитов13. Для модели клеток микроглии человека использовались iPSC-макрофаги, которые имитируют онтогенез и транскрипционный профиль микроглии человека и являются фагоцитически компетентными14,15,16,17. iPSC-макрофаги не являются самой аутентичной моделью микроглии, например, они не имитируют морфологию микроглии; однако при желании его можно заменить более аутентичной монокультурной iPSC-моделью микроглии, такой как Haenseler et al.15. Модели iPSC человека предпочтительнее первичных микроглий грызунов для изучения нейродегенерации из-за опасений по поводу ограниченного перекрытия транскрипционных модулей микроглии, наблюдаемых в тканях нейродегенеративных заболеваний человека имыши18. Мертвые SH-SY5Y окрашиваются кислотно-чувствительным красителем, который слабо флуоресцирует при нейтральном рН и сильнее внутри фаголизосом iPSC-макрофагов после фагоцитоза. Использование кислоточувствительного красителя повышает точность обнаружения фагоцитарных событий, с универсальностью для различных считывания живых и фиксированных макрофагов19. Этот протокол описывает как покадровую визуализацию фагоцитоза живыми клетками, так и фиксированный анализ изображений с высоким содержанием для фагоцитоза с теми же этапами подготовки клеток до считывания(рисунок 1).
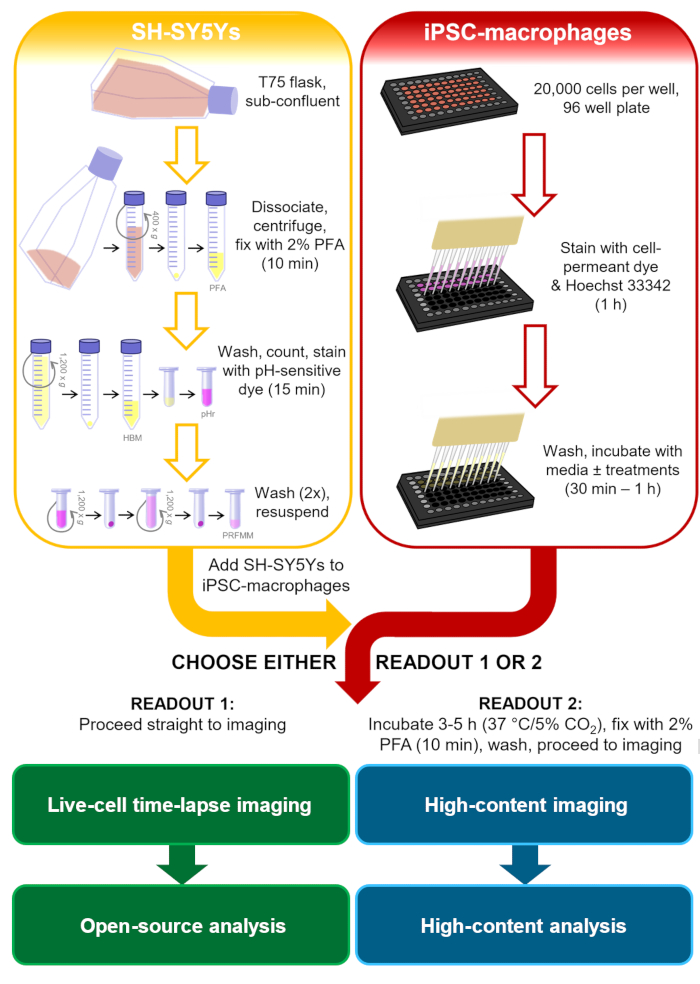
Рисунок 1:Принципиальная схема методологии. Контур анализа фагоцитоза, где параллельно проводится подготовка SH-SY5Ys и окрашивание iPSC-макрофагов, а затем SH-SY5Ys пипетируются на iPSC-макрофаги. Либо покадровая визуализация живых клеток выполняется немедленно, либо клетки инкубируют при 37 °C / 5% CO2 в течение требуемой продолжительности и фиксируют перед выполнением микроскопии с высоким содержанием. PFA: параформальдегид, HBM: фенольные красные буферизованные среды HEPES, pHr: pH-чувствительный красный флуоресцентный раствор красителя STP Ester, PRFMM: фенольные среды макрофагов без красного цвета. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Микроглии обладают важными функциями, которые влияют на инициацию и прогрессирование нейродегенеративных заболеваний, включая фагоцитоз апоптотических нейронов. Нарушение фагоцитоза микроглии и неадекватный фагоцитоз синапсов были связаны с нейродегенеративными заболеваниями, хотя основные механизмы и причинно-следственная связь не совсем понятны4,23. В этой статье описывается анализ фагоцитоза для измерения фагоцитоза апоптотических клеток iPSC-макрофагами с помощью либо считывания покадровой визуализации живых клеток, либо с микроскопией с фиксированными клетками с высоким содержанием, либо комбинацией обоих на одном анализе. Эта универсальность означает, что анализ может быть использован для изучения отдельных фагоцитарных событий с течением времени в нескольких скважинах или использован для скрининга с высоким содержанием с несколькими состояниями или методами лечения. Поскольку анализ с высоким содержанием фиксируется в одной точке времени, одновременно могут быть подготовлены несколько пробирных пластин. Анализ с высоким содержанием имеет потенциальную полезность для характеристики макрофагов / микроглии с генетическими вариантами, связанными с заболеванием, или скрининга ингибиторов малых молекул на наличие изменений фагоцитоза. Анализ также может быть легко адаптирован для изучения фагоцитоза других моделей микроглии или потенциально астроцитов. Анализ фагоцитоза потенциально может быть мультиплексирован пятнами визуализации живых клеток, например, индикаторами митохондрий, кальция или АФК, и может быть выполнено постфиксационное иммунофлуоресцентное окрашивание для белков, представляющих интерес. По сравнению с существующими анализами фагоцитоза, которые используют апоптотические нейрональные клетки, основные преимущества, которые дает этот протокол, заключается в том, что подготовка фагоцитарного груза относительно проста и быстра и приводит к однородным продуктам. Другие анализы индуцируют апоптоз нейронов или SH-SY5Ys с S-нитрозо-L-цистеином в течение 2 ч25,окадаевой кислотой в течение 3 ч22,ставроспорином в течение 4-16 ч26,27,28,29 или УФ-облучением в течение 24 ч30,и могут приводить к клеткам на разных стадиях апоптоза. Кроме того, изображения живых клеток и показания изображений с высоким содержанием ранее не были описаны, насколько известно авторам. Основным ограничением использования параформальдегид-фиксации для приготовления фагоцитарного груза является то, что он не полностью рекапитулирует процесс апоптоза, поскольку фиксация препятствует расщеплению клеток на апоптотические тела, которые, вероятно, будут фагоцитозироваться быстрее из-за их меньших размеров. Неизвестно, какое влияние оказывает фиксация на секрецию нуклеотидных сигналов «найди меня» (например, АТФ, УДФ) от клетки-мишени, которая притягивает фагоциты. Подобно апоптотическим клеткам, фиксированные SH-SY5Ys проявляют некоторую мембранную проницаемость для йодида пропидия. Мембранная проницаемость связана с выделением сигналов «найди меня»; однако это не было изучено в фиксированных SH-SY5Ys, и если нуклеотиды высвобождаются слишком быстро, они будут смыты до того, как SH-SY5Ys будут добавлены к iPSC-макрофагам.
Первым критическим шагом в протоколе является окрашивание мертвого SH-SY5Ys эфиром STP чувствительного к pH красного флуоресцентного красителя. Этот краситель быстро и ковалентно реагирует со свободными первичными аминами на поверхности мертвого SH-SY5Ys. Длительность окрашивания не нужно оптимизировать; однако необходимо соблюдать осторожность при обращении с красителем перед маркировкой. Реакция маркировки не должна проводиться в буферах, содержащих свободные амины. Кроме того, существует риск осадков, если запас ДМСО разбавляется в холодном водном буфере или в высокой конечной концентрации. Осадки будут появляться в виде плотных темных объектов под микроскопом. Кроме того, pH-чувствительный раствор красителя прилипает к обычным пластиковым центрифужным трубкам и медленно смывается; поэтому на этапе маркировки рекомендуются трубки с низким связыванием. Использование pH-чувствительного красителя вместо постоянно флуоресцентного красителя помогает идентифицировать поглощенные частицы по сравнению с частицами, которые соседствуют с плазматической мембраной. Поскольку существует некоторая флуоресценция при нейтральном рН, плотность фагоцитарного груза и iPSC-макрофагов должна быть достаточно низкой для точной сегментации, хотя и достаточно высокой, чтобы захватывались многочисленные фагоцитарные события. Высокосодержимая микроскопия была способна точно идентифицировать фагоцитоз со средней плотностью груза в скважине (более 2 SH-SY5Ys на iPSC-макрофаг). И наоборот, из-за более слабой чувствительности микроскопа в темно-красном спектре сегментация iPSC-макрофагов в данных покадровой визуализации живых клеток была менее уверенной и необходимо было использовать очень низкую плотность груза для снижения вероятности ложных срабатываний (1 SH-SY5Y на каждые два iPSC-макрофага). Валидация надлежащей сегментации и плотности груза должна проводиться со сравнением необработанных скважин и скважин, обработанных цитохалазином D. В хорошо оптимизированном анализе цитохалазин D должен уменьшить среднее количество пятен на клетку на 90% по сравнению с необработанными образцами.
Другим важным шагом в протоколе является окрашивание iPSC-макрофагов, которое позволяет идентифицировать и сегментировать клетку в анализе изображений, так что любые внешние SH-SY5Y исключаются из подсчета. Рекомендуемый краситель является клеточно-проницаемым, преобразованным в нерастворимый флуоресцентный продукт внутри цитоплазмы, поправимым и нетоксичным (см. Таблицу материалов). Этап окрашивания был оптимизирован для использования iPSC-макрофагов с анализом фагоцитоза с высоким содержанием изображения, и мы предлагаем его повторно оптимизировать, если используются другие типы клеток. Продолжительность окрашивания клеток может быть увеличена для улучшения осаждения нерастворимого флуоресцентного продукта в клетках. Если концентрация красителя оптимизирована, следует позаботиться о том, чтобы избежать токсичных уровней органического растворителя.
Третьим критическим фактором успеха анализа является анализ данных. Предоставляемые конвейеры анализа предназначены для руководства, а не для предписания, поскольку различия в интенсивности окрашивания или морфологии клеток могут снизить эффективность сегментации конвейеров, как написано. Поэтому потребуются некоторые оптимизации с тестированием конвейера на соответствующих положительных и отрицательных элементах управления, а параметры, которые должны быть оптимизированы, указаны в тексте протокола. Отрицательный контроль должен включать состояние, при котором iPSC-макрофаги предварительно обрабатываются мощным ингибитором фагоцитоза, таким как цитохалазин D, перед добавлением SH-SY5Ys. Другим возможным негативным контролем является добавление SH-SY5Ys к ранее необработанным скважинам iPSC-макрофагов в конце анализа, за 10 минут до фиксации, что позволяет некоторое осаждение груза, но слишком коротко для того, чтобы произошло значительное количество фагоцитоза. Событие фагоцитоза определяется как красно-флуоресцентный объект в границах iPSC-макрофага, определяемый программным алгоритмом с использованием темно-красного флуоресцентного канала. Если сегментация клеток плохая(рисунок 2),многие нефагоцитозные SH-SY5Ys в непосредственной близости от iPSC-макрофагов могут быть ошибочно включены в анализ, т.е. ложноположительные результаты. Важнейшим фактором достижения хорошей сегментации является строгое разграничение iPSC-макрофагов. Сегментация для обоих анализов автоматизирована, поэтому невозможно получить идеальную сегментацию для каждой ячейки; однако некоторые параметры могут быть скорректированы, чтобы сделать сегментацию более оптимальной, используя несколько тестовых изображений в качестве эталона. Контроль цитохалазина D важен для оценки оптимальной сегментации, поскольку большое количество фагоцитарных событий, обнаруженных в этом состоянии, указывает на то, что сегментация является неоптимальной. Оптимизация конвейера анализа данных в идеале должна повторяться до тех пор, пока количество фагоцитарных событий на клетку не будет на 80-90% ниже в состоянии цитохалазина D по сравнению с отсутствием ингибитора.
Наиболее вероятными проблемами с анализом фагоцитоза являются: (1) слабая рН-чувствительная флуоресценция в положительном контроле, (2) редкое или неравномерное распределение макрофагов в конце анализа или (3) большое количество ложноположительных результатов в анализе из нефагоцитозных SH-SY5Ys. При устранении неполадок слабой pH-чувствительной флуоресценции следует сначала проверить, что окрашивание SH-SY5Ys привело к получению ячейки с сильным пурпурным цветом. Если цвет слабый, убедитесь, что используется свежий запас красителя, убедитесь, что буфер маркировки не содержит аминов, добавьте дополнительную промывку в SH-SY5Ys перед окрашиванием, проверьте, было ли окрашено правильное количество SH-SY5Y, убедитесь, что нет осадков красителя, и оптимизируйте маркировку концентрации красителя. Если SH-SY5Y сильно окрашены, проверьте, правильна ли концентрация, добавленная к анализной пластине, и убедитесь, что iPSC-макрофаги здоровы и не слишком стары. Второй тип проблемы, неравномерное распределение макрофагов, может возникнуть в результате потери клеток во время пипетки, и следует предпринять шаги для уменьшения сил пипетки, испытываемых клетками, избегая узкобородых кончиков. Если проблема остается, сократите время инкубации загрузки iPSC-макрофагов клеточно-проницаемым красителем. Третья проблема, касающаяся ошибочного включения в анализ нефагоцитированных частиц, указывает на то, что требуется большая оптимизация конвейера анализа. Устранение неполадок должно быть сосредоточено в первую очередь на сегментации ячеек и на том, включает ли программное обеспечение соседние объекты. Конкретные параметры, которые могут быть скорректированы, предлагаются в примечаниях ниже соответствующих этапов (этапы 6.1.11-6.1.15 для покадрового анализа живых клеток и этапы 6.2.4-6.2.8 для анализа высокого содержания). Если сегментация клеток не может быть дополнительно улучшена, анализ высокого содержания имеет дополнительный шаг (шаг 6.2.8), который исключает неправильно сегментированные iPSC-макрофаги. Кроме того, модуль, который фильтрует принятые пятна pH-чувствительной флуоресценции в iPSC-макрофагах, может быть оптимизирован, увеличивая пороговую интенсивность принимаемых объектов, что должно помочь исключить нефагоцитозные SH-SY5Ys (шаг 6.1.17 для покадрового анализа живых клеток и шаг 6.2.11 для анализа высокого содержания).
Мы разработали два типа считывания микроскопии для анализа фагоцитоза, каждый из которых имеет преимущества и ограничения. Покадровая визуализация живых клеток имеет преимущества предоставления дополнительной информации о кинетике фагоцитоза и более широко доступна, чем платформы визуализации с высоким содержанием. Рекомендуемое программное обеспечение с открытым исходным кодом не соответствует источнику микроскопа и может использоваться с любым высококачественным флуоресцентным микроскопом, с возможностью замедленной съемки живых клеток или без нее. Основным ограничением визуализации живых клеток является ограниченная чувствительность и оптика, что затрудняет обнаружение и выполнение хорошей сегментации iPSC-макрофагов. Это ограничение может быть смягчено либо путем увеличения продолжительности окрашивания iPSC-макрофагов, либо путем переключения на более чувствительный микроскоп, если таковой имеется. Анализ фагоцитоза с высоким содержанием является рекомендуемым считыванием, если доступна система визуализации с высоким содержанием. Системы визуализации с высоким содержанием обеспечивают более высокую пропускную способность и более надежные данные, что позволяет использовать этот анализ для скрининга, в котором ожидается надежный Z’ ≥0,7 для выхода «количество пятен на ячейку»20. По сравнению с методом замедленной съемки живых клеток, считывание микроскопии с высоким содержанием имеет более высокую чувствительность, более высокую степень автоматизации и скорости, может быть обработано больше скважин и полей визуализации, и производятся конфокальные изображения с высоким разрешением. Сегментация клеток более эффективна при хороших изображениях, а сегментации дополнительно помогает программное обеспечение для анализа изображений с высоким содержанием, обеспечивающее больше методов сегментации клеток, подходящих для клеток с высокой неправильной формой. Программное обеспечение для анализа изображений с высоким содержанием также рассчитало больше параметров фагоцитоза по сравнению с программным обеспечением с открытым исходным кодом, таким как процент фагоцитарных клеток. Основным ограничением анализа фагоцитоза с высоким содержанием является стоимость и доступность системы визуализации и программного обеспечения для анализа.
В заключение, количественный анализ фагоцитоза, представленный в данной работе, является полезным инструментом для моделирования фагоцитоза микроглии мертвых нейронов in vitro. Микроглия моделируется iPSC-макрофагами, а мертвые нейроны моделируются параформальдегид-фиксированным SH-SY5Ys. Хотя это не самые аутентичные модели микроглии и мертвых / апоптотических нейронов, они просты в подготовке и масштабируемы. Сам анализ очень универсален, с двумя типами считывания изображений, и он может быть адаптирован для использования с различными моделями монокультуры микроглии / макрофагов или другим типом клеток, чтобы действовать в качестве фагоцитарного груза. Считывание изображений с высоким содержанием выгодно для получения количественных данных и может быть масштабировано до анализа модуляторов малых молекул фагоцитоза или скрининга генетических вариантов в iPSC-макрофагах. Однако, поскольку системы визуализации с высоким содержанием являются дорогостоящими и большими, альтернативное считывание изображений было включено в протокол с использованием покадрового микроскопа с живыми клетками, который при необходимости может быть заменен любым обычным флуоресцентным микроскопом хорошего качества.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Авторы благодарят доктора Вэла Миллара и доктора Сохаиба Низами за их помощь в микроскопии с высоким содержанием, а также доктора Даниэля Эбнера за доступ к микроскопам с высоким содержанием. Кроме того, авторы благодарят доктора Эмму Мид за советы по разработке анализа и миссис Кэти Браун за поддержку iPSC. Эта работа была поддержана Оксфордским институтом поиска лекарств (ARUK ODDI, ссылка на грант ARUK-2020DDI-OX) при дополнительной поддержке Центра стволовых клеток Джеймса Мартина в Оксфорде (S.A.C.) из Оксфордской школы Мартина LC0910-004; Премия Monument Trust Discovery Award от Паркинсона Великобритании (J-1403); MRC Dementias Platform UK Stem Cell Network Capital Equipment MC_EX_MR/N50192X/1, Partnership MR/N013255/1 и Momentum MC_PC_16034 Awards.
Materials
| 15 mL conical centrifuge tube | Falcon | 352096 | For centrifugation of cells |
| 2-20 µL, 20-200 µL, 100-1000 µL single-channel micropipettes | |||
| 2-mercaptoethanol 50 mM | Gibco | 31350010 | Component of Factory media |
| 4% paraformaldehyde in PBS | Alfa Aesar | J61899 | For fixation of cells |
| 6-well plate, tissue culture treated | |||
| AggreWell-800 24-well plate | STEMCELL Technologies | 34815 | Microwell low-adherence 24-well plate for formation of embryoid bodies |
| Annexin V-FITC Apoptosis Staining / Detection Kit | Abcam | ab14085 | Kit for annexin V-FITC staining , as an assay for quality control of fixed SH-SY5Ys. Kit contains annexin binding buffer, annexin V-FITC, and propidium iodide. |
| Automated cell counter | |||
| Benchtop centrifuge | |||
| Benchtop microcentrifuge | |||
| CellCarrier-96 Ultra Microplates, tissue culture treated, black, 96-well with lid | Perkin Elmer | 6055302 | 96-well tissue culture (TC)-treated microplate with black well walls and an optically-clear bottom, for phagocytosis assay |
| CellProfiler software | Open-source software for analysis of phagocytosis images obtained by live-cell time-lapse microscope. Download for free from website (http://cellprofiler.org/), this protocol used version 2.2.0. | ||
| CellTracker Deep Red dye | Thermo Fisher | C34565 | Deep red-fluorescent, cell-permeant, succinimidyl ester-reactive dye for staining cytoplasm of iPS-macrophages. Dissolve CellTracker Deep Red dye in DMSO to 2 mM (1.4 mg/mL). Use at 1 μM, by dilution of DMSO stock with Macrophage media. |
| Class 2 laminar air flow safety cabinet | |||
| CO2 gas bottle | Accessory for EVOS FL Auto | ||
| CO2 incubator, set to 37°C and 5 % CO2 | |||
| Columbus Image Data Storage and Analysis System | Perkin Elmer | Columbus | Data storage and analysis platform for Opera Phenix. Supports all major high content screening instruments. |
| Cytochalasin D | Cayman | 11330 | Negative control treatment for phagocytosis assay. Reconstitute in DMSO to 10 mM and store aliquots at -20°C, avoid further freeze-thaw cycles. Use at final concentration 10 µM. |
| DMEM/F12 | Gibco | 11320074 | Component of SH-SY5Y media |
| DMSO | Sigma | D8418 | Solvent for CellTracker and pHrodo dyes |
| EVOS FL Auto Imaging System | Thermo Fisher | AMF4300 | Live-cell time-lapse imaging microscope |
| EVOS Light Cube CY5 | Thermo Fisher | AMEP4656 | Accessory for EVOS FL Auto |
| EVOS Light Cube DAPI | Thermo Fisher | AMEP4650 | Accessory for EVOS FL Auto |
| EVOS Light Cube RFP | Thermo Fisher | AMEP4652 | Accessory for EVOS FL Auto |
| EVOS Onstage Incubator | Thermo Fisher | AMC1000 | Accessory for EVOS FL Auto |
| Fetal Bovine Serum | Sigma | F4135 | Component of SH-SY5Y media |
| Flow cytometer | |||
| Flow cytometry analysis software | |||
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Invitrogen | A1413302 | hESC-qualified basement membrane matrix for iPSC culture |
| GlutaMAX Supplement | Gibco | 35050-038 | Component of both Factory and Macrophage media |
| HBSS | Lonza | BE 10-547F | Hank’s balanced salt solution for washing steps |
| Human recombinant BMP4 | Gibco | PHC9534 | Component of Embryoid Body media |
| Human recombinant IL-3 | Gibco | PHC0033 | Component of both Factory and Macrophage media |
| Human recombinant SCF | Miltenyi Biotech | 130-096-695 | Component of Embryoid Body media |
| Human recombinant VEGF | Gibco | PHC9394 | Component of Embryoid Body media |
| Live Cell Imaging Solution | Thermo Fisher | A14291DJ | Phenol red-free HEPES-buffered media for labelling dead SH-SY5Ys |
| Low protein binding 2 mL tubes | Eppendorf | 30108.132 | For staining SH-SY5Ys |
| M-CSF | Thermo Fisher | PHC9501 | Component of both Factory and Macrophage media |
| mTeSR1 Medium | STEMCELL Technologies | 85850 | iPSC media |
| Multichannel 20-200 uL pipette | For liquid handling of 96-well plate | ||
| NucBlue Live ReadyProbes Reagent | Thermo Fisher | R37605 | Hoechst 33342 formulation in a dropper bottle for staining nuclei of iPS-macrophages, use 0.5 drops/mL in Macrophage media. |
| Opera Phenix High-Content Screening System | Perkin Elmer | HH14000000 | High-content imaging microscope, used with Harmony software version 4.9. |
| Penicillin-Streptomycin | Gibco | 15140-122 | Component of Factory, Macrophage, and SH-SY5Y media |
| pHrodo iFL Red STP-Ester | Thermo Fisher | P36011 | pH-sensitive red fluorescent dye for labelling dead SH-SY5Ys. Reconstitute pHrodo iFL Red STP Ester powder in DMSO to a 5 mg/mL concentration. For each 1 million SH-SY5Ys, add 2.5 μL (12.5 μg) of pHrodo iFL Red STP Ester stock to pre-warmed cells suspended in Live Cell Imaging Solution. |
| Serological pipette filler | |||
| T175 flask, tissue culture treated | Vessel for differentiations of iPSC-macrophage precursors, known as "Factories" | ||
| T75 flask | Vessel for SH-SY5Y culture | ||
| Transparent plate sealers | Greiner Bio-One | 676001 | For assay plate storage and transportation |
| TrypLE Express (1X), no phenol red | Gibco | 12604013 | Cell dissociation buffer containing recombinant trypsin-like enzymes and 1.1 mM EDTA, use neat. |
| Water bath, set to 37°C | |||
| X-VIVO 15 Medium with L-glutamine, gentamicin, and phenol red | Lonza | BE04-418F | Component of Factory and Macrophage media |
| X-VIVO 15 Medium with L-glutamine; without gentamicin or phenol red | Lonza | 04-744Q | Phenol red-free macrophage media, for use in phagocytosis without additives or growth factors |
References
- Hochreiter-Hufford, A., Ravichandran, K. S. Clearing the dead: apoptotic cell sensing, recognition, engulfment, and digestion. Cold Spring Harbour Perspectives in Biology. 5, 008748 (2013).
- Freeman, S. A., Grinstein, S. Phagocytosis: receptors, signal integration, and the cytoskeleton. Immunological Reviews. 2262, 193-215 (2014).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., El Khoury, J. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359-1369 (2018).
- Galloway, D. A., Phillips, A. E. M., Owen, D. R. J., Moore, C. S. Phagocytosis in the brain: Homeostasis and disease. Frontiers in Immunology. 10, 790 (2019).
- Nizami, S., Hall-Roberts, H., Warrier, S., Cowley, S. A., Di Daniel, E. Microglial inflammation and phagocytosis in Alzheimer’s disease: potential therapeutic targets. British Journal of Pharmacology. 176 (18), 3515-3532 (2019).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Neher, J. J., et al. Inhibition of microglial phagocytosis is sufficient to prevent inflammatory neuronal death. The Journal of Immunology. 186 (8), 4973-4983 (2011).
- Brown, G. C., Neher, J. J. Microglial phagocytosis of live neurons. Nature Reviews Neuroscience. 15 (4), 209-216 (2014).
- Scott-Hewitt, N., et al. Local externalization of phosphatidylserine mediates developmental synaptic pruning by microglia. The EMBO Journal. 39 (16), 105380 (2020).
- Li, T., et al. A splicing isoform of GPR56 mediates microglial synaptic refinement via phosphatidylserine binding. The EMBO Journal. 39 (16), 104136 (2020).
- Sapar, M. L., et al. Phosphatidylserine externalization results from and causes neurite degeneration in Drosophila. Cell Reports. 24 (9), 2273-2286 (2018).
- Skjesol, A., et al. The TLR4 adaptor TRAM controls the phagocytosis of Gram-negative bacteria by interacting with the Rab11-family interacting protein 2. PLOS Pathogens. 15 (3), 1007684 (2019).
- Wong, K., Li, X., Ma, Y. Paraformaldehyde induces elevation of intracellular calcium and phosphatidylserine externalization in platelets. Thrombosis Research. 117 (5), 537-542 (2006).
- van Wilgenburg, B., Browne, C., Vowles, J., Cowley, S. A. Efficient, long term production of monocyte-derived macrophages from human pluripotent stem cells under partly-defined and fully-defined conditions. PLoS One. 8 (8), (2013).
- Haenseler, W., et al. A highly efficient human pluripotent stem cell microglia model displays a neuronal-co-culture-specific expression profile and inflammatory response. Stem Cell Reports. 8 (6), 1727-1742 (2017).
- Buchrieser, J., James, W., Moore, M. D. Human induced pluripotent stem cell-derived macrophages share ontogeny with MYB-independent tissue-resident macrophages. Stem Cell Reports. 8 (2), 334-345 (2017).
- Hall-Roberts, H., et al. TREM2 Alzheimer’s variant R47H causes similar transcriptional dysregulation to knockout, yet only subtle functional phenotypes in human iPSC-derived macrophages. Alzheimer’s Research & Therapy. 12, 151 (2020).
- Friedman, B. A., et al. Diverse brain myeloid expression profiles reveal distinct microglial activation states and aspects of Alzheimer’s disease not evident in mouse models. Cell Reports. 22 (3), 832-847 (2018).
- Aziz, M., Yang, W. L., Wang, P. Measurement of phagocytic engulfment of apoptotic cells by macrophages using pHrodo succinimidyl ester. Current Protocols in Immunology. 100, 1-8 (2013).
- Atmaramani, R., Pancrazio, J. J., Black, B. J. Adaptation of robust Z’ factor for assay quality assessment in microelectrode array based screening using adult dorsal root ganglion neurons. Journal of Neuroscience Methods. 339, 108699 (2020).
- Fernandes, H. J. R., et al. ER Stress and Autophagic Perturbations Lead to Elevated Extracellular α-Synuclein in GBA-N370S Parkinson’s iPSC-Derived Dopamine Neurons. Stem Cell Reports. 6 (3), 342-356 (2016).
- Takahashi, K., Rochford, C. D. P., Neumann, H. Clearance of apoptotic neurons without inflammation by microglial triggering receptor expressed on myeloid cells-2. Journal of Experimental Medicine. 201 (4), 647-657 (2005).
- Kober, D. L., Brett, T. J. TREM2-ligand interactions in health and disease. Journal of Molecular Biology. 429 (11), 1607-1629 (2017).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Witting, A., Müller, P., Herrmann, A., Kettenmann, H., Nolte, C. Phagocytic clearance of apoptotic neurons by microglia/brain macrophages in vitro: Involvement of lectin-, integrin-, and phosphatidylserine-mediated recognition. Journal of Neurochemistry. 75 (3), 1060-1070 (2000).
- Hsieh, C. L., et al. A role for TREM2 ligands in the phagocytosis of apoptotic neuronal cells by microglia. Journal of Neurochemistry. 109 (4), 1144-1156 (2009).
- Beccari, S., Diaz-Aparicio, I., Sierra, A. Quantifying microglial phagocytosis of apoptotic cells in the brain in health and disease. Current Protocols in Immunology. 122 (1), 49 (2018).
- Diaz-Aparicio, I., et al. Microglia actively remodel adult hippocampal neurogenesis through the phagocytosis secretome. Journal of Neuroscience. 40 (7), 1453-1482 (2020).
- Shirotani, K., et al. Aminophospholipids are signal-transducing TREM2 ligands on apoptotic cells. Scientific Reports. 9 (1), 1-9 (2019).
- Garcia-Reitboeck, P., et al. Human induced pluripotent stem cell-derived microglia-like cells harboring TREM2 missense mutations show specific deficits in phagocytosis. Cell Reports. 24 (9), 2300-2311 (2018).

