تحليل تتبع الجسيمات النانوية لتحديد كمي وحجم الحويصلات خارج الخلية
Summary
نحن نبين كيفية استخدام أداة جديدة لتحليل تتبع الجسيمات النانوية لتقدير توزيع الحجم والتركيز الكلي للجسيمات الحويصلات خارج الخلية المعزولة عن الأنسجة الدهنية perigonadal الماوس والبلازما البشرية.
Abstract
أصبحت الأدوار الفسيولوجية والفيزيولوجية المرضية لل الحويصلات خارج الخلية (EVs) معترف بها بشكل متزايد ، مما يجعل مجال EV مجالا سريعا من مجالات البحث. هناك العديد من الطرق المختلفة لعزل EV ، ولكل منها مزايا وعيوب متميزة تؤثر على العائد النهائي ونقاء المركبات الكهربائية. وبالتالي، فإن توصيف الإعدادية EV معزولة عن مصدر معين من قبل طريقة مختارة مهم لتفسير نتائج المصب ومقارنة النتائج عبر المختبرات. توجد طرق مختلفة لتحديد حجم وكمية المركبات الكهربائية، والتي يمكن تغييرها من قبل حالات المرض أو استجابة للظروف الخارجية. تحليل تتبع الجسيمات النانوية (NTA) هي واحدة من التقنيات البارزة المستخدمة لتحليل الإنتاجية العالية للمركبات الكهربائية الفردية. هنا، نقدم بروتوكول مفصل للقياس الكمي وتحديد حجم المركبات الكهربائية المعزولة عن الأنسجة الدهنية perigonadal الماوس والبلازما البشرية باستخدام تكنولوجيا اختراق لNTA تمثل التقدم الكبير في هذا المجال. وتبين النتائج أن هذه الطريقة يمكن أن توفر تركيز الجسيمات الكلي القابل للاستنساخ والصالح وبيانات توزيع الحجم للمركبات الكهربائية المعزولة عن مصادر مختلفة باستخدام أساليب مختلفة، كما أكد ذلك المجهر الإلكتروني الإرسال. تكييف هذا الصك لNTA سوف تلبي الحاجة إلى توحيد في أساليب NTA لزيادة الدقة والتكرار في البحوث EV.
Introduction
الحويصلات خارج الخلية (EVs) صغيرة (0.03-2 ميكرومتر) الحويصلات المرتبطة بالغشاء التي تفرزها جميع أنواع الخلايا تقريبا1. وغالبا ما يشار إليها باسم “exosomes” ، “microvesicles” ، أو “الهيئات المبرمج” اعتمادا على آلية الإفراج عنها وحجم2. في حين كان يعتقد في البداية أن المركبات الكهربائية كانت مجرد وسيلة للقضاء على النفايات من الخلية للحفاظ على التوازن3، ونحن نعلم الآن أنها يمكن أن تشارك أيضا في الاتصالات بين الخلايا عن طريق نقل المواد الجزيئية — بما في ذلك الحمض النووي ، الجيش الملكي النيبالي (ميرنا ، ميكرورنا) ، والدهون ، والبروتينات4،5 — وأنها هي المنظمين المهمين لعلم وظائف الأعضاء الطبيعية ، فضلا عن العمليات المرضية1، 5،6،7،8.
هناك العديد من الطرق المختلفة لعزل وقياس المركبات الكهربائية، والتي تم وصفها في مكان آخر9،10،11،12. بروتوكول العزل المستخدمة وكذلك مصدر المركبات الكهربائية يمكن أن تؤثر بشكل كبير EV الغلة والنقاء. وحتى الطرد المركزي التفاضلي، الذي طالما اعتبر نهج “المعيار الذهبي” للعزلة الخارجية، يمكن أن يخضع لتباين كبير يؤثر في وقت لاحق على السكان EV التي تم الحصول عليها وتحليلات المصب13. وهكذا، فإن مختلف المنهجيات المختلفة لعزل EV وتحديد كمي تجعل من الصعب مقارنة واستنساخ وتفسير نتائج التجارب المبلغ عنها في الأدب14. وعلاوة على ذلك، يمكن تنظيم إطلاق EV من خلال الظروف الخلوية أو عوامل خارجية مختلفة. وقد اقترح أن المركبات الكهربائية تلعب دورا في الحفاظ على التوازن الخلوي من خلال حماية الخلايا ضد الإجهاد داخل الخلايا15, كما أظهرت العديد من الدراسات أن الإجهاد الخلوي يحفز إفراز EV. على سبيل المثال، تم الإبلاغ عن زيادة إطلاق EV بعد التعرض الخلوي لنقص الأكسيجة، والإجهاد الشبكي بطانة الرحم، والإجهاد التأكسدي، والإجهاد الميكانيكي، ومستخلص دخان السجائر، وتلوث الهواء الجسيمات16،17،18،19،20،21،22. كما تبين أن إطلاق EV قد تم تعديله في الجسم الحي؛ الفئران التي تعرضت لنظام غذائي عالي الدهون أو الصيام لمدة ستة عشر ساعة صدر أكثر المركبات EVsadipocyte 23. للتحقيق فيما إذا كان علاج أو حالة معينة يغير إطلاق EV، يجب تحديد عدد المركبات الكهربائية بدقة. تقييم توزيع حجم EV قد تشير أيضا إلى الأصل شبه الخلوي السائد من المركبات الكهربائية (على سبيل المثال، الانصهار من الأجسام الاندوسومات المتأخرة / متعددة المركبات مع غشاء البلازما مقابل الناشئة من غشاء البلازما)24. وبالتالي، هناك حاجة إلى أساليب قوية لقياس بدقة التركيز الكلي وتوزيع حجم الإعدادية EV التي تجري دراستها.
طريقة سريعة وحساسة للغاية لتصور وتوصيف المركبات الكهربائية في الحل هو تحليل تتبع الجسيمات النانوية (NTA). وقد وصف شرح مفصل لمبادئ هذه الطريقة والمقارنة مع الطرق البديلة لتقييم حجم EV والتركيز سابقا25،26،27،28. باختصار، أثناء قياس NTA، يتم تصور المركبات الكهربائية بواسطة الضوء المتناثر عندما يتم تشعيعها بشعاع ليزر. يركز الضوء المتناثر بواسطة المجهر على الكاميرا التي تسجل حركة الجسيمات. يتتبع برنامج NTA الحركة الحرارية العشوائية لكل جسيم ، والمعروفة باسم الحركة البراونية ، لتحديد معامل الانتشار الذي يستخدم لحساب حجم كل جسيم باستخدام معادلة ستوكس آينشتاين. تم تطبيق NTA لأول مرة على قياس المركبات الكهربائية في عينة بيولوجية في عام 201125. حتى وقت قريب، كان هناك سوى شركتين التيار الرئيسي التي تقدم أدوات NTA التجارية29 حتى إدخال ViewSizer 3000 (يشار إليها فيما بعد باسم أداة تتبع الجسيمات) الذي يستخدم مزيجا من الأجهزة الجديدة وحلول البرمجيات للتغلب على قيود كبيرة من تقنيات NTA الأخرى.
تميز أداة تتبع الجسيمات الجسيمات النانوية في العينات السائلة من خلال تحليل حركتها البراونية وتميز جزيئات أكبر بحجم ميكرون من خلال تحليل استقرار الجاذبية. يسمح النظام البصري الفريد لهذا الجهاز، والذي يتضمن إضاءة متعددة الأطياف مع ثلاثة مصادر ضوء ليزر (عند 450 نانومتر و520 نانومتر و635 نانومتر)، للباحثين بتحليل مجموعة واسعة من أحجام الجسيمات (على سبيل المثال، إكسوسومات، ميكروفيسيكليس) في وقت واحد. يظهر تخطيطي لإعداد الأداة في الشكل 1.
هنا، ونحن نبين كيفية تنفيذ توزيع حجم الجسيمات وقياسات تركيز الماوس المعزولة والمركبات الكهربائية البشرية باستخدام أداة NTA جديدة.
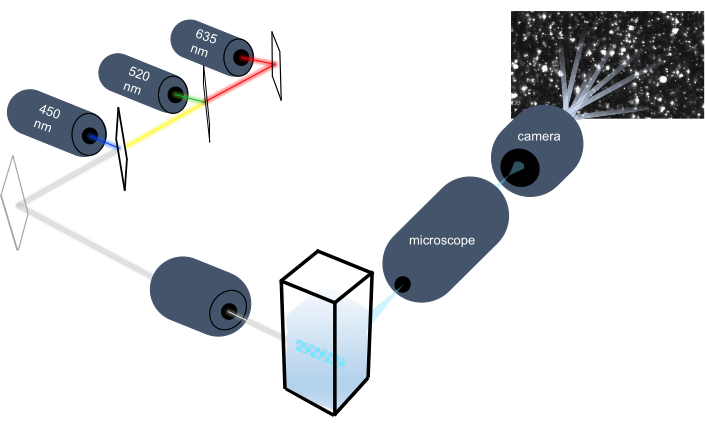
الشكل 1: نظام بصري أداة تتبع الجسيمات. تضيء أداة NTA الجسيمات باستخدام ثلاثة أشعة ليزر ذات أطوال موجية تالية: 450 نانومتر، 520 نانومتر، 635 نانومتر. يتم الكشف عن تسجيل الفيديو للضوء المتناثر من الجسيمات الفردية وتتبعها بواسطة كاميرا فيديو رقمية موجهة 90 درجة من cuvette. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
هنا، ونحن نثبت بروتوكول لNTA من المركبات الكهربائية لقياس توزيع حجم مجموعة واسعة من أحجام الجسيمات في وقت واحد وقياس تركيز EV الكلي في عينة متعددة الأضلاع. في هذه الدراسة، استخدمت الأنسجة الدهنية بيريغودال الماوس والبلازما البشرية كمصدر للمركبات الكهربائية. ومع ذلك، يمكن أيضا استخدام المر…
Disclosures
The authors have nothing to disclose.
Acknowledgements
وقد دعم هذا العمل المعاهد الوطنية للصحة (ES030973-01A1، R01ES025225، R01DK066525، P30DK026687، P30DK063608). ونحن نعترف جيفري Bodycomb، دكتوراه من هوريبا الصكوك المدمجة لمساعدته في معايرة الصك.
Materials
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | – | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | – | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | – | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | – | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | – | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | – | Nanoparticle tracking instrument |
References
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D’Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis – An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution – a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).

