Generering af transgenik og knockouts i Strongyloides Species ved mikroinjektion
Summary
Det funktionelle genomiske værktøjssæt til de parasitære nematoder Strongyloides stercoralis og Strongyloides ratti omfatter transgenese, CRISPR/Cas9-medieret mutagenese og RNAi. Denne protokol vil demonstrere, hvordan man bruger intragonadal mikroinjektion til at introducere transgener og CRISPR-komponenter i S. stercoralis og S. ratti.
Abstract
Slægten Strongyloides består af flere arter af hudgennemtrængende nematoder med forskellige værtsområder, herunder Strongyloides stercoralis og Strongyloides ratti. S. stercoralis er en human-parasitisk, hudpenetrerende nematode, der inficerer ca. 610 millioner mennesker, mens rotteparasitten S. ratti er nært beslægtet med S. stercoralis og ofte bruges som laboratoriemodel for S. stercoralis. Både S. stercoralis og S. ratti er let modtagelige for dannelsen af transgenik og knockouts gennem den eksogene nukleinsyreleveringsteknik af intragonadal mikroinjektion og er som sådan opstået som modelsystemer for andre parasitære helminths, der endnu ikke er modtagelige for denne teknik.
Parasitiske Strongyloides voksne beboer tyndtarmen af deres vært og frigiver afkom i miljøet via afføringen. En gang i miljøet udvikler larverne sig til fritlevende voksne, der lever i afføring og producerer afkom, der skal finde og invadere en ny vært. Denne miljøgeneration er unik for Strongyloides-arten og ligner nok i morfologi til modellen fritlevende nematode Caenorhabditis elegans , at teknikker udviklet til C. elegans kan tilpasses til brug med disse parasitære nematoder, herunder intragonadal mikroinjektion. Ved hjælp af intragonadal mikroinjektion kan en lang række transgener indføres i Strongyloides. CRISPR/Cas9-komponenter kan også mikroinjektioneres for at skabe mutante Strongyloides larver. Her beskrives teknikken til intragonadal mikroinjektion i Strongyloides, herunder fremstilling af fritlevende voksne, injektionsproceduren og udvælgelsen af transgent afkom. Billeder af transgene Strongyloides larver skabt ved hjælp af CRISPR/Cas9 mutagenese er inkluderet. Formålet med denne artikel er at gøre det muligt for andre forskere at bruge mikroinjektion til at skabe transgene og mutante Strongyloides.
Introduction
Strongyloides stercoralis har længe været overset som et vigtigt humant patogen sammenlignet med de mere almindeligt anerkendte hageorm og rundorm Ascaris lumbricoides1. Tidligere undersøgelser af ormebyrden undervurderede ofte alvorligt forekomsten af S. stercoralis på grund af den lave følsomhed af almindelige diagnostiske metoder til S. stercoralis2. I de senere år har epidemiologiske undersøgelser baseret på forbedrede diagnostiske værktøjer anslået, at den sande forekomst af S. stercoralis-infektioner er meget højere end tidligere rapporteret, ca. 610 millioner mennesker over hele verden2.
Både S. stercoralis og andre Strongyloides-arter, herunder den nært beslægtede rotteparasit og fælles laboratoriemodel S. ratti, har en usædvanlig livscyklus, der er fordelagtig for eksperimentelle genomiske undersøgelser, fordi den består af både parasitære og fritlevende (miljømæssige) generationer3 (figur 1). Specifikt kan både S. stercoralis og S. ratti cykle gennem en enkelt fritlevende generation. Den fritlevende generation består af postparasitære larver, der udvikler sig til fritlevende voksne mænd og kvinder; alle afkom af de fritlevende voksne udvikler sig til infektiøse larver, som skal inficere en vært for at fortsætte livscyklussen. Desuden kan denne miljømæssige eller fritlevende generation eksperimentelt manipuleres i laboratoriet. Fordi fritlevende Strongyloides voksne og C. elegans voksne deler lignende morfologi, kan teknikker som intragonadal mikroinjektion, der oprindeligt blev udviklet til C. elegans, tilpasses til brug med fritlevende voksne Strongyloides 4,5. Mens DNA generelt introduceres i fritlevende voksne kvinder, kan både mænd og kvinder af Strongyloides mikroinjekt6. Således er funktionelle genomiske værktøjer tilgængelige for at forhøre mange aspekter af Strongyloidernes biologi. Andre parasitære nematoder mangler en fritlevende generation og er derfor ikke så let modtagelige for funktionelle genomiske teknikker3.
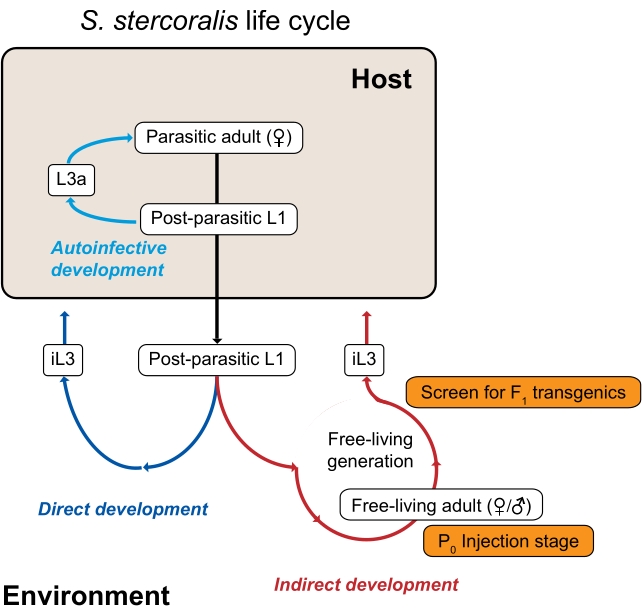
Figur 1: Strongyloides stercoralis livscyklus. S. stercoralis parasitære kvinder beboer tyndtarmen hos deres pattedyrværter (mennesker, ikke-menneskelige primater, hunde). De parasitære hunner reproducerer ved parthenogenese og lægger æg i tyndtarmen. Æggene klækkes, mens de stadig er inde i værten, til postparasitære larver, som derefter overføres til miljøet med afføring. Hvis de postparasitære larver er mandlige, udvikler de sig til fritlevende voksne mænd. Hvis de postparasitære larver er kvindelige, kan de enten udvikle sig til fritlevende voksne hunner (indirekte udvikling) eller tredje fase infektiøse larver (iL3s; direkte udvikling). De fritlevende mænd og kvinder reproducerer seksuelt for at skabe afkom, der er begrænset til at blive iL3’er. Under visse betingelser kan S. stercoralis også gennemgå autoinfektion, hvor nogle af de postparasitære larver forbliver inde i værtstarmen i stedet for at passere ind i miljøet i afføring. Disse larver kan udvikle sig til autoinfektive larver (L3a) inde i værten, trænge gennem tarmvæggen, migrere gennem kroppen og til sidst vende tilbage til tarmen for at blive reproduktive voksne. Livscyklussen for S. ratti er ens, bortset fra at S. ratti inficerer rotter og ikke har en autoinfektiv cyklus. Miljøgenerationen er nøglen til at bruge Strongyloides-arter til genetiske undersøgelser. De fritlevende voksne kvinder (P0) kan mikroinjekteres; deres afkom, som alle bliver iL3’er, er de potentielle F1-transgene. Dette tal er blevet ændret fra Castelletto et al. 3. Klik her for at se en større version af denne figur.
S. stercoralis deler mange aspekter af sin biologi med andre gastrointestinale human-parasitiske nematoder, herunder værtsinvasion og værtsimmunmodulation. For eksempel inficerer human-parasitiske hookworms i slægterne Necator og Ancylostoma også ved hudindtrængning, navigerer på samme måde gennem kroppen og i sidste ende befinder sig som parasitære voksne i tyndtarmen7. Således bruger mange gastrointestinale nematoder sandsynligvis almindelig sensorisk adfærd og immununddragelsesteknikker. Som følge heraf vil den viden, der er hentet fra Strongyloides , supplere fund i andre mindre genetisk medgørlige nematoder og føre til en mere fuldstændig forståelse af disse komplekse og vigtige parasitter.
Denne mikroinjektionsprotokol skitserer metoden til at introducere DNA i Strongyloides fritlevende voksne kvinder for at lave transgene og mutante afkom. Kravene til vedligeholdelse af stammen, herunder udviklingstimingen af voksne orme til mikroinjektioner og indsamling af transgene afkom, er beskrevet. Protokoller og en demonstration af den komplette mikroinjektionsteknik sammen med protokoller til dyrkning og screening af transgene afkom er inkluderet sammen med en liste over alt nødvendigt udstyr og forbrugsstoffer.
Protocol
Representative Results
Discussion
Denne mikroinjektionsprotokol beskriver metoderne til introduktion af konstruktioner til transgenese og CRISPR/Cas9-medieret mutagenese i S. stercoralis og S. ratti. For både S. stercoralis og S. ratti er overlevelse efter injektion og transgenese eller mutagenese underlagt flere variabler, der kan finjusteres.
Den første kritiske overvejelse for vellykket transgenese er, hvordan plasmidtransgener konstrueres. Tidligere undersøgelser har vist, at ekspres…
Disclosures
The authors have nothing to disclose.
Acknowledgements
pPV540 og pPV402 var venlige gaver fra Dr. James Lok ved University of Pennsylvania. Vi takker Astra Bryant for nyttige kommentarer til manuskriptet. Dette arbejde blev finansieret af en Burroughs-Wellcome Fund Investigators i Patogenese of Disease Award, en Howard Hughes Medical Institute Faculty Scholar Award og National Institutes of Health R01 DC017959 (E.A.H.).
Materials
| (−)-Nicotine, ≥99% (GC), liquid | Sigma-Aldrich | N3876-5ML | nicotine for paralyzing worms |
| 3" iron C-clamp, 3" x 2" (capacity x depth) | VWR | 470121-790 | C-clamp to secure setup to bench top |
| Agarose LE | Phenix | RBA-500 | agarose for slides |
| Bone char, 4 lb pail, 10 x 28 mesh | Ebonex | n/a | charcoal for fecal-charcoal cultures |
| Bone char, granules, 10 x 28 mesh | Reade | bonechar10x28 | charcoal for fecal-cultures (alternative to the above) |
| Coarse micromanipulator | Narishige | MMN-1 | coarse micromanipulator |
| Corning Costar Spin-X centrifuge tube filters | Fisher | 07-200-385 | microfilter column |
| Cover glass, 48 x 60 mm, No. 1 thickness | Brain Research Lab | 4860-1 | coverslips (48 x 60 mm) |
| Deep Petri dishes, heavy version with 6 vents, 100 mm diameter | VWR | 82050-918 | 10 cm Petri dishes (for fecal-charcoal cultures) |
| Eisco retort base w/ rod | Fisher | 12-000-101 | stand for Baermann apparatus |
| Eppendorf FemtoJet microinjector microloader tips | VWR | 89009-310 | for filling microinjection needles |
| Fisherbrand absorbent underpads | Fisher | 14-206-62 | bench paper (for prepping) |
| Fisherbrand Cast-Iron Rings | Fisher | 14-050CQ | Baermann o-ring |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for mixing) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (for catch bucket/water bucket) |
| Fisherbrand tri-cornered polypropylene beakers | Fisher | 14-955-111F | Plastic beaker (x2) (to make holder) |
| Gorilla epoxie in syringe | McMaster-Carr | 7541A51 | glue (to attach tubing) |
| Halocarbon oil 700 | Sigma-Aldrich | H8898-50ML | halocarbon oil |
| High-temperature silicone rubber tubing for food and beverage, 1/2" ID, 5/8" OD | McMaster-Carr | 3038K24 | tubing (for funnel) |
| KIMAX funnels, long stem, 60° Angle, Kimble Chase | VWR | 89001-414 | Baermann funnel |
| Kimberly-Clark Professional Kimtech Science benchtop protectors | Fisher | 15-235-101 | bench paper (for prepping) |
| Leica stereomicroscope with fluorescence | Leica | M165 FC | GFP stereomicroscope for identifying and sorting transgenic worms |
| microINJECTOR brass straight arm needle-holder | Tritech | MINJ-4 | microinjection needle holder |
| microINJECTOR system | Tritech | MINJ-1 | microinjection system |
| Mongolian Gerbils | Charles River Laboratories | 213-Mongolian Gerbil | gerbils for maintenance of S. stercoralis, male 4-6 weeks |
| Nasco Whirl-Pak easy-to-close bags, 18 oz | VWR | 11216-776 | Whirl-Pak sample bags |
| Nylon tulle (mesh) | Jo-Ann Fabrics | zprd_14061949a | nylon mesh for Baermann holder |
| Platinum wire, 36 Gauge, per inch | Thomas Scientific | 1233S72 | platinum/iridium wire for worm picks |
| Puritan tongue depressors, 152 mm (L) x 17.5 mm (W) | VWR | 62505-007 | wood sticks (for mixing samples) |
| QIAprep Spin Miniprep Kit (250) | QIAGEN | 27106 | QIAGEN miniprep kit |
| Rats-Long Evans | Envigo | 140 HsdBlu:LE Long Evans | rats for maintenance of S. ratti, female 4-6 weeks |
| Rats-Sprague Dawley | Envigo | 002 Hsd:Sprague Dawley SD | rats for maintenance of S. ratti, female 4-6 weeks |
| Really Useful Boxes translucent storage boxes with lids, 1.6 L capacity, 7-5/8" x 5-5/16" x 4-5/16" | Office Depot | 452369 | plastic boxes for humidified chamber |
| Shepherd techboard, 8 x 16.5 inches | Newco | 999589 | techboard |
| Stainless steel raised wire floor | Ancare | R20SSRWF | wire cage bottoms |
| StalkMarket compostable cutlery spoons, 6", white, pack of 1,000 | Office Depot | 9587303 | spoons |
| Stender dish, stacking type, 37 x 25 mm | Carolina (Science) | 741012 | watch glasses (small, round) |
| Stereomicroscope | Motic | K-400 LED | dissecting prep scope |
| Storage tote, color clear/white, outside height 4-7/8 in, outside length 13-5/8 in, Sterilite | Grainger | 53GN16 | plastic boxes for humidified chamber |
| Sutter P-30 micropipette puller | Sutter | P-30/P | needle puller with platinum/iridium filament |
| Syracuse watch glasses | Fisher | S34826 | watch glasses (large, round) |
| Thermo Scientific Castaloy fixed-angle clamps | Fisher | 05-769-2Q | funnel clamps (2x) |
| Three-axis hanging joystick oil hydrolic micromanipulator | Narishige | MM0-4 | fine micromanipulator |
| United Mohr pinchcock clamps | Fisher | S99422 | Pinch clamps (2x) |
| Vented, sharp-edge Petri dishes (60 mm diameter) | Tritech Research | T3308P | 6 cm Petri dishes (for small-scale fecal-charcoal cultures) |
| VWR light-duty tissue wipers | VWR | 82003-820 | lining for Baermann holder |
| watch glass, square, 1-5/8 in | Carolina (Science) | 742300 | watch glasses (small, square) |
| Whatman qualitative grade plain circles, grade 1, 5.5 cm diameter | Fisher | 09-805B | filter paper (for 6 cm Petri dishes) |
| Whatman qualitative grade plain circles, grade 1, 9 cm diameter | Fisher | 09-805D | filter paper (for 10 cm Petri dishes) |
| World Precision Instrument borosilicate glass capillary, 1.2 mm x 4 in | Fisher | 50-821-813 | glass capillaries for microinjection needles |
| X-Acto Knives, No. 1 Knife With No. 11 Blade | Office Depot | 238816 | X-Acto knives without blades to hold worm picks |
| Zeiss AxioObserver A1 | Zeiss | n/a | inverted microscope |
References
- Krolewiecki, A. J., et al. A public health response against Strongyloides stercoralis: time to look at soil-transmitted helminthiasis in full. PLoS Neglected Tropical Diseases. 7 (5), 2165 (2013).
- Buonfrate, D., et al. The global prevalence of Strongyloides stercoralis infection. Pathogens. 9 (6), 468 (2020).
- Castelletto, M. L., Gang, S. S., Hallem, E. A. Recent advances in functional genomics for parasitic nematodes of mammals. Journal of Experimental Biology. 223, 206482 (2020).
- Evans, T. C., et al. Transformation and microinjection. WormBook. , (2006).
- Lok, J. B., Unnasch, T. R., et al. Transgenesis in animal parasitic nematodes: Strongyloides spp. and Brugia spp. WormBook. , (2013).
- Shao, H. G., Li, X. S., Lok, J. B. Heritable genetic transformation of Strongyloides stercoralis by microinjection of plasmid DNA constructs into the male germline. International Journal for Parasitology. 47 (9), 511-515 (2017).
- Schafer, T. W., Skopic, A. Parasites of the small intestine. Current Gastroenterology Reports. 8 (4), 312-320 (2006).
- Stiernagle, T. Maintenance of C. elegans. The C. elegans Research Community, WormBook. , (2006).
- Gang, S. S., et al. Targeted mutagenesis in a human-parasitic nematode. PLoS Pathogens. 13 (10), 1006675 (2017).
- Lok, J. B. Strongyloides stercoralis: a model for translational research on parasitic nematode biology. The C. elegans Research Community, WormBook. , (2007).
- Hawdon, J. M., Schad, G. A. Long-term storage of hookworm infective larvae in buffered saline solution maintains larval responsiveness to host signals. Proceedings of the Helminthological Society of Washington (USA). 58 (1), 140-142 (1991).
- Bargmann, C. I., Hartwieg, E., Horvitz, H. R. Odorant-selective genes and neurons mediate olfaction in C. elegans. Cell. 74 (3), 515-527 (1993).
- Junio, A. B., et al. Strongyloides stercoralis: cell- and tissue-specific transgene expression and co-transformation with vector constructs incorporating a common multifunctional 3′ UTR. Experimental Parasitology. 118 (2), 253-265 (2008).
- Gang, S. S., et al. Chemosensory mechanisms of host seeking and infectivity in skin-penetrating nematodes. Proceedings of the National Academy of Sciences of the United States of America. 117 (30), 17913-17923 (2020).
- Bryant, A. S., et al. A critical role for thermosensation in host seeking by skin-penetrating nematodes. Current Biology. 28 (14), 2338-2347 (2018).
- Lok, J. B. Nucleic acid transfection and transgenesis in parasitic nematodes. Parasitology. 139 (5), 574-588 (2012).
- Shao, H., et al. Transposon-mediated chromosomal integration of transgenes in the parasitic nematode Strongyloides ratti and establishment of stable transgenic lines. PLoS Pathogens. 8 (8), 1002871 (2012).
- Lok, J. piggyBac: a vehicle for integrative DNA transformation of parasitic nematodes. Mobile Genetic Elements. 3 (2), 24417 (2013).
- Li, X., et al. Successful transgenesis of the parasitic nematode Strongyloides stercoralis requires endogenous non-coding control elements. International Journal for Parasitology. 36 (6), 671-679 (2006).
- Bryant, A. S., Hallem, E. A. The Wild Worm Codon Adapter: a web tool for automated codon adaptation of transgenes for expression in non-Caenorhabditis nematodes. G3. 3 (7), (2021).
- Crane, M., et al. In vivo measurements reveal a single 5′-intron is sufficient to increase protein expression level in Caenorhabditis elegans. Scientific Reports. 9 (1), 9192 (2019).
- Han, Z., et al. Improving transgenesis efficiency and CRISPR-associated tools through codon optimization and native intron addition in Pristionchus nematodes. 유전학. 216 (4), 947-956 (2020).
- Adams, S., Pathak, P., Shao, H., Lok, J. B., Pires-daSilva, A. Liposome-based transfection enhances RNAi and CRISPR-mediated mutagenesis in non-model nematode systems. Scientific Reports. 9 (1), 483 (2019).
- Dulovic, A., Puller, V., Streit, A. Optimizing culture conditions for free-living stages of the nematode parasite Strongyloides ratti. Experimental Parasitology. 168, 25-30 (2016).
- Harvey, S. C., Gemmill, A. W., Read, A. F., Viney, M. E. The control of morph development in the parasitic nematode Strongyloides ratti. Proceedings of the Royal Society B: Biological Sciences. 267 (1457), 2057-2063 (2000).
- Kim, A., Pyykko, I. Size matters: versatile use of PiggyBac transposons as a genetic manipulation tool. Molecular and Cellular Biochemistry. 354 (1-2), 301-309 (2011).
- Lok, J. B., Shao, H., Massey, H. C., Li, X. Transgenesis in Strongyloides and related parasitic nematodes: historical perspectives, current functional genomic applications and progress towards gene disruption and editing. Parasitology. 144 (3), 327-342 (2017).
- Farboud, B., Meyer, B. J. Dramatic enhancement of genome editing by CRISPR/Cas9 through improved guide RNA design. 유전학. 199 (4), 959-971 (2015).
- Cheong, M. C., et al. Identification of a nuclear receptor/coactivator developmental signaling pathway in the nematode parasite Strongyloides stercoralis. Proceedings of the National Academy of Sciences of the United States of America. 118 (8), 2021864118 (2021).
- Nolan, T. J., Megyeri, Z., Bhopale, V. M., Schad, G. A. Strongyloides stercoralis: the first rodent model for uncomplicated and hyperinfective strongyloidiasis, the Mongolian gerbil (Meriones unguiculatus). Journal of Infectious Diseases. 168 (6), 1479-1484 (1993).
- Li, X., et al. Transgenesis in the parasitic nematode Strongyloides ratti. Molecular and Biochemical Parasitology. 179 (2), 114-119 (2011).
- Viney, M. E. Exploiting the life cycle of Strongyloides ratti. Parasitology Today. 15 (6), 231-235 (1999).
- Stoltzfus, J. D., Massey, H. C., Nolan, T. J., Griffith, S. D., Lok, J. B. Strongyloides stercoralis age-1: a potential regulator of infective larval development in a parasitic nematode. PLoS ONE. 7 (6), 38587 (2012).
- Castelletto, M. L., Massey, H. C., Lok, J. B. Morphogenesis of Strongyloides stercoralis infective larvae requires the DAF-16 ortholog FKTF-1. PLoS Pathogens. 5 (4), 1000370 (2009).
- Douglas, B., et al. Transgenic expression of a T cell epitope in Strongyloides ratti reveals that helminth-specific CD4+ T cells constitute both Th2 and Treg populations. PLoS Pathogens. 17 (7), 1009709 (2021).

