산화 질소 및 그 유도체의 검출을위한 화학 발광 기반 분석 및 자동 산화 및 니트로화 화합물
Summary
여기에서는 고감도의 화학 발광 기반 분석을 사용하여 산화 질소 및 이의 생물학적 관련 유도체를 검출하기위한 프로토콜을 제시합니다.
Abstract
생체 내에서 산화질소(NO) 활성은 그의 직접적인 효과, NO autoxidation으로부터 생성된 그의 유도체의 작용, 및 니트로화 화합물의 효과의 조합된 결과이다. NO 대사산물을 측정하는 것은 혈관 수준과 다른 조직, 특히 외인성 NO가 투여되는 실험 환경에서 NO 활성을 연구하는 데 필수적입니다. 오존 기반 화학발광 분석은 유체(플라즈마, 조직 균질물, 세포 배양물 포함) 및 가스 혼합물(예: 내뿜는 호흡) 모두에서 NO 및 NO 대사산물의 정밀한 측정을 가능하게 합니다. NO는 오존과 반응하여 흥분 상태에서 이산화질소를 생성합니다. 결과적으로 발광은 광검출 및 샘플의 NO 함량을 반영하는 전기 신호의 생성을 허용합니다. 동일한 샘플로부터의 분취량은 특정 NO 대사산물, 예컨대 질산염, 아질산염, S-니트로소티올, 및 철-니트로실 착물을 측정하는데 사용될 수 있다. 또한, 무세포 헤모글로빈에 의해 소비된 NO는 또한 화학발광 분석으로 정량화된다. 이러한 모든 기술에 대한 그림이 제공됩니다.
Introduction
살바도르 몬카다와 노벨상 수상자인 로버트 푸르치고트, 루이 이그나로, 페리드 무라드가 산화질소(NO)를 이전에 알려진 내피 유래 이완인자(EDRF)로 확인했기 때문에, NO의 중심 역할은 혈관 생물학, 신경과학, 대사 및 숙주 반응전반에 걸친 몇 가지 주요 메커니즘에서 확립되었다 1,2,3,4,5,6,7 . NO 가스의 외인성 투여는 신생아8에서 폐 고혈압으로 인한 호흡 부전에 대한 확립된 치료법이 되었다. 산화 질소 가스는 또한 호흡기 세포융합 바이러스 (RSV) 감염, 말라리아 및 기타 감염성 질환, 허혈 재관류 손상의 치료 및 심장 수술을받는 환자의 급성 신장 손상 예방 9,10,11,12에 대해 조사되었습니다. NO, 그 대사 산물 및 표적 단백질 및 화합물의 수준을 평가하기위한 정확한 측정 기술의 필요성은 기계론적 및 중재적 연구 모두에서 비롯됩니다.
그것의 높은 반응성으로 인해, NO는 그것이 생성 및/또는 방출되는 생물학적 매트릭스에 따라 상이한 반응을 겪을 수 있다. 헤모글로빈 (Hb) 또는 다른 옥시헤모단백질의 부재하에, NO는 아질산염 (NO2–)으로 거의 완전히 산화된다.
2NO + O2 →2NO2
NO2 + NO →N2O3
N2O3+H2O →NO2– + H+
NO는 먼저 분자 산소(O2)와 상호 작용하여 이산화질소(NO2)를 생성하고,NO2 자체와 반응하여 삼산화이질소(N2O3)를생성한다. N2O3의 한 분자는 물(H2O)과 반응하여 NO2– 및 양성자(H+)13의2분자를 형성한다. 전혈14,15 내에서, NO와 NO2-는 이들 분자가 Hb의 산화된 헴기[Hb-Fe2+-O2 또는 옥시헤모글로빈(oxyHb)]와 격렬하게 반응하여 질산염(NO3-)으로 빠르게 전환되어 NO3–를 생성한다. 이 반응은 헴기가 페릭 상태로의 전이와 결합된다 [Hb-Fe3+ 또는 메트헤모글로빈 (metHb)]:
Hb-Fe2+–O2 + NO → Hb-Fe3+ +NO3–
적혈구 (RBC) 장벽과 내피에 바로 인접한 공간은 이러한 반응을 제한하는 주요 요인이며 내피에 의해 방출되는 NO의 작은 부분이 EDRF16,17로 작용할 수 있도록합니다. 실제로, 순환에서 무세포 Hb는 실험 및 임상 설정(17,18)에서 혈관확장을 방해하는 것으로 알려져 있다. RBC 내에서, 산소화 및NO2-농도에 따라, NO의 일부는 데옥시헤모글로빈(Hb-Fe2+)과 반응하여 철-니트로실 Hb(Hb-Fe2+-NO 또는 HbNO)를 형성한다:
Hb-Fe2++ NO → Hb-Fe2+-NO
RBC15,17에서, NO2-NO의 방출을 유도하는 Hb-Fe2+를 감소시킴으로써 Hb-Fe3+를 형성할 수 있고, 이는 차례로 Hb-Fe2+-O2 (우선적으로) 또는 Hb-Fe2+에 결합한다.
NO 유도체의 생성은 NO가 다양한 조직 및 상이한 효소에 의해 (예를 들어, 장내 박테리아 또는 미토콘드리아 내에서, 특히 저산소 조건 하에서) NO2- 및NO3–로부터 재생될 수 있기 때문에 엄격하게 단방향성으로 간주되어서는 안 된다.19,20.
가변량의 NO 생성(또는 투여)은 주로 친핵체의 존재하에N2O3로부터 티올 트랜스니트로화에 의해 N-니트로소티올의 하류 생성을 유도하여 NO+ 공여체 중간체(Nuc-NO+–NO2–)를 생성한다:
N2O3+ RS-→ RS-NO + NO2–
S-니트로소티올스 생성에 대한 또 다른 가능성은 산화된 티올의 니트로실화(산화된 티올과 반응하는 NO)이다:
RS• + 아니오 → RS-아니오
NO2에 의한 이러한 메카니즘 및 직접적인 티올 산화는 다른 곳에서 설명되는 매우 특정한 조건에서만 가능할 수 있다(21). S-니트로소티올은 S-니트로소글루타티온과 같은 광분자에서 큰 티올 함유 단백질에 이르기까지 다양합니다. S-니트로소헤모글로빈(S-NO-Hb)은 β쇄(β93C)22 내에 보존된 시스테인 잔기의 티올기의 니트로화에 의해 형성된다.
S-니트로소티올의 생성과 신진 대사는 중요한 조절 메커니즘의 일부입니다. 그 예로는 글루타티온, 카스파제, N-메틸-D-아스파르테이트 (NMDA), 및 리아노딘 수용체 23,24,25,26,27,28의 조절이 포함된다. 이전에 생체내에서 NO 생물학의 주요 매개체로서 고려되었던 니트로화 알부민(S-nitroso-albumin)은 어떠한 특정한 추가적인 생물학적 활성도 없이 NO/NO+ 수송체인 것으로 보인다(29).
생물학적 매트릭스 내의 특정 생물학적 샘플로부터 NO 및 그 유도체의 농도를 측정할 때, 산도, 산소화, 온도 및 시약의 존재와 같은 특성을 고려하는 것이 중요하다. 그 예로는 외인성 NO 공여체 투여를 포함하고, 급성 염증의 설정에서, 과산화수소(H2O2)가NO2와 반응하여 퍼옥시아질산염(ONOO–)21과 같은 초정상 농도의 자유 라디칼의 생성을 유도한다. 사용되는 분석 방법 외에도 샘플 준비 및 저장의 사전 분석 단계가 기본입니다. 생체내 NO 활성을 나타내지 않는 하류 반응은 예측, 고려, 차단되어야 한다. 유효한 예는 S-NO-Hb의 불안정성이며, 측정22를 목표로 할 때 혈액 샘플의 전용 처리가 필요합니다.
화학발광-기반 분석은 조직 균질물30,31을 포함하는 임의의 생물학적 유체에서 NO 및 그의 주요 대사산물 [NO2-,NO3–, S-NO 및 철-니트로실 착물 (Fe-NO)]의 수준을 검출하기 위한 황금 표준이다. 이러한 방법은 NO와 오존(O3)의 반응을 수용하여 여기된 상태(NO2•)에서NO2를 생성하는 장치인 화학발광 검출기(CLD)에 의존합니다. NO2•의 이완은 광승수 튜브에 의해 검출되는 광자의 발광을 야기하여, 샘플링된 가스 혼합물(32)의 NO 함량에 직접적으로 비례하는 전기 신호를 생성한다. CLD의 단순화된 개략도가 표현된다.
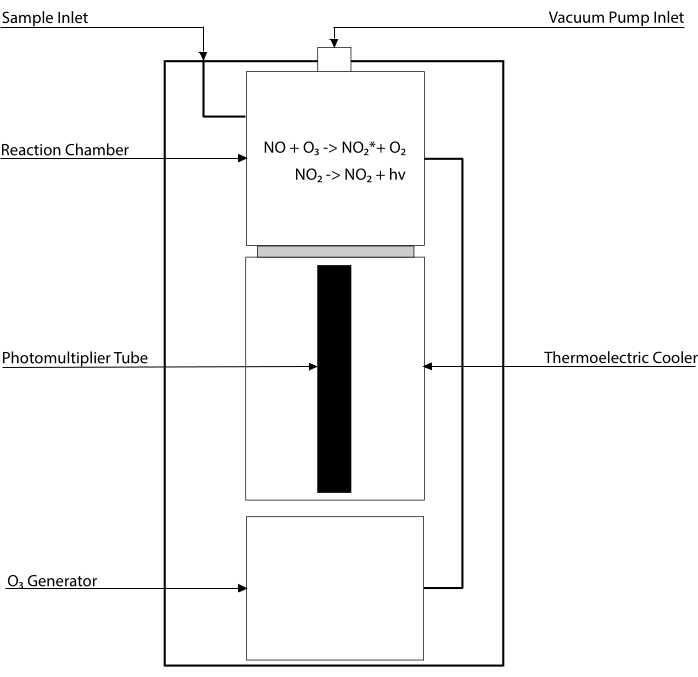
그림 1: 산화질소 가스에 대한 화학발광 검출기의 단순화된 회로도. 화학발광 기반 산화질소(NO)의 검출은 화학발광 검출기(CLD)에 도입되는 NO 가스 분자당 하나의 광자의 화학량론적 생성이다. 화학 발광 반응은 내부 발전기에서 오존 (O3)이 공급되는 지정된 챔버에서 얻어지며, 외부 펌프와의 연결로 음압으로 유지되어 샘플 가스의 지속적이고 지속적인 유입을 허용합니다. O3의 생성에는 CLD와 연결된 전용 O2 탱크에 의해 공급되는 규원자 산소(O2)가 필요합니다(다른 제조업체는 주변 공기로 작동하는 CLD를 제공합니다). 반응 챔버 내에서, 샘플링된 가스에 포함된 NO 가스의 각 분자는 산소와 반응하여 활성화 상태의 이산화질소(NO2*) 한 분자를 산출한다. 그의 기저 상태로 되돌아감으로써, 각각의NO2* 분자는 반응 챔버에 인접해 위치한 광승수 튜브(PMT)에 의해 검출되는 하나의 광자를 방출한다. 증폭기 및 중앙 처리 유닛과 연관된 PMT는 반응 챔버 내의 광자 수 및 NO 분자의 수에 비례하는 신호를 생성한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
CLD의 샘플 입구는 액체 샘플용 반응 챔버를 함유하는 유리 시스템에 연결될 수 있다. 이 시스템은 질소, 헬륨 또는 아르곤과 같은 불활성 가스로 연속적으로 퍼징되어 NO를 반응 챔버에서 CLD로 전달합니다. 액상 샘플은 전용 멤브레인을 통해 정화 용기로 주입됩니다.
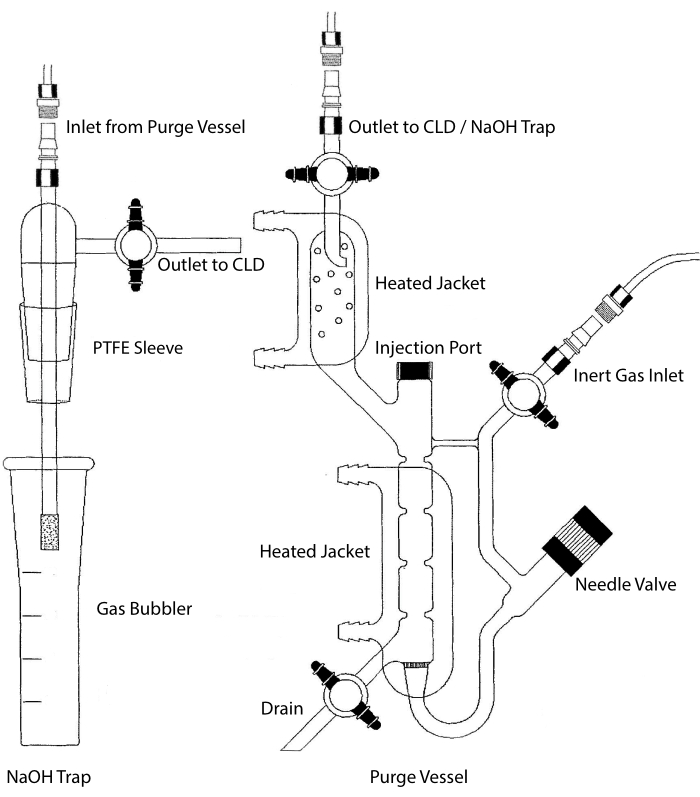
그림 2 : 화학 발광 기반 산화 질소 가스 검출을위한 정화 용기의 구조 퍼지 용기 (오른쪽)는 액상 시약에서 방출 될 때 NO 가스로 쉽게 전환 될 수있는 산화 질소 (NO) 가스 또는 기타 화합물의 검출을 허용합니다. 불활성 가스 유입구는 아르곤, 제온, 또는 이원자성 질소(N2)와 같은 불활성 기체의 소스(탱크)에 연결된다. 바늘 밸브 (왼쪽으로 열림)는 퍼지 용기 내의 압력 제어에 사용되며 용기를 청소하기 위해 완전히 제거 할 수 있습니다. 주입 포트는 샘플 주입을위한 막 중격이있는 캡으로 덮여 있습니다. 멤브레인은 자주 교체해야합니다. 가열된 재킷은 반응 챔버를 둘러싸고 온수 욕조에 연결되어 HCl 분석에서VCl3을 수행한다. 퍼지 용기 출구는 화학발광 검출기 (CLD) 또는 NaOH 트랩에 연결된다 (HCl 분석에서VCl3에 필요함). 반응 챔버 함량을 배출하려면 먼저 불활성 가스 입구와 퍼지 용기 출구에서 스톱콕을 닫고 바늘 밸브를 닫은 다음 주입구에서 캡을 제거한 다음 마지막으로 드레인에서 스톱콕을 엽니 다. NaOH 트랩 (왼쪽)은 HCl의 부식성 때문에 HCl 분석에서VCl3이 수행되는 경우 정화 용기와 CLD 사이에 인라인으로 배치해야합니다. CLD에 연결하려면 CLD와 퍼지 용기의 출력(또는 사용되는 경우 NaOH 트랩) 사이에 항상 강렬한 전계 유전체(IFD) 필터가 배치되어야 합니다. IFD 필터는 공기 중 입자를 제거하고 액체가 퍼지 용기를 통과하는 것을 방지합니다. PTFE = 폴리테트라플루오로에틸렌. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과적으로, 특이적이고 조절된 화학 반응을 통해 NO로 전환될 수 있는 임의의 화합물은 임의의 생물학적 유체 및 조직 균질액(24)에서 높은 감도로 검출될 수 있다. 화학발광을 통한 기상NO의 직접 측정은 실험 및 임상 설정 모두에서 수행된다. 이들 기술은 다른 곳에서도 광범위하게 설명된다(33,34,35). NO2–, S-니트로소티올, S-니트로소티올, S-니트로화 단백질 및 Fe-NOs의 측정은 이들 모든 화합물로부터 NO 가스를 화학량론적으로 방출하는 트리요오다이드(I3–)와의 반응 혼합물에 샘플을 첨가함으로써 수행될 수 있다:
I3– → I2 + I–
2NO2 – +2I– +4H + → 2NO + I 2 +2H2 O
I3 – + 2RS-NO → 3I – + RSSR + 2NO +
2NO + + 2I – → 2NO + I2
반면 I 3-은 NO 3-15와 반응하지 않습니다. 각 화합물의 정확한 측정은 수은 염화물 (HgCl2)의 유무에 관계없이 산성화 된 설파 닐 아미드 (AS)로 샘플 분취량을 전처리함으로써 가능합니다. 구체적으로, AS로 전처리하면NO2-함량이 모두 제거된다. 결과적으로, CLD에 의해 측정된 NO 함량은 S-NOs 및 Fe-NOs 농도의 합만을 반영한다. AS 주입 전에 샘플 분취량에 HgCl2를 주입하면NO2-가 S-NO에 의해 방출됩니다. AS로 처리(NO2-제거로 이어짐)는 측정된 NO 함량이 Fe-NOs의 농도만을 반영하도록 보장한다. 평가 사이의 일련의 감산은 세 개의 NO 유도체(22)의 정확한 농도를 계산할 수있게한다.
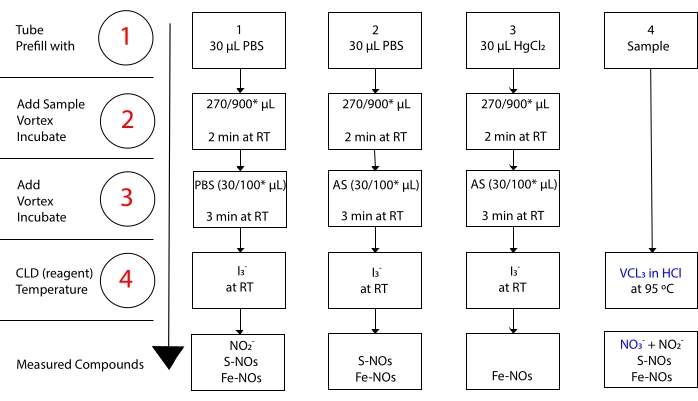
도 3: I3-아세트산 화학발광 분석에서I3-용 시료 제조 단계. 아세트산 화학발광 분석에서 I3-의 제조를 위한 순차적 단계가 예시된다. 광 보호 원심 분리 튜브의 사용이 필요합니다. 튜브 1, 2, 및 3은 분석을 준비하기 위해 사용되는 것들이다. 또 다른 샘플 분취량 (튜브 4)은 질산염 (NO3–)의 측정이 필요한 경우 HCl 분석에서VCl3에 필요합니다. 단계는 빨간색으로 숫자로 표시됩니다. 샘플 부피를 첨가하기 전에 포스페이트 버퍼 식염수(PBS) 또는 HgCl2로 표시된 바와 같이 예비충전(단계 1). 지시된 바와 같이 샘플 부피 (2)를 첨가하고, 볼텍스하고, 실온 (RT)에서 2분 동안 인큐베이션한다. 지시된 바와 같이 (3) PBS 또는 산성화된 설파닐아미드 (AS)를 첨가하고, 볼텍스하고, RT에서 3분 동안 인큐베이션한다. 분석법에 의해 측정된 농도는 각 튜브 하에서보고된 화합물의 농도의 합이다. 튜브 번호 1은 단일 신호로서 아질산염(NO2-), S-니트로소티올(S-NO) 및 철-니트로실 착물(Fe-NOs)의 측정을 허용한다. 질산염 (NO3–) 측정을 위해, 샘플은 HCl 분석에서 아세트산의 I3-와 VCl3 둘 다로 실행되어야하며, 튜브 1로부터 얻은 값은 튜브 4로부터 얻은 값에서 뺄 수 있어야합니다. *잔류NO2-, S-니트로소헤모글로빈 및 철–니트로실헤모글로빈의 결정을 위해 Hb 분석에 사용되는 제안된 양. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
NO3-측정을 위해, 염산(HCl) 중의 바나듐(III) 클로라이드(VCl3)는 CLD를 사용한 NO3-화학량론적으로 측정하기 위해 퍼지 용기 내의NO3-로의 NO로의 전환에 사용된다:
2 NO3– + 3V + 3 +2H2O→ 2NO + 3VO2 + + 4H +
충분히 빠른 전환을 달성하기 위해, 반응은 90-95°C에서 수행될 필요가 있다. NO3-에서 NO2-로의 환원은 HCl에 의한 NO2-내지 NO의 환원과 결합된다. 바나듐 금속은 또한 그들의 NO 모이어티22,36을 해방시키는 S-NOs를 감소시킨다. HCl 중의 VCl3을 갖는 CLD에 의해 수득된 최종 농도는NO3–, NO2, 및 다른 니트로화 화합물의 응집체 농도를 반영한다. I3-를 사용한 CLD로 수득된 농도로부터 후자의 값을 뺀 것은NO3-농도 36,37의 계산을 허용한다(도 3).
NO 소비 분석에서, NO 공여체에 의한 퍼지 용기 내의 NO의 연속 방출은 (Z)-1-[2-(2-아미노에틸)-N-(2-암모니오에틸)아미노]디아젠-1-륨-1,2-디올레이트(DETA-NONOate)와 같은 NO 공여체에 의해 주입된 샘플에서 무세포 옥시Hb를 정량화할 수 있게 하는 안정한 신호를 생성한다. 퍼지 용기에서 소비되는 NO의 양은 샘플(38) 중의 oxyHb의 양과 화학양론적 관계에 있다.
혈장 샘플에서 무세포 Hb에 의한NO2-, NO3-, S–니트로소티올, 철-니트로실 착물, 및 NO 소비의 측정을 위한 프로토콜이 예시된다. RBC 환경에서 NO에 대한 연구는 총 Hb 농도15,22의 결정과 결합 된 매우 취약한 S-NO-Hb 및 Hb-NO를 측정하기 위해 특정 샘플 처리 후 배제 크로마토그래피가 필요합니다. 샘플 준비는 측정을 교정하는 데 도움이됩니다. 분석 동안 H2O에서 NO2-의 사전 존재 및NO2-방출은 S-NO-Hb14,39와 같은 인위적으로 더 높은 농도의 NO 유도체의 측정을 유도할 수 있다. 샘플 준비의 중요한 측면도 제시됩니다.
Protocol
Representative Results
Discussion
높은 민감도로 인해, NO 및 관련 화합물의 결정을 위한 화학발광 기반 분석은NO2-오염의 위험이 높다. 실험에 사용된 각각의 시약 (특히 NO2-차단 용액) 및 희석제 (ddH2O 포함)는 배경 신호에 대해 보정하기위해 그의NO2–함량에 대해 시험되어야 한다. 아질산염은 10분 전혈에서 반감기가 매우 반응하며NO3–를 빠르게 생성한다. 따?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 원고에보고 된 프로토콜은 매사추세츠 종합 병원의 마취학과 인 워렌 자폴 (Warren Zapol) 박사의 중환자 치료 마취 연구 연구소의 이전 동료들의 축적 된 기여로 가능했습니다. 우리는 나카가와 아키토 박사, 프란체스코 자덱, 엠마누엘레 바세나, 정 레이, 나가사카 야스코, 에스테르 스파그놀리, 엠마누엘레 레조아글리 박사의 공헌을 인정합니다.
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
References
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

