Chemilumineszenz-basierte Assays zum Nachweis von Stickstoffmonoxid und seinen Derivaten aus Autoxidation und nitrosierten Verbindungen
Summary
Hier stellen wir Protokolle zum Nachweis von Stickstoffmonoxid und seinen biologisch relevanten Derivaten mittels Chemilumineszenz-basierter Assays mit hoher Sensitivität vor.
Abstract
Die Aktivität von Stickstoffmonoxid (NO) in vivo ist das kombinierte Ergebnis seiner direkten Wirkungen, der Wirkung seiner Derivate, die durch NO-Autoxidation erzeugt werden, und der Wirkung von nitrosierten Verbindungen. Die Messung von NO-Metaboliten ist für die Untersuchung der NO-Aktivität sowohl auf Gefäßebene als auch in anderen Geweben unerlässlich, insbesondere in den experimentellen Umgebungen, in denen exogenes NO verabreicht wird. Ozonbasierte Chemilumineszenz-Assays ermöglichen präzise Messungen von NO- und NO-Metaboliten sowohl in Flüssigkeiten (einschließlich Plasma, Gewebehomogenaten, Zellkulturen) als auch in Gasgemischen (z. B. ausgeatmeter Atem). NO reagiert mit Ozon, um Stickstoffdioxid in einem angeregten Zustand zu erzeugen. Die daraus resultierende Lichtemission ermöglicht die Photodetektion und die Erzeugung eines elektrischen Signals, das den NO-Gehalt der Probe reflektiert. Aliquots aus derselben Probe können verwendet werden, um spezifische NO-Metaboliten wie Nitrat, Nitrit, S-Nitrosothiole und Eisen-Nitrosyl-Komplexe zu messen. Darüber hinaus wird NO, das von zellfreiem Hämoglobin verbraucht wird, auch mit der Chemilumineszenzanalyse quantifiziert. Eine Illustration all dieser Techniken wird zur Verfügung gestellt.
Introduction
Seit Salvador Moncada und die Nobelpreisträger Robert Furchgott, Louis Ignarro und Ferid Murad Stickstoffmonoxid (NO) als den bisher bekannten Endothel-abgeleiteten Relaxationsfaktor (EDRF) identifiziert haben, wurde die zentrale Rolle von NO in mehreren Schlüsselmechanismen etabliert, die sich über die Gefäßbiologie, die Neurowissenschaften, den Stoffwechsel und die Wirtsantwort erstrecken 1,2,3,4,5,6,7 . Die exogene Verabreichung von NO-Gas hat sich zu einer etablierten Behandlung für Ateminsuffizienz aufgrund von pulmonaler Hypertonie beim Neugeborenenentwickelt 8. Stickstoffmonoxidgas wurde auch zur Behandlung von Infektionen mit dem respiratorischen Synzytialvirus (RSV), Malaria und anderen Infektionskrankheiten, Ischämie-Reperfusionsverletzungen und zur Vorbeugung akuter Nierenschäden bei Patienten, die sich einer Herzoperation unterziehen, untersucht 9,10,11,12. Der Bedarf an präzisen Messtechniken zur Beurteilung der NO-Werte, seiner Metaboliten und der seiner Zielproteine und -verbindungen ergibt sich sowohl aus mechanistischen als auch aus interventionellen Studien.
Aufgrund seiner hohen Reaktivität kann NO je nach biologischer Matrix, in der es hergestellt und/oder freigesetzt wird, unterschiedliche Reaktionen erfahren. In Abwesenheit von Hämoglobin (Hb) oder anderen Oxy-Hämoproteinen wird NO fast vollständig zu Nitrit oxidiert (NO2–).
2NEIN + O 2 → 2NR.2
NR. 2 + NR. → N2O3
N2O3 + H 2 O → NO2– + H+
NO wird zunächst mit molekularem Sauerstoff (O2) zu Stickstoffdioxid (NO2) autoxidiert und reagiert selbst mitNO2 zur Erzeugung von Distickstofftrioxid (N2O3). Ein MolekülN2O3reagiert mit Wasser (H2O) zu zwei Molekülen von NO2- und einem Proton (H+)13. Im Vollblutwerden 14,15, NO und NO 2- schnell in Nitrat (NO3-) umgewandelt, da diese Moleküle eifrig mit den oxidierten Hämgruppen von Hb [Hb-Fe2+–O2 oder Oxyhämoglobin (oxyHb)] reagieren, um NO3– zu erhalten. Diese Reaktion ist mit dem Übergang der Hämgruppe in den ferrischen Zustand [Hb-Fe 3+ oder Methämoglobin (metHb)] gekoppelt:
Hb-Fe2+-O2 + NO → Hb-Fe3+ + NO3–
Die Barriere der roten Blutkörperchen (RBC) und der unmittelbar an das Endothel angrenzende Raum sind die Hauptfaktoren, die diese Reaktion begrenzen und es einem kleinen Teil des vom Endothel freigesetzten NO ermöglichen, als EDRF16,17 zu wirken. Tatsächlich ist bekannt, dass zellfreies Hb im Kreislauf die Vasodilatation in experimentellen und klinischen Umgebungen stört17,18. Innerhalb der RBC reagiert je nach Oxygenierung undNO2-Konzentration ein Teil von NO mit Desoxyhämoglobin (Hb-Fe 2+) zu Eisen-Nitrosyl Hb (Hb-Fe2+–NO oder HbNO):
Hb-Fe2 + + NEIN → Hb-Fe2+-NEIN
Im RBC15,17 kann NO 2- Hb-Fe 3+ bilden, indem es Hb-Fe 2+ reduziert, was zur Freisetzung von NO führt, das wiederum Hb-Fe 2+-O2 (bevorzugt) oder Hb-Fe 2+ bindet.
Die Erzeugung von NO-Derivaten sollte nicht als streng unidirektional betrachtet werden, da NO aus NO2– und NO3– in verschiedenen Geweben und durch verschiedene Enzyme (z.B. durch Darmbakterien oder in Mitochondrien, insbesondere unter hypoxischen Bedingungen) regeneriert werden kann19,20.
Eine variable Menge an produziertem (oder verabreichtem) NO führt zur nachgeschalteten Erzeugung von S-Nitrosothen, hauptsächlich durch Thiol-Transnitrosierung aus N2O3 in Gegenwart eines Nucleophils, wodurch ein NO+-Donorzwischenprodukt entsteht (Nuc-NO+-NO2-):
N 2 O3 + RS– → RS-NO + NO2–
Eine weitere Möglichkeit zur Erzeugung von S-Nitrosothiolen ist die Nitrosylierung oxidierter Thiole (KEINE Reaktion mit einem oxidierten Thiol):
RS• + NEIN → RS-NEIN
Dieser Mechanismus und die direkte Thioloxidation durch NR.2 sind möglicherweise nur unter sehr spezifischen Bedingungen möglich, die an anderer Stelle21 beschrieben werden. S-Nitrosothiole reichen von leichten Molekülen wie S-Nitrosoglutathion bis hin zu großen Thiol-haltigen Proteinen. S-Nitrosohämoglobin (S-NO-Hb) wird durch Nitrosierung einer Thiolgruppe eines konservierten Cysteinrests in der β-Kette (β93C)22 gebildet.
Die Erzeugung und der Stoffwechsel von S-Nitrosothiolen sind Teil wichtiger Regulationsmechanismen. Beispiele hierfür sind die Regulation von Glutathion, Caspasen, N-Methyl-D-Aspartat (NMDA) und Ryanodinrezeptoren23,24,25,26,27,28. Nitrosiertes Albumin (S-Nitroso-Albumin), das bisher als wichtiger Vermittler der NO-Biologie in vivo galt, scheint ein NO/NO+-Transporter ohne spezifische zusätzliche biologische Aktivitätzu sein 29.
Bei der Messung der Konzentration von NO und seinen Derivaten aus einer bestimmten biologischen Probe innerhalb einer biologischen Matrix ist es wichtig, Eigenschaften wie Säuregehalt, Sauerstoffversorgung, Temperatur und das Vorhandensein von Reagenzien zu berücksichtigen. Beispiele hierfür sind verabreichte exogene NO-Donatoren und, im Rahmen einer akuten Entzündung, Wasserstoffperoxid (H2O2), das mitNO2 reagiert, was zur Erzeugung einer übernormalen Konzentration von freien Radikalen wie Peroxynitrit (ONOO-)21 führt. Neben der verwendeten Analysemethode ist die präanalytische Phase der Probenvorbereitung und -lagerung von grundlegender Bedeutung. Nachgeschaltete Reaktionen, die nicht die in vivo NO-Aktivität darstellen, sind vorherzusagen, zu berücksichtigen und zu blockieren. Ein valides Beispiel ist die Instabilität von S-NO-Hb, die eine spezielle Behandlung von Blutproben erfordert, wenn es für die Messungvorgesehen ist 22.
Chemilumineszenz-basierte Assays sind der Goldstandard für den Nachweis der NO-Spiegel und seiner Hauptmetaboliten [NO2-, NO3-, S-NO- und Eisen-Nitrosyl-Komplexe (Fe-NO)] in jeder biologischen Flüssigkeit, einschließlich Gewebehomogenaten30,31. Diese Methoden basieren auf dem Chemilumineszenzdetektor (CLD), einem Gerät, das die Reaktion von NO mit Ozon (O3) beherbergt und NO 2 in einem angeregten Zustand (NO2•) erzeugt. Die Relaxation von NO2• verursacht die Emission eines Lichtphotons, das von einem Photomultiplierrohr detektiert wird, wodurch ein elektrisches Signal erzeugt wird, das direkt proportional zum NO-Gehalt des abgetasteten Gasgemisches32 ist. Es wird ein vereinfachter Schaltplan der CLD dargestellt.
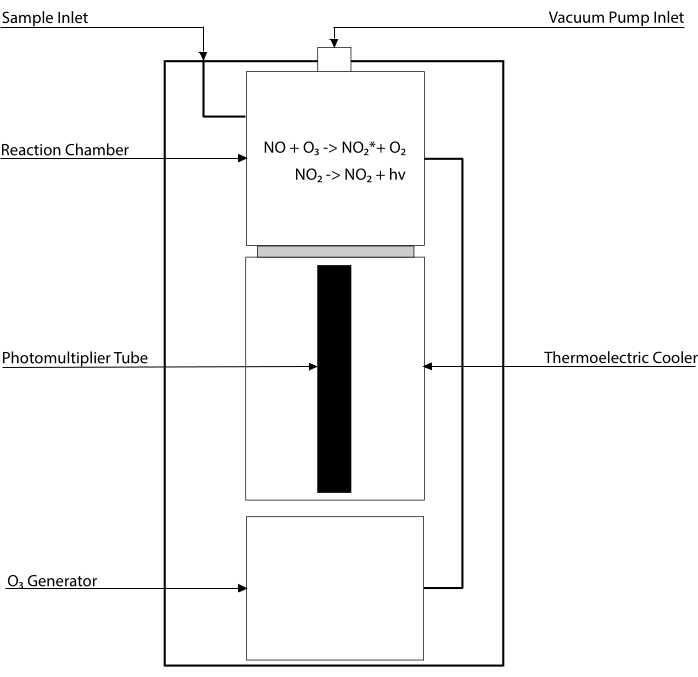
Abbildung 1: Vereinfachtes Schema eines Chemilumineszenzdetektors für Stickoxidgas. Der Chemilumineszenz-basierte Nachweis von Stickstoffmonoxid (NO) ist die stöchiometrische Erzeugung eines Photons pro NO-Gasmolekül, das in den Chemilumineszenzdetektor (CLD) eingeführt wird. Die Chemilumineszenzreaktion wird in einer dafür vorgesehenen Kammer erhalten, die mit Ozon (O3) von einem internen Generator versorgt wird, der durch Verbindung mit einer externen Pumpe auf Unterdruck gehalten wird, was einen kontinuierlichen und konstanten Zufluss von Messgas ermöglicht. Die Erzeugung von O3 erfordert zweiatomigen Sauerstoff (O2), der von einem speziellenO2-Tank geliefert wird, der mit dem CLD verbunden ist (andere Hersteller bieten CLDs an, die mit Umgebungsluft betrieben werden). Innerhalb der Reaktionskammer reagiert jedes im beprobten Gas enthaltene NO-Gasmolekül mit Sauerstoff zu einem Molekül Stickstoffdioxid im aktivierten Zustand (NO2*). Durch die Rückkehr in seinen Grundzustand emittiert jedes NO2*-Molekül ein Photon, das von einer Photomultiplierröhre (PMT) neben der Reaktionskammer detektiert wird. Das PMT mit dem zugehörigen Verstärker und der zentralen Verarbeitungseinheit erzeugt ein Signal, das proportional zur Photonenzahl und der Anzahl der NO-Moleküle in der Reaktionskammer ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Der Probeneinlass des CLD kann an ein Glaswarensystem angeschlossen werden, das eine Reaktionskammer für flüssige Proben enthält. Das System wird kontinuierlich mit einem Inertgas wie Stickstoff, Helium oder Argon gespült, wodurch NO von der Reaktionskammer auf die CLD übertragen wird. Flüssigphasenproben werden durch eine spezielle Membran in den Spülbehälter injiziert.
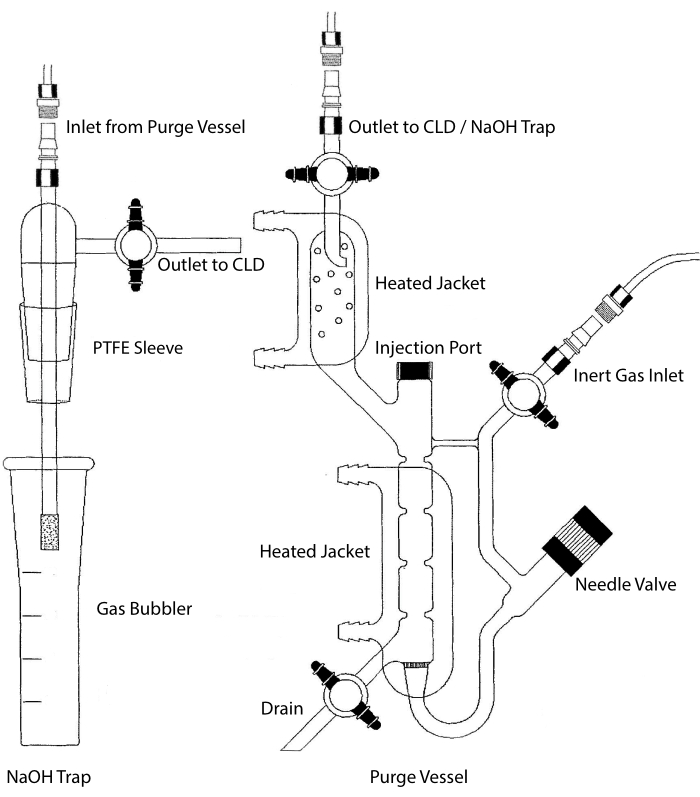
Abbildung 2: Struktur eines Spülgefäßes für die chemilumineszenzbasierte Detektion von Stickoxidgas Das Spülgefäß (rechts) ermöglicht den Nachweis von Stickstoffmonoxid (NO) -Gas oder einer anderen Verbindung, die leicht in NO-Gas umgewandelt werden kann, wenn sie aus einem flüssigen Phasenreagenz freigesetzt wird. Der Inertgaseinlass ist an eine Quelle (Tank) eines Inertgases wie Argon, Xeon oder zweiatomigen Stickstoff (N2) angeschlossen. Das Nadelventil (öffnet sich nach links) dient zur Druckregelung innerhalb des Spülbehälters und kann zur Reinigung des Behälters vollständig entfernt werden. Der Injektionsanschluss ist von einer Kappe mit einem Membranseptum für die Probeninjektion bedeckt. Die Membran sollte oft ausgetauscht werden. Ein beheizter Mantel umgibt die Reaktionskammer und ist an ein Warmwasserbad angeschlossen, um denVCl 3 in HCl-Assay durchzuführen. Der Spülgefäßauslass ist mit dem Chemilumineszenzdetektor (CLD) oder mit der NaOH-Falle (erforderlich fürVCl 3 in HCl-Assays) verbunden. Um den Inhalt der Reaktionskammer abzulassen, schließen Sie zunächst die Absperrhähne am Inertgaseinlass und am Spülbehälterauslass, schließen Sie das Nadelventil, entfernen Sie die Kappe am Einspritzanschluss und öffnen Sie schließlich den Absperrhahn am Abfluss. Die NaOH-Falle (links) muss inline zwischen dem Spülgefäß und dem CLD platziert werden, wenn derVCl 3 in HCl-Assay aufgrund der Korrosivität von HCl durchgeführt wird. Die Verbindung mit dem CLD erfordert immer, dass ein Intensivfeld-Dielektrikum (IFD) zwischen dem CLD und dem Ausgang des Spülbehälters (oder der NaOH-Falle, falls verwendet) platziert wird. Der IFD-Filter entfernt luftgetragene Partikel und verhindert, dass Flüssigkeit durch das Spülgefäß gelangt. PTFE = Polytetrafluorethylen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Infolgedessen kann jede Verbindung, die durch eine spezifische und kontrollierte chemische Reaktion in NO umgewandelt werden kann, mit hoher Empfindlichkeit in jeder biologischen Flüssigkeit und jedem Gewebehomogenat24 nachgewiesen werden. Die direkte Messung von Gasphasen-NO durch Chemilumineszenz wird sowohl in experimentellen als auch in klinischen Umgebungen durchgeführt. Diese Techniken werden an anderer Stelle ausführlich beschrieben33,34,35. Die Messung von NO2-, S-Nitrosothiolen, S-nitrosierten Proteinen und Fe-NOs kann durch Zugabe von Proben in einem Reaktionsgemisch mit Triiodid (I3–) durchgeführt werden, das stöchiometrisch KEIN Gas aus all diesen Verbindungen freisetzt:
I3– → I2 + I–
2NO 2− +2I− +4H+ → 2NO + I 2 +2H 2 O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NEIN + I2
während I 3- nicht mit NO 3-15 reagiert. Präzise Messungen jeder Verbindung werden durch die Vorbehandlung von Probenaliquoten mit angesäuertem Sulfanilamid (AS) mit oder ohne Quecksilberchlorid (HgCl2) ermöglicht. Insbesondere entfernt die Vorbehandlung mit AS alle NO 2-Inhalte. Infolgedessen spiegelt der von der CLD gemessene NO-Gehalt nur die Summe der S-NO- und Fe-NOs-Konzentration wider. Die Injektion von HgCl 2 in eine Probe aliquot vor der AS-Injektion bewirkt, dass NO2– durch S-NO freigesetzt wird. Die Behandlung mit AS (die zur NO2-Entfernung führt) stellt sicher, dass der gemessene NO-Gehalt nur die Konzentration von Fe-NOs widerspiegelt. Eine Reihe von Subtraktionen zwischen den Bewertungen ermöglicht es, die genaue Konzentration der drei NO-Derivatezu berechnen 22.
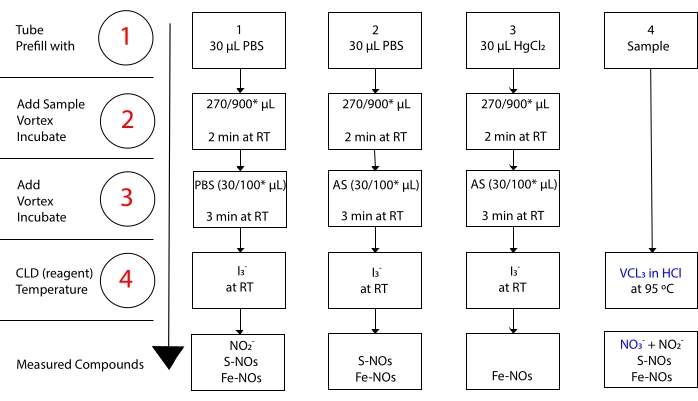
Abbildung 3: Schritte in der Probenvorbereitung für denI3– in Essigsäure-Chemilumineszenz-Assay. Die sequentiellen Schritte zur Herstellung des I-3-in-Essigsäure-Chemilumineszenz-Assays sind dargestellt. Die Verwendung von lichtgeschützten Zentrifugenröhrchen ist erforderlich. Die Röhrchen 1, 2 und 3 werden zur Vorbereitung auf den Assay verwendet. Ein weiteres Probenaliquot (Tube 4) wird für denVCl 3 in HCl-Assay benötigt, wenn die Messung von Nitrat (NO3–) erforderlich ist. Die Schritte werden durch rot markierte Zahlen gekennzeichnet. Vorfüllen (Schritt 1) wie angegeben mit Phosphatpufferkochsalzlösung (PBS) oder HgCl2 vor Zugabe des Probenvolumens. Fügen Sie das Probenvolumen (2) wie angegeben hinzu, wirbeln Sie es ein und inkubieren Sie es für 2 Minuten bei Raumtemperatur (RT). Fügen Sie (3) PBS oder angesäuertes Sulfanilamid (AS) wie angegeben, Wirbel hinzu und inkubieren Sie für 3 Minuten bei RT. Führen Sie den Assay aus (4). Die durch den Assay gemessene Konzentration ist die Summe der Konzentration der Verbindungen, die unter jedem Röhrchen berichtet werden. Röhre Nummer 1 ermöglicht Messungen von Nitrit (NO2-), S-Nitrosothiolen (S-NO) und Eisen-Nitrosyl-Komplexen (Fe-NOs) als ein einziges Signal. Für die Nitratmessung (NR.3-) sind die Proben sowohl mit I 3- in Essigsäure als auch mitVCl 3 in HCl-Assays zu verwenden, und der aus Röhrchen 1 erhaltene Wert ist von dem aus Röhrchen 4 erhaltenen Wert zu subtrahieren. *empfohlene Mengen für die Hb-Analyse zur Bestimmung vonRest-NO2-, S-Nitrosohämoglobin und Eisen-Nitrosyl-Hämoglobin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Für die NO3-Messung wird Vanadium(III)-chlorid (VCl3) in Salzsäure (HCl) zur Umwandlung von NO 3– in NO im Spülgefäß verwendet, um NO3– stöchiometrisch mit der CLD zu messen:
2 NR.3–+ 3V+3 + 2H 2 O →2NO+ 3VO2+ + 4H+
Um eine ausreichend schnelle Umwandlung zu erreichen, muss die Reaktion bei 90-95 °C durchgeführt werden. Die Reduktion von NO3– auf NO 2- ist gekoppelt mit der Reduktion von NO2– auf NO durch HCl. Vanadiummetall reduziert auch S-NOs und setzt ihre NO-Einheit 22,36 frei. Die endgültige Konzentration, die CLD mitVCl 3 in HCl erhält, spiegelt die Gesamtkonzentration von NO3–, NO2 und anderen nitrosierten Verbindungen wider. Die Subtraktion des letztgenannten Wertes von der mit CLD mit I 3- ergebenden Konzentration ermöglicht die Berechnung der NO 3– Konzentration36,37 (Abbildung 3).
Im NO-Verbrauchsassay erzeugt die kontinuierliche Freisetzung von NO im Spülgefäß durch NO-Donatoren wie (Z)-1-[2-(2-aminoethyl)-N-(2-ammonioethyl)amino]diazen-1-ium-1,2-diolate (DETA-NONOate) ein stabiles Signal, das die Quantifizierung von zellfreiem oxyHb in den injizierten Proben ermöglicht. Die Menge an NO, die im Spülgefäß verbraucht wird, steht in einer stöchiometrischen Beziehung zur Menge an oxyHb in der Probe38.
Protokolle zur Messung vonNO2-,NO3–, S-Nitrosothiolen, Eisen-Nitrosyl-Komplexen und NO-Verbrauch durch zellfreies Hb in Plasmaproben sind dargestellt. Studien zu NO in der RBC-Umgebung erfordern eine spezifische Probenbehandlung, gefolgt von einer Ausschlusschromatographie, um extrem fragile S-NO-Hb und Hb-NO in Verbindung mit der Bestimmung der Hb-Gesamtkonzentration15,22 zu messen. Die Probenvorbereitung ist für die Korrektur der Messung von entscheidender Bedeutung. Die Präexistenz von NO2– inH2Ound die Freisetzung vonNO2– während des Assays können zur Messung künstlich höherer Konzentrationen von NO-Derivaten wie S-NO-Hb 14,39 führen. Wichtige Aspekte der Probenvorbereitung werden ebenfalls vorgestellt.
Protocol
Representative Results
Discussion
Aufgrund der hohen Sensitivität haben Chemilumineszenz-basierte Assays zur Bestimmung von NO und verwandten Verbindungen ein hohes Risiko einerNO2-Kontamination. Jedes Reagenz (insbesondere die NO-2-Blockierungslösung) und jedes Verdünnungsmittel (einschließlich ddH 2 O), das im Experiment verwendet wird, sollte auf seinenNO-2-Gehaltgetestet werden, um das Hintergrundsignal zu korrigieren. Nitrit ist extrem reaktiv mit einer Halbwertszeit im…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die in diesem Manuskript berichteten Protokolle wurden durch die gesammelten Beiträge früherer Stipendiaten von Dr. Warren Zapols Labor für Anästhesieforschung in der Intensivmedizin, Abteilung für Anästhesie am Massachusetts General Hospital, ermöglicht. Wir danken Dr. Akito Nakagawa, Dr. Francesco Zadek, Dr. Emanuele Vassena, Dr. Chong Lei, Dr. Yasuko Nagasaka, Dr. Ester Spagnolli und Dr. Emanuele Rezoagli.
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
References
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

