Nitrik Oksit ve Türevlerinin Otoksidasyon ve Nitroslu Bileşiklerden Tespiti için Kemilüminesans Bazlı Testler
Summary
Burada, nitrik oksit ve biyolojik olarak ilgili türevlerini, yüksek hassasiyete sahip kemilüminesans bazlı testler kullanarak tespit etmek için protokoller sunuyoruz.
Abstract
İn vivo nitrik oksit (NO) aktivitesi, doğrudan etkilerinin, NO otoksidasyonundan üretilen türevlerinin etkisinin ve nitroslu bileşiklerin etkilerinin birleşik sonuçlarıdır. NO metabolitlerinin ölçülmesi, hem vasküler seviyelerde hem de diğer dokularda, özellikle de eksojen NO’nun uygulandığı deneysel ortamlarda NO aktivitesini incelemek için gereklidir. Ozon bazlı kemilüminesans testleri, hem sıvılarda (plazma, doku homojenatları, hücre kültürleri dahil) hem de gaz karışımlarında (örneğin, ekshale edilen nefes) NO ve NO metabolitlerinin hassas ölçümlerine izin verir. NO, uyarılmış bir durumda azot dioksit üretmek için ozon ile reaksiyona girer. Sonuçta ortaya çıkan ışık emisyonu, fotoalgılamaya ve numunenin NO içeriğini yansıtan bir elektrik sinyalinin üretilmesine izin verir. Aynı numuneden elde edilen alikotlar, nitrat, nitrit, S-nitrosotioller ve demir-nitrosil kompleksleri gibi spesifik NO metabolitlerini ölçmek için kullanılabilir. Ek olarak, hücresiz hemoglobin tarafından tüketilen NO, kemilüminesans analizi ile de ölçülür. Tüm bu tekniklerin bir örneği verilmiştir.
Introduction
Salvador Moncada ve Nobel ödüllü Robert Furchgott, Louis Ignarro ve Ferid Murad, nitrik oksidi (NO) daha önce bilinen endotel kaynaklı gevşeme faktörü (EDRF) olarak tanımladıklarından beri, NO’nun merkezi rolü vasküler biyoloji, nörobilimler, metabolizma ve konakçı yanıtı boyunca uzanan birkaç anahtar mekanizmada kurulmuştur 1,2,3,4,5,6,7 . NO gazının eksojen olarak uygulanması, yenidoğanda pulmoner hipertansiyona bağlı solunum yetmezliği için yerleşik bir tedavi haline gelmiştir8. Nitrik oksit gazı ayrıca solunum sinsityal virüs (RSV) enfeksiyonu, sıtma ve diğer enfektif hastalıkların, iskemi-reperfüzyon hasarının tedavisinde ve kalp cerrahisi geçiren hastalarda akut böbrek hasarının önlenmesinde araştırılmıştır 9,10,11,12. NO’nun seviyelerini, metabolitlerini ve hedef protein ve bileşiklerinin seviyelerini değerlendirmek için hassas ölçüm tekniklerine duyulan ihtiyaç, hem mekanik hem de girişimsel çalışmalardan kaynaklanmaktadır.
Yüksek reaktivitesi nedeniyle, NO, üretildiği ve / veya salındığı biyolojik matrise bağlı olarak farklı reaksiyonlara maruz kalabilir. Hemoglobin (Hb) veya diğer oksi-hemoproteinlerin yokluğunda, NO neredeyse tamamen nitrite (NO2–) oksitlenir.
2NO + O 2 → 2NO2
NO 2 + NO → N2O3
N 2 O3 + H 2 O →NO2– + H+
NO, azot dioksit(NO 2) üretmek için önce moleküler oksijen (O2) ile otoksidasyona tabi tutulur ve diazot trioksit (N 2O3) üretmek için NO2’ninkendisi ile reaksiyona girer. N2O3’ün bir molekülü, iki NO 2- molekülü ve bir proton (H +) 13 oluşturmak için su (H2O) ile reaksiyona girer. Tam kan14,15 içinde, NO ve NO 2- hızla nitrata (NO 3-) dönüştürülür, çünkü bu moleküller Hb’nin oksitlenmiş heme grupları [Hb-Fe2 + -O 2 veya oksihemoglobin (oksiHb)] ile NO3– vermek için hevesle reaksiyona girer. Bu reaksiyon, heme grubunun ferrik duruma [Hb-Fe3+ veya methemoglobin (metHb)] geçişi ile birleştirilir:
Hb-Fe2+-O2 + NO → Hb-Fe3+ NO3–
Kırmızı kan hücresi (RBC) bariyeri ve endotelin hemen bitişiğindeki boşluk, bu reaksiyonu sınırlayan ve endotel tarafından salınan NO’nun küçük bir kısmının EDRF16,17 olarak hareket etmesine izin veren ana faktörlerdir. Aslında, dolaşımdaki hücresiz Hb’nin deneysel ve klinik ortamlarda vazodilatasyonu bozduğu bilinmektedir17,18. RBC içinde, oksijenasyona ve NO 2- konsantrasyonuna bağlı olarak, NO’nun bir kısmı demir-nitrosil Hb (Hb-Fe 2 +-NO veya HbNO) oluşturmak için deoksihemoglobin (Hb-Fe 2 +) ile reaksiyona girer:
Hb-Fe2 + + NO → Hb-Fe2+-NO
RBC15,17’de, NO 2- Hb-Fe 2+’yı azaltarak Hb-Fe 2+’yı oluşturabilir ve bu da NO’nun salınımına yol açar ve bu da Hb-Fe2+-O2 (tercihen) veya Hb-Fe 2+‘yı bağlar.
NO-türevlerinin üretimi kesinlikle tek yönlü olarak kabul edilmemelidir, çünkü NO, çeşitli dokularda ve farklı enzimlerde (örneğin, bağırsak bakterileri veya mitokondri içinde, özellikle hipoksik koşullar altında) NO-2– ve NO 3’ten rejenere edilebilir19,20.
Üretilen (veya uygulanan) değişken miktarda NO, esas olarak bir NO+ donör ara maddesi (Nuc-NO+-NO 2–) oluşturan bir nükleofil varlığındaN2O3’ten tiol transnitrozasyonu ile S-nitrosothiollerin aşağı akış üretimine yol açar:
N 2 O3 + RS- → RS-NO + NO2–
S-nitrosothiols üretimi için bir başka olasılık, oksitlenmiş tiollerin nitrosilasyonudur (oksitlenmiş bir tiol ile reaksiyona giren NO):
RS• + NO → RS-NO
Bu mekanizma ve NO2 ile doğrudan tiol oksidasyonu, yalnızca başka bir yerde21’de açıklanan çok özel koşullarda mümkün olabilir. S-nitrosothioller, S-nitrosoglutathione gibi hafif moleküllerden büyük tiol içeren proteinlere kadar uzanır. S-nitrosohemoglobin (S-NO-Hb), β zincirinde (β93C)22 korunmuş bir sistein kalıntısının bir tiol grubunun nitrozasyonu ile oluşur.
S-nitrosothiollerin üretimi ve metabolizması önemli düzenleyici mekanizmaların bir parçasıdır. Örnekler arasında glutatyon, kaspazlar, N-metil-D-Aspartat (NMDA) ve ryanodin reseptörlerinin23,24,25,26,27,28 regülasyonu sayılabilir. Daha önce in vivo olarak NO biyolojisinin önemli bir aracısı olarak kabul edilen nitrosated albümin (S-nitroso-albumin), herhangi bir spesifik ek biyolojik aktivite içermeyen bir NO / NO + taşıyıcısı gibi görünmektedir29.
NO konsantrasyonunu ve türevlerini biyolojik bir matris içindeki belirli bir biyolojik numuneden ölçerken, asitlik, oksijenasyon, sıcaklık ve reaktiflerin varlığı gibi özellikleri dikkate almak önemlidir. Örnekler arasında uygulanan eksojen NO donörleri ve akut inflamasyon durumunda, NO2ile reaksiyona giren hidrojen peroksit (H2 O2), peroksinitrit (ONOO–)21 gibi serbest radikallerin olağanüstü konsantrasyonunun oluşmasına yol açar. Kullanılan analitik yönteme ek olarak, numune hazırlama ve depolamanın analitik öncesi aşaması da esastır. İn vivo NO aktivitesini temsil etmeyen aşağı akış reaksiyonları tahmin edilmeli, dikkate alınmalı ve bloke edilmelidir. Geçerli bir örnek, ölçüm22 için hedeflendiğinde kan örneklerinin özel bir tedavisini gerektiren S-NO-Hb’nin dengesizliğidir.
Kemilüminesans bazlı testler, doku homojenatları30,31 dahil olmak üzere herhangi bir biyolojik sıvıdaki NO ve ana metabolitlerinin [NO2-, NO3-, S-NO ve demir-nitrosil kompleksleri (Fe-NO)] seviyelerini tespit etmek için altın standarttır. Bu yöntemler, NO’nun ozon (O3) ile reaksiyonunu barındıran ve uyarılmış bir durumda (NO2 •) NO2 üreten bir cihaz olan kemilüminesans dedektörüne (CLD) dayanır. NO2• gevşemesi, bir fotoçarpan tüpü tarafından algılanan bir ışık fotonunun emisyonuna neden olur ve örneklenen gaz karışımının NO içeriği ile doğru orantılı bir elektrik sinyali üretir32. CLD’nin basitleştirilmiş bir şeması temsil edilir.
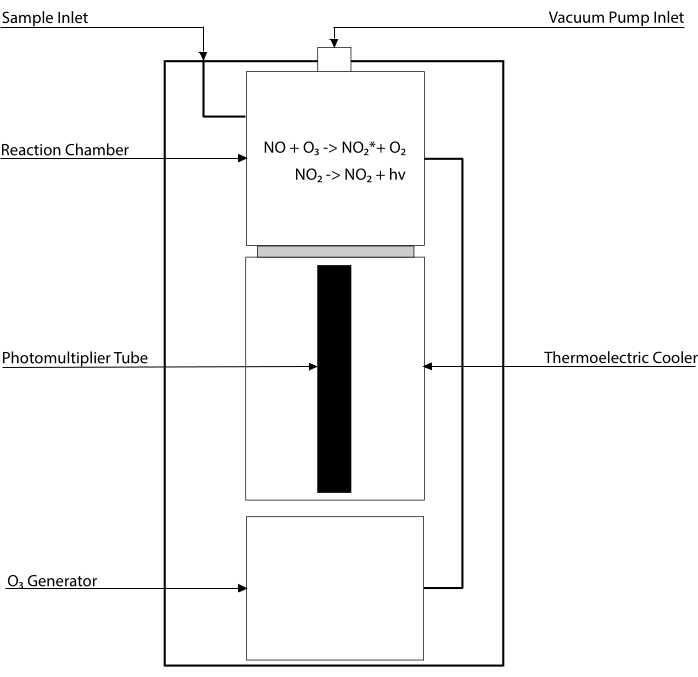
Şekil 1: Nitrik oksit gazı için bir kemilüminesans dedektörünün basitleştirilmiş şeması. Nitrik oksidin (NO) kemilüminesans temelli tespiti, kemilüminesans dedektöründe (CLD) tanıtılan NO gaz molekülü başına bir fotonun stokiyometrik üretimidir. Kemilüminesans reaksiyonu, harici bir pompa ile bağlanarak negatif basınçta tutulan ve numune gazının sürekli ve sabit girişine izin veren dahili bir jeneratörden ozon (O3) ile beslenen belirlenmiş bir odada elde edilir. O3 üretimi, CLD ile bağlantılı özel bir O2 tankı tarafından sağlanan diyatomik oksijen (O2) gerektirir (diğer üreticiler ortam havasıyla çalışan CLD’ler sağlar). Reaksiyon odasında, örneklenen gazda bulunan her bir NO gazı molekülü, aktif durumda (NO2*) bir azot dioksit molekülü üretmek için oksijenle reaksiyona girer. Zemin durumuna geri dönerek, her NO2 * molekülü, reaksiyon odasına bitişik bulunan bir fotoçarpan tüpü (PMT) tarafından tespit edilen bir foton yayar. İlgili amplifikatör ve merkezi işlem ünitesi ile PMT, foton sayısı ve reaksiyon odasındaki NO moleküllerinin sayısı ile orantılı bir sinyal üretir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
CLD’nin numune girişi, sıvı numuneler için bir reaksiyon odası içeren bir cam eşya sistemine bağlanabilir. Sistem azot, helyum veya argon gibi inert bir gazla sürekli olarak temizlenir ve NO’yu reaksiyon odasından CLD’ye aktarır.
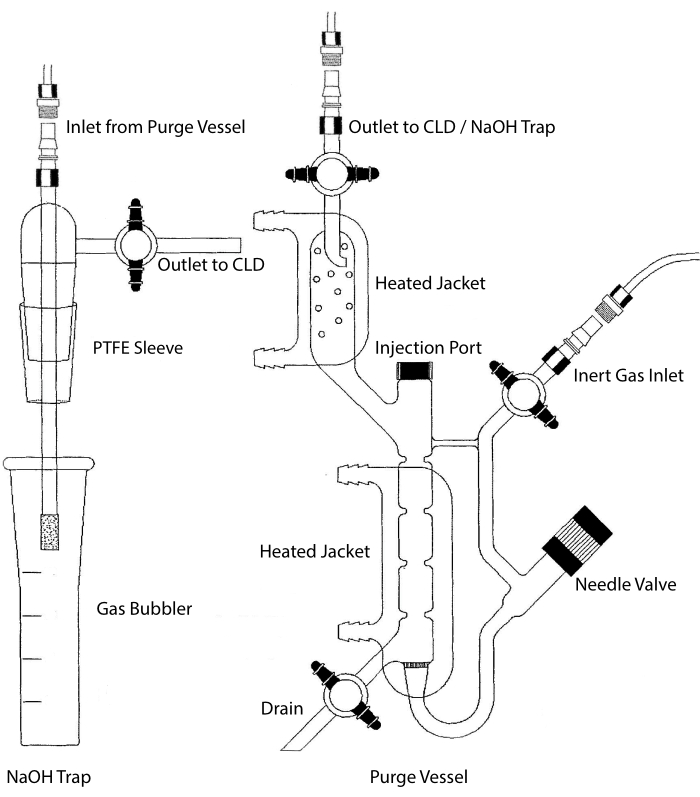
Şekil 2: Nitrik oksit gazının kemilüminesans bazlı tespiti için bir tahliye kabının yapısı Temizleme kabı (sağda), nitrik oksit (NO) gazının veya bir sıvı faz reaktifinden salındığında kolayca NO gazına dönüştürülebilen başka bir bileşiğin algılanmasına izin verir. İnert gaz girişi, Argon, Xeon veya diyatomik azot (N2) gibi inert bir gazın kaynağına (tankına) bağlanır. İğne valfi (sola açılır) boşaltma kabı içindeki basınç kontrolü için kullanılır ve kabı temizlemek için tamamen çıkarılabilir. Enjeksiyon portu, numune enjeksiyonu için membran septumlu bir kapakla kaplanmıştır. Membran sık sık değiştirilmelidir. Isıtmalı bir ceket reaksiyon odasını çevreler ve HCl testinde VCl3’ü gerçekleştirmek için bir sıcak su banyosuna bağlanır. Temizleme kabı çıkışı, kemilüminesans dedektörüne (CLD) veya NaOH tuzağına (HCl tahlillerinde VCl3 için gereklidir) bağlanır. Reaksiyon odası içeriğini boşaltmak için, önce inert gaz girişindeki ve boşaltma kabı çıkışındaki stopcock’ları kapatın, iğne valfini kapatın, enjeksiyon portundaki kapağı çıkarın ve son olarak tahliyede stopcock’u açın. HCl’nin aşındırıcılığı nedeniyle HCl tahlilindeki VCl3 gerçekleştirilirse, NaOH tuzağının (solda) temizleme kabı ile CLD arasına satır içi olarak yerleştirilmesi gerekir. CLD’ye bağlantı her zaman CLD ile boşaltma kabının çıkışı (veya kullanılıyorsa NaOH tuzağı) arasına yerleştirilecek yoğun alan dielektrik (IFD) filtresini gerektirir. IFD filtresi havadaki partikülleri uzaklaştırır ve sıvının tahliye kabından geçmesini durdurur. PTFE = politetrafloroetilen. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuç olarak, spesifik ve kontrollü bir kimyasal reaksiyon yoluyla NO’ya dönüştürülebilen herhangi bir bileşik, herhangi bir biyolojik sıvı ve doku homojenatında yüksek hassasiyetle tespit edilebilir24. Kemilüminesans yoluyla gaz fazı NO’nun doğrudan ölçümü hem deneysel hem de klinik ortamlarda gerçekleştirilir. Bu teknikler başka yerlerde kapsamlı bir şekilde tanımlanmıştır33,34,35. NO2-, S-nitrosothiols, S-nitrosated proteinler ve Fe-NO’ların ölçümü, tüm bu bileşiklerden stokiyometrik olarak NO gazını serbest bırakan triiyodür (I3–) ile bir reaksiyon karışımında numuneler eklenerek gerçekleştirilebilir:
I3– → I2 + I–
2NO 2− +2I− +4H+ → 2NO + I 2 +2H 2 O
I3− + 2RS-NO → 3I− + RSSR + 2NO+
2NO+ + 2I− → 2NO + I2
Ben3– NO 3-15 ile reaksiyona girmezken. Her bileşiğin hassas ölçümleri, numune alikotlarının merkürik klorürlü veya merkürik klorürsüz (HgCl2) asitlenmiş sülfanilamid (AS) ile ön işlemden geçirilmesiyle mümkün olur. Özellikle, AS ile ön işlem tüm NO2– içeriğini kaldırır. Sonuç olarak, CLD tarafından ölçülen NO içeriği yalnızca S-NO’ların ve Fe-NO’ların konsantrasyonunun toplamını yansıtır. AS enjeksiyonundan önce bir numune aliquot’a HgCl2’nin enjekte edilmesi, NO2– nin S-NO tarafından salınmasına neden olur. AS ile tedavi (NO2– çıkarılmasına yol açar), ölçülen NO içeriğinin sadece Fe-NO’ların konsantrasyonunu yansıtmasını sağlar. Değerlendirmeler arasındaki bir dizi çıkarma, üç NO türevinin kesin konsantrasyonunu hesaplamaya izin verir22.
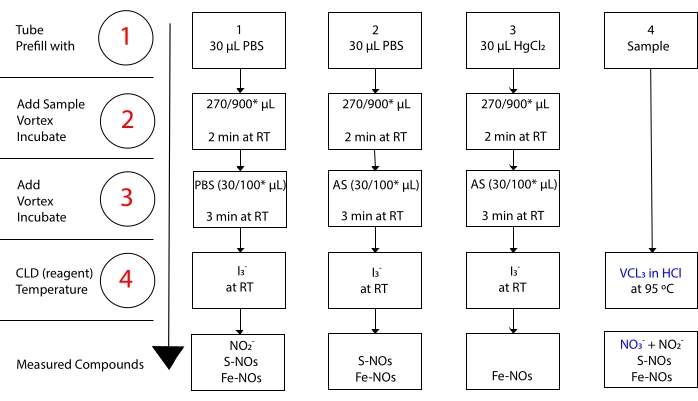
Şekil 3: Asetik asit kemilüminesans testinde I3– için numune hazırlama adımları. Asetik asit kemilüminesans testinde I3– hazırlanması için sıralı adımlar gösterilmiştir. Işık korumalı santrifüj tüplerinin kullanılması gereklidir. Tüp 1, 2 ve 3, tahlili hazırlamak için kullanılanlardır. Nitrat (NO3–) ölçümü gerekiyorsa, HCl testinde VCl3 için başka bir örnek aliquot (tüp 4) gereklidir. Adımlar kırmızı renkli sayılarla gösterilir. Numune hacmini eklemeden önce fosfat tampon salin (PBS) veya HgCl2 ile belirtildiği gibi önceden doldurma (Adım 1). Numune hacmini (2) belirtildiği gibi ekleyin, girdap yapın ve oda sıcaklığında (RT) 2 dakika kuluçkaya yatırın. (3) PBS veya asitlenmiş sülfanilamid (AS) belirtildiği gibi, vorteks ekleyin ve RT’de 3 dakika boyunca inkübe edin. Tahlil ile ölçülen konsantrasyon, her tüp altında bildirilen bileşiklerin konsantrasyonunun toplamıdır. 1 numaralı tüp, nitrit (NO2-), S-nitrosothiols (S-NO) ve demir-nitrosil komplekslerinin (Fe-NO’lar) tek bir sinyal olarak ölçülmesine izin verecektir. Nitrat (NO 3-) ölçümü için, numuneler hem asetik asitte I 3– hem de HCl tahlillerinde VCl 3 ile çalıştırılmalı ve tüp 1’den elde edilen değer, tüp 4’ten elde edilenden çıkarılmalıdır. *Kalıntı NO2-, S-nitrosohemoglobin ve demir-nitrosil-hemoglobinin belirlenmesi için Hb analizi için kullanılması önerilen miktarlar. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
NO 3- ölçümü için, hidroklorik asit (HCl) içindeki Vanadyum (III) klorür (VCl3), CLD ile NO 3- stokiyometrik olarak NO 3- ölçümü için temizleme kabında NO- 3– ‘ye dönüştürülmesi için kullanılır:
2 NO 3–+ 3V +3 + 2H 2 O →2NO+ 3VO2+ + 4H+
Yeterince hızlı bir dönüşüm elde etmek için, reaksiyonun 90-95 ° C’de yapılması gerekir. NO3’ten NO 2’ye indirgeme, HCl tarafından NO2’nin NO’ya indirgenmesi ile birleştirilir. Vanadyum metali ayrıca NO moiety22,36’larını serbest bırakan S-NO’ları azaltır. CLD tarafından HCl’de VCl 3 ile elde edilen nihai konsantrasyon, NO3–, NO2 ve diğer nitroslu bileşiklerin toplam konsantrasyonunu yansıtır. İkinci değerin I 3- ile CLD ile verilen konsantrasyondan çıkarılması, NO 3– konsantrasyon 36,37’nin hesaplanmasına izin verir (Şekil 3).
NO tüketim tahlilinde, (Z)-1-[2-(2-aminoetil)-N-(2-amonyoetil)amino]diazen-1-ium-1,2-diyol (DETA-NONOate) gibi NO donörleri tarafından temizleme kabında NO’nun sürekli salınması, enjekte edilen numunelerde hücresiz oksiHb’nin ölçülmesine izin veren kararlı bir sinyal üretir. Temizleme kabında tüketilen NO miktarı, numunedeki oksiHb miktarı ile stokiyometrik bir ilişki içindedir38.
Plazma örneklerinde NO2-, NO3-, S-nitrosothiols, demir-nitrosil kompleksleri ve hücresiz Hb ile NO tüketiminin ölçümü için protokoller gösterilmiştir. RBC ortamında NO ile ilgili çalışmalar, toplam Hb konsantrasyonu 15,22’nin belirlenmesi ile birlikte son derece kırılgan S-NO-Hb ve Hb-NO’yu ölçmek için dışlama kromatografisi ile birlikte spesifik numune muamelesi ve ardından dışlama kromatografisi gerektirir. Numune hazırlama, ölçümün düzeltilmesinde etkilidir. Tahlil sırasındaH2 O’da NO 2’ninönceden varlığı ve NO 2’nin salınması, S-NO-Hb 14,39 gibi yapay olarak daha yüksek konsantrasyonlarda NO türevlerinin ölçülmesine yol açabilir. Numune hazırlamanın önemli yönleri de sunulmaktadır.
Protocol
Representative Results
Discussion
Yüksek hassasiyet nedeniyle, NO ve ilgili bileşiklerin belirlenmesi için kemilüminesans bazlı testler yüksekNO2 kontaminasyon riskine sahiptir. Deneyde kullanılan her reaktif (özellikle NO 2- bloke edici çözelti) ve seyreltici (ddH 2 O dahil), arka plan sinyalini düzeltmek için NO2– içeriği açısından test edilmelidir. Nitrit, tam kanda yaklaşık 10 dakika yarı ömürlü bir yarı ömür ile son derece reaktiftir ve hızla…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu makalede bildirilen protokoller, Dr. Warren Zapol’un Massachusetts Genel Hastanesi Anestezi Bölümü Kritik Bakımda Anestezi Araştırma Laboratuvarı’nın önceki bursiyerlerinin birikmiş katkılarıyla mümkün olmuştur. Dr. Akito Nakagawa, Francesco Zadek, Emanuele Vassena, Chong Lei, Yasuko Nagasaka, Ester Spagnolli ve Emanuele Rezoagli’nin katkılarını takdir ediyoruz.
Materials
| Acetic Acid | Sigma | 45754 | 500 mL – liquid |
| Antifoam B Emulsion | Sigma | A5757 | 250 mL – liquid |
| DETA NONOate | Cayman | 82120 | 10 mg |
| Gibco DPBS (1x) no calcium, no magnesium | ThermoFisher | 14190144 | 500 mL |
| Hydroochloric Acid 37% (1 M) | Sigma | 258148 | 500 mL – liquid |
| Iodine | SAFC | 207772 | 100 g – solid |
| Kimwipes | Kimtech | 34155 | |
| Mercury (II) Chloride ACS reagent> 99.5% | Sigma | 215465 | 100 g – solid (dissolve in water) |
| Mili-Q Water Purification System | Millipore | ||
| Model 705 RN 50 μL syringe | Hamilton | 80530 | Microliter syringe |
| Model 802 N 25 μL Syringe | Hamilton | 84854 | Microliter syringe |
| N-ethylmaleimide | Sigma | 4260 | 25 g – crystalline |
| Nitric Oxide Analyzer + Bundle Software – Purge Vessel | Zysense | NOA 280i | Chemiluminescence Detector |
| Nonidet p-40 (NP-40) | ThermoFisher | 85125 | 10% – 500 mL |
| Potassium hexacyanoferrate (III) ACS reagent≥ 99% | Sigma | 244023 | 100 g – powder |
| Potassium Iodide ACS reagent> 99% | Sigma | 221945 | 100 g – solid |
| Potassium Nitrite cryst. For analysis EMSURE ACS | Supelco | 105067 | 250 g – crystalline |
| PowerGen 125 | Fisher Scientific | 14-359-251 | Mechanic Homogenizer |
| RV3 Two Stage Rotary Vane Pump | Edwards | A65201906 | Vacuum Pump – Bundled with analyzer |
| Sodium Heparin – BD Hemogard Clo | BD Biosciences | BD367871 | 75 USP Units |
| Sodium hydroxide anhydrous ACS reagent ≥ 97% | Sigma | 795429 | 1 kg – pelletts |
| Sodium Nitrate ACS reagent ≥ 99% | Sigma | 221341 | 500 g – powder |
| Sodium nitrite ≥ 99% | Sigma | S2252 | 500 g – crystalline |
| Sulfanilamide ≥ 98% | Sigma | S9251 | 100 g – solid |
| Vanadium (III) Chloride | Sigma | 112393 | 25 g – solid – Caution (exothermic) |
| Whatman 1 Filter Paper | Sigma | WHA10010155 |
References
- Palmer, R. M. J., Ferrige, A. G., Moncada, S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor. Nature. 327 (6122), 524-526 (1987).
- Furchgott, R. F. The discovery of endothelium-derived relaxing factor and its importance in the identification of nitric oxide. JAMA: The Journal of the American Medical Association. 276 (14), 1186 (1996).
- Ignarro, L. J., Buga, G. M., Byrns, R. E., Wood, K. S., Chaudhuri, G. Endothelium-derived relaxing factor and nitric oxide possess identical pharmacologic properties as relaxants of bovine arterial and venous smooth muscle. The Journal of Pharmacology and Experimental Therapeutics. 246 (1), 218-226 (1998).
- Arnold, W. P., Mittal, C. K., Katsuki, S., Murad, F. Nitric oxide activates guanylate cyclase and increases guanosine 3′:5′-cyclic monophosphate levels in various tissue preparations. Proceedings of the National Academy of Sciences of the United States of America. 74 (8), 3203-3207 (1977).
- Hayashida, K., et al. Depletion of vascular nitric oxide contributes to poor outcomes after cardiac arrest. American Journal of Respiratory and Critical Care Medicine. 199 (10), 1288-1290 (2019).
- Ignarro, L. J. Inhaled NO and COVID-19. British Journal of Pharmacology. 177 (16), 3848-3849 (2020).
- Gantner, B. N., LaFond, K. M., Bonini, M. G. Nitric oxide in cellular adaptation and disease. Redox Biology. 34, 101550 (2020).
- Clark, R. H., et al. Low-dose nitric oxide therapy for persistent pulmonary hypertension of the newborn. New England Journal of Medicine. 342 (7), 469-474 (2000).
- Goldbart, A., et al. Inhaled nitric oxide therapy in acute bronchiolitis: A multicenter randomized clinical trial. Scientific Reports. 10 (1), (2020).
- Bangirana, P., et al. Inhaled nitric oxide and cognition in pediatric severe malaria: A randomized double-blind placebo controlled trial. PloS One. 13 (1), 0191550 (2018).
- Jiang, S., Dandu, C., Geng, X. Clinical application of nitric oxide in ischemia and reperfusion injury: A literature review. Brain Circulation. 6 (4), 248-253 (2020).
- Lei, C., et al. Nitric oxide decreases acute kidney injury and stage 3 chronic kidney disease after cardiac surgery. American Journal of Respiratory and Critical Care Medicine. 198 (10), 1279-1287 (2018).
- Kelm, M. Nitric oxide metabolism and breakdown. Biochimica et Biophysica Acta. 1411 (2-3), 273-289 (1999).
- Bryan, N. S., Grisham, M. B. Methods to detect nitric oxide and its metabolites in biological samples. Free Radical Biology and Medicine. 43 (5), 645-657 (2007).
- Macarthur, P. H., Shiva, S., Gladwin, M. T. Measurement of circulating nitrite and S-nitrosothiols by reductive chemiluminescence. Journal of Chromatography B. 851 (1-2), 93-105 (2007).
- Helms, C., Kim-Shapiro, D. B. Hemoglobin-mediated nitric oxide signaling. Free Radical Biology and Medicine. 61, 464-472 (2013).
- Kim-Shapiro, D. B., Schechter, A. N., Gladwin, M. T. Unraveling the reactions of nitric oxide, nitrite, and hemoglobin in physiology and therapeutics. Arteriosclerosis, Thrombosis, and Vascular Biology. 26 (4), 697-705 (2006).
- Rezoagli, E., et al. Pulmonary and systemic vascular resistances after cardiopulmonary bypass: role of hemolysis. Journal of Cardiothoracic and Vascular Anesthesia. 31 (2), 505-515 (2017).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- Lundberg, J. O., Weitzberg, E., Gladwin, M. T. The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics. Nature Reviews Drug Discovery. 7 (2), 156-167 (2008).
- Heinrich, T. A., Da Silva, R. S., Miranda, K. M., Switzer, C. H., Wink, D. A., Fukuto, J. M. Biological nitric oxide signalling: chemistry and terminology. British Journal of Pharmacology. 169 (7), 1417-1429 (2013).
- Yang, B. K., Vivas, E. X., Reiter, C. D., Gladwin, M. T. Methodologies for the sensitive and specific measurement of s -nitrosothiols, iron-nitrosyls, and nitrite in biological samples. Free Radical Research. 37 (1), 1-10 (2003).
- Hayashida, K., et al. Improvement in outcomes after cardiac arrest and resuscitation by inhibition of s-nitrosoglutathione reductase. Circulation. 139 (6), 815-827 (2019).
- Rodríguez-Ortigosa, C. M., et al. Biliary secretion of S-nitrosoglutathione is involved in the hypercholeresis induced by ursodeoxycholic acid in the normal rat. Hepatology. 52 (2), 667-677 (2010).
- Mitchell, D. A., Marletta, M. A. Thioredoxin catalyzes the S-nitrosation of the caspase-3 active site cysteine. Nature Chemical Biology. 1 (3), 154-158 (2005).
- Mannick, J. B., et al. Fas-induced caspase denitrosylation. Science. 284 (5414), 651-654 (1999).
- Choi, Y. -. B., et al. Molecular basis of NMDA receptor-coupled ion channel modulation by S-nitrosylation. Nature Neuroscience. 3 (1), 15-21 (2000).
- Eu, J. P., Sun, J., Xu, L., Stamler, J. S., Meissner, G. The skeletal muscle calcium release channel: Coupled O2 sensor and NO signaling functions. Cell. 102 (4), 499-509 (2000).
- Stamler, J. S., et al. Nitric oxide circulates in mammalian plasma primarily as an S-nitroso adduct of serum albumin. Proceedings of the National Academy of Sciences of the United States of America. 89 (16), 7674-7677 (1992).
- Dunham, A. J., Barkley, R. M., Sievers, R. E. Aqueous nitrite ion determination by selective reduction and gas phase nitric oxide chemiluminescence. Analytical Chemistry. 67 (1), 220-224 (1995).
- Hogg, N., Zielonka, J., Kalyanaraman, B., Ignarro, L. J., Freeman, B. A. Detection of Nitric Oxide and Peroxynitrite in Biological Systems: A State-of-the-Art Review. Nitric Oxide (Third Edition). , 23-44 (2017).
- Gudem, M., Hazra, A. Mechanism of the chemiluminescent reaction between nitric oxide and ozone. The Journal of Physical Chemistry A. 123 (4), 715-722 (2019).
- Ishibe, Y., Liu, R., Hirosawa, J., Kawamura, K., Yamasaki, K., Saito, N. Exhaled nitric oxide level decreases after cardiopulmonary bypass in adult patients. Critical Care Medicine. 28 (12), 3823-3827 (2000).
- American Thoracic Society, European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, 2005. American Journal of Respiratory and Critical Care Medicine. 171 (8), 912-930 (2005).
- Cuthbertson, B. H., Stott, S. A., Webster, N. R. Exhaled nitric oxide as a marker of lung injury in coronary artery bypass surgery. British Journal of Anaesthesia. 89 (2), 247-250 (2002).
- Ewing, J. F., Janero, D. R. Specific S-nitrosothiol (thionitrite) quantification as solution nitrite after vanadium(III) reduction and ozone-chemiluminescent detection. Free Radical Biology and Medicine. 25 (4-5), 621-628 (1998).
- Braman, R. S., Hendrix, S. A. Nanogram nitrite and nitrate determination in environmental and biological materials by vanadium(III) reduction with chemiluminescence detection. Analytical Chemistry. 61 (24), 2715-2718 (1989).
- Wang, X., et al. Biological activity of nitric oxide in the plasmatic compartment. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11477-11482 (2004).
- Bryan, N. S., Rassaf, T., Rodriguez, J., Feelisch, M. Bound NO in human red blood cells: fact or artifact. Nitric Oxide. 10 (4), 221-228 (2004).
- Kida, K., Shirozu, K., Yu, B., Mandeville, J. B., Bloch, K. D., Ichinose, F. Beneficial effects of nitric oxide on outcomes after cardiac arrest and cardiopulmonary resuscitation in hypothermia-treated mice. Anesthesiology. 120 (4), 880-889 (2014).
- Gladwin, M. T., et al. S-Nitrosohemoglobin is unstable in the reductive erythrocyte environment and lacks O2/NO-linked allosteric function. The Journal of Biological Chemistry. 277 (31), 27818-27828 (2002).
- Feelisch, M., et al. and heme-nitros(yl)ation in biological tissues and fluids: implications for the fate of NO in vivo. The FASEB Journal. 16 (13), 1775-1785 (2002).
- Liu, T., et al. L-NAME releases nitric oxide and potentiates subsequent nitroglycerin-mediated vasodilation. Redox Biology. 26, 101238 (2019).
- Piknova, B., Park, J. W., Cassel, K. S., Gilliard, C. N., Schechter, A. N. Measuring nitrite and nitrate, metabolites in the nitric oxide pathway, in biological materials using the chemiluminescence method. Journal of Visualized Experiments: JoVE. (118), e54879 (2016).
- Keefer, L. K., Nims, R. W., Davies, K. M., Wink, D. A. 34;NONOates" (1-substituted diazen-1-ium-1,2-diolates) as nitric oxide donors: Convenient nitric oxide dosage forms. Methods in Enzymology. , 281-293 (1996).
- Nagababu, E., Rifkind, J. M. Measurement of plasma nitrite by chemiluminescence without interference of S-, N-nitroso and nitrated species. Free Radical Biology and Medicine. 42 (8), 1146-1154 (2007).
- Doctor, A., et al. Hemoglobin conformation couples erythrocyte S-nitrosothiol content to O2 gradients. Proceedings of the National Academy of Sciences of the United States of America. 102 (16), 5709-5714 (2005).
- Zhang, Y., Keszler, A., Broniowska, K. A., Hogg, N. Characterization and application of the biotin-switch assay for the identification of S-nitrosated proteins. Free Radical Biology and Medicine. 38 (7), 874-881 (2005).
- Davies, I. R., Zhang, X., Poole, R. K. Nitric Oxide Selective Electrodes. Methods in enzymology. , 63-95 (2008).
- Saito, J., et al. Comparison of fractional exhaled nitric oxide levels measured by different analyzers produced by different manufacturers. Journal of Asthma. 57 (11), 1216-1226 (2020).

