Использование анализатора метаболического потока клеток в реальном времени для мониторинга биоэнергетики остеобластов
Summary
Анализ метаболического потока клеток в режиме реального времени измеряет скорость потребления кислорода и скорость внеклеточного подкисления, что соответствует производству митохондриальных и гликолитических аденозинтрифосфатов с использованием датчиков pH и кислорода. Рукопись объясняет метод понимания энергетического статуса остеобластов, а также характеристику и интерпретацию клеточного биоэнергетического статуса.
Abstract
Формирование кости остеобластами является важным процессом для правильного приобретения кости и оборота кости для поддержания скелетного гомеостаза и, в конечном счете, предотвращения перелома. В интересах оптимизации пиковой костной массы и борьбы с различными заболеваниями опорно-двигательного аппарата (например, постменопаузальным остеопорозом, нервной анорексией, сахарным диабетом 1 и 2 типа) в области костной биологии были предприняты невероятные усилия для полной характеристики остеобластов на протяжении всего процесса их дифференцировки. Учитывая основную роль зрелых остеобластов в секреции матричных белков и минерализующих везикул, было отмечено, что эти процессы забирают невероятное количество клеточной энергии, или аденозинтрифосфата (АТФ). Общий клеточный энергетический статус часто называют клеточной биоэнергетикой, и он включает в себя ряд метаболических реакций, которые ощущают доступность субстрата для получения АТФ для удовлетворения клеточных потребностей. Таким образом, текущий метод детализирует процесс выделения первичных стромальных клеток мыщеричного мозга (BMSCs) и мониторинга их биоэнергетического статуса с использованием анализатора метаболического потока клеток в реальном времени на различных стадиях дифференцировки остеобластов. Важно отметить, что эти данные продемонстрировали, что метаболический профиль резко меняется на протяжении всей дифференциации остеобластов. Таким образом, использование этого физиологически значимого типа клеток необходимо для полного понимания того, как биоэнергетический статус клетки может регулировать общую функцию.
Introduction
Образование кости остеобластом сопровождается скоординированным разрушением или рассасыванием костей остеокластами. Баланс между остеобластным формированием кости и резорбцией остеокластов представляет собой связанный процесс, описывающий оборот или ремоделирование кости, который необходим для скелетного гомеостаза. Дисфункция остеобластов приводит к нарушению костеобразования и приводит к различным заболеваниям, в том числеостеопорозу 1,2,3. Дифференцировка стромальных стволовых клеток костного мозга (BMSCs) ex vivo/in vitro к предшественникам остеобластов и зрелым остеобластам приводит к образованию и отложению минерализованного костного матрикса в культуральном сосуде с течением времени 4,5,6. Это костное образование остеобластом требует значительного количества клеточной энергии. В частности, было показано, что синтез и секреция коллагена в значительной степени зависят от клеточных соотношений АТФ: АДФ, и, по-видимому, минерализованный пузырчатый трафик и секреция требуют дополнительного АТФ 7,8,9,10,11. Многие исследователи продемонстрировали, что процесс остеобластогенеза и функции остеобластов требует адекватного запаса энергии для удовлетворения метаболической потребности в формировании костей 12,13,14,15,16. Поэтому целью данного метода является характеристика биоэнергетического статуса первичных, мышиных стромальных клеток на протяжении дифференцировки остеобластов с помощью анализатора метаболического потока клеток реального времени. Эти методы помогают в развитии лучшего понимания скелетного гомеостаза, что в конечном итоге может привести к разработке новых терапевтических вариантов, способных улучшить скелетные расстройства.
Анализатор метаболического потока клеток в реальном времени может быть использован для измерения скорости потребления кислорода (OCR) и скорости внеклеточного подкисления (ECAR) живых остеобластов, что соответствует митохондриальной и гликолитической продукции АТФ соответственно. Основополагающим для этой методологии является тот факт, что один ион H+ на лактат высвобождается во время гликолиза при превращении глюкозы в лактат, что изменяет рН среды, отраженный в значениях ECAR. И наоборот, во время цикла TCA (трикарбоновой кислоты) окислительное фосфорилирование через митохондрии производит CO2 путем использования или потребления кислорода, и поэтому мониторинг OCR отражает этот метаболический процесс. Анализатор измеряет как OCR, так и ECAR во внеклеточной микросреде одновременно и в режиме реального времени, что позволяет использовать огромный потенциал при изучении клеточной биоэнергетики 6,17. Кроме того, выполнение этих анализов относительно просто и легко настраивается в зависимости от экспериментальной цели. Аналогичные методы были использованы для дальнейшего понимания метаболической регуляции Т-клеток иммунной системы18,19, инициации рака и прогрессирования20, наряду с несколькими другими типами клеток, способствующими метаболическим синдромам21,22.
Преимущества анализатора метаболических потоков в реальном времени перед альтернативными методами включают (1) возможность измерения клеточной биоэнергетики живых клеток в режиме реального времени, (2) способность выполнять анализ с относительно небольшим количеством клеток (требуется всего 5000 клеток), (3) инъекционные порты для параллельного манипулирования несколькими обработками в высокопроизводительной 96-луночной системе, (4) использование автоматического тепловизора без радиоактивных меток для нормализации18, 23,24. Следующие методы направлены на обобщенное, но подробное описание мониторинга клеточной биоэнергетики в мышиных BMSC на протяжении дифференцировки остеобластов с помощью анализатора. Он будет включать в себя регулярно выполняемые анализы; однако, как и во многих техниках и методах, настоятельно рекомендуется, чтобы отдельные лаборатории определяли конкретные детали для своих экспериментов.
Выбор анализов и различные типы анализов доступны: Доступно большое разнообразие наборов для анализа и реагентов для изучения биоэнергетики клеток, обеспечивая при этом надежность и согласованность экспериментальных результатов. Кроме того, настольное программное обеспечение также предлагает шаблоны анализа, которые можно легко настроить. Анализ может быть определен на основе потребностей пользователя в измерении различных метаболических параметров. Эти анализы могут быть модифицированы различными способами на основе экспериментальной цели и/или научного вопроса. Например, с четырьмя инъекционными портами несколько соединений могут быть введены в пробирную среду для анализа клеточного ответа, специфичного для каждого метаболического пути.
Тест фенотипа клеточной энергии: Этот анализ измеряет метаболический фенотип живых клеток и метаболический потенциал. Этот анализ также рекомендуется в качестве первого шага для получения обобщенного представления о метаболизме, специфичном для пути. Смесь олигомицина А-ингибитора АТФ-синтазы и карбонилцианида 4-(трифторметокси)фенилгидразона (FCCP)-митохондриального разъединяющего агента вводят для понимания энергетического потенциала клетки. Инъекция олигомицина А ингибирует синтез АТФ, что приводит к увеличению скорости гликолиза (ЭКАР), чтобы позволить клеткам удовлетворить свои энергетические потребности; с другой стороны, инъекция FCCP приводит к более высокому OCR из-за деполяризации митохондриальной мембраны. По сути, этот анализ изображает базальное метаболическое дыхание и после двойных инъекций, толчков или стрессов метаболическую реакцию. Основываясь на этих параметрах, программное обеспечение затем строит ГРАФИК OCR и ECAR клеток, классифицируя клетки как аэробное, покоящееся, гликолитическое или энергетическое состояние с течением времени25,26.
Анализ скорости производства АТФ в режиме реального времени: Это измеряет выработку клеточной АТФ одновременно от гликолиза и митохондриального дыхания. Этот анализ количественно измеряет метаболические сдвиги от двух энергетических путей и предоставляет данные о скорости производства митохондриальной и гликолитической АТФ с течением времени. Анализ получает базальные данные OCR и ECAR с последующим расчетом скорости производства митохондриальной АТФ путем инъекции олигомицина А и гликолитической скорости производства АТФ путем инъекции смеси ротенона + антимицина А (полное ингибирование митохондриальной функции), что приводит к митохондриальному подкислению17,27.
Клеточный митохондриальный стресс-тест (или клеточный мито-стресс-тест): Он измеряет митохондриальную функцию через АТФ-связанное дыхание, количественно оценивает клеточную биоэнергетику, идентифицирует митохондриальную дисфункцию и измеряет реакцию клеток на стресс. Различные параметры, включая базальную и запасную дыхательную способность, АТФ-связанное дыхание, максимальное дыхание и немитохондриальное потребление кислорода, могут быть получены в одном анализе. Этот анализ включает последовательные инъекции олигомицина А, FCCP (митохондриального разъединяющего агента), смеси ингибиторов ротенона/ антимицина А для эффективного анализа их влияния на митохондриальную функцию28.
Тест на гибкость топлива: Это измеряет скорость митохондриального дыхания путем окисления трех основных митохондриальных топлив присутствием и отсутствием их ингибиторов. Последовательное ингибирование глюкозы, глутамина и жирных кислот помогает измерить зависимость, емкость и гибкость клеток, а также зависимость клеток в различных клеточных путях для удовлетворения потребности в энергии. Когда митохондрии не могут удовлетворить требования заблокированного пути, представляющего интерес, путем окисления других видов топлива, клетки входят в состояние зависимости. Емкость клеток рассчитывается путем ингибирования двух других альтернативных путей с последующим ингибированием интересующего пути. Гибкость клеток помогает понять способность митохондрий компенсировать и удовлетворять потребности в топливе ингибированного пути. Он рассчитывается путем вычитания зависимости ячеек из емкости ячеек. Три различных ингибитора используются независимо или в виде смеси двух для эффективного расчета параметров анализа. 2-циан-3-(1-фенил-1Н-индол-3-ил)-2-пропеновая кислота (UK5099) ингибирует окисление глюкозы, блокируя пируват-носитель в гликолизе. Бис-2-(5-фенилацетамидо-1,3,4-тиадиазол-2-ил) (BPTES) этилсульфид ингибирует путь окисления глутамина, а этомоксир ингибирует окисление длинноцепочечных жирных кислот29.
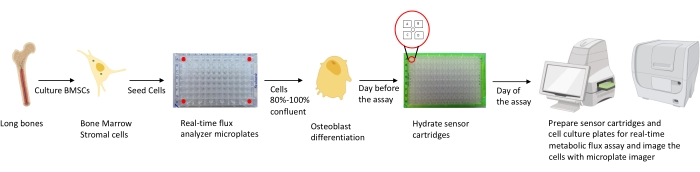
Рисунок 1: Схематическое представление методологии культивирования и подготовки остеобластов к анализу. Мышиные BMSC выделяют из длинных костей, культивируют и засеивают в 96-луночные пластины с плотностью 25 000 клеток на лунку. Культивирование этих клеток в специфических средах остеобластов начинается, когда они достигают 80%-100% конфлюзии, чтобы начать их дифференцировку. Анализы выполняются на разных этапах дифференцировки. Картриджные пластины гидратируются за один день до анализа. В день анализа различные ингибиторы вводятся в порты картриджей датчиков в зависимости от требований анализа, а к калибровочной пластине на 96 скважин добавляется калибровочный буфер. После калибровки выполняется анализ метаболического потока клеток в реальном времени, после чего выполняется визуализация микропластины клеточной культуры с использованием микропластичного тепловизора для нормализации данных анализатора метаболического потока клеток в реальном времени с количеством клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Анализатор метаболического потока клеток в реальном времени может быть использован для изучения клеточной энергетики в различных условиях. Протокол иллюстрирует эффективную изоляцию BMSC, культивирование клеток в соответствующих пластинах клеточной культуры и их дифференцировку в з?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержана грантом Национального института здравоохранения (NIH), Национальным институтом артрита и заболеваний опорно-двигательного аппарата и кожных заболеваний (NIAMS) AR072123 и грантом Национального института по проблемам старения (NIA) AG069795 (для ERR).
Materials
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma – Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma – Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma – Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma – Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma – Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma – Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma – Aldrich | O3008 | |
| Oligomycin A – 5 mg | Sigma – Aldrich | 75351 | |
| Rotenone | Sigma – Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies – BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
References
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073 (2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. . Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1 (2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918 (2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081 (2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511 (2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- . What are the advantages of using Seahorse XF technology Available from: https://wwwagilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018)
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- . XF cell energy phenotype test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021)
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, 285-293 (2018).
- . XF ATP rate assay Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021)
- . XF cell mito stress test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021)
- . XF cell mito fuel flex test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021)
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750 (2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004 (2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. . Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).

