Usando o analisador de fluxo metabólico de células em tempo real para monitorar bioenergetics osteoblast
Summary
O ensaio de fluxo metabólico celular em tempo real mede a taxa de consumo de oxigênio e a taxa de acidificação extracelular, que corresponde à produção de triptosfato de adenosina mitocondrial e glicolítico, usando sensores de pH e oxigênio. O manuscrito explica um método para compreender o estado energético dos osteoblastos e a caracterização e interpretação do estado bioenergéstico celular.
Abstract
A formação óssea por osteoblastos é um processo essencial para a aquisição óssea adequada e a rotatividade óssea para manter a homeostase esquelética e, finalmente, prevenir a fratura. No interesse de otimizar o pico de massa óssea e combater várias doenças musculoesquelletas (ou seja, osteoporose pós-menopausa, anorexia nervosa, diabetes mellitus tipo 1 e 2), esforços incríveis têm sido feitos no campo da biologia óssea para caracterizar totalmente os osteoblastos durante seu processo de diferenciação. Dado o papel primário dos osteoblastos maduros para segregar proteínas matriciais e vesículas de mineralização, observou-se que esses processos tomam uma quantidade incrível de energia celular, ou triptosfato de adenosina (ATP). O status geral de energia celular é frequentemente referido como bioenergéstico celular, e inclui uma série de reações metabólicas que sentem a disponibilidade de substrato para derivar ATP para atender às necessidades celulares. Portanto, o método atual detalha o processo de isolação das células estrômicas primárias de medula óssea murina (BMSCs) e o monitoramento de seu status bioenergénico utilizando o analisador de fluxo metabólico de células reais em vários estágios na diferenciação do osteoblasto. É importante ressaltar que esses dados demonstraram que o perfil metabólico muda drasticamente ao longo da diferenciação do osteoblasto. Assim, o uso desse tipo de célula fisiologicamente relevante é necessário para apreciar plenamente como o status bioenergértico de uma célula pode regular a função geral.
Introduction
A formação do osso pelo osteoblasto é acompanhada de destruição coordenada ou resorção dos ossos por osteoclastos. O equilíbrio entre a formação óssea osteoblástica e a resorção do osteoclato é um processo acoplado que descreve a rotatividade óssea ou a remodelação, essencial para a homeostase esquelética. A disfunção do osteoblasto leva à formação óssea prejudicada e resulta em várias doenças, incluindo a osteoporose 1,2,3. A diferenciação ex vivo/in vitro de células-tronco estrômicas de medula óssea (BMSCs) aos precursores do osteoblasto e osteoblastos maduros resulta na formação e deposição da matriz óssea mineralizada no vaso cultural ao longo do tempo 4,5,6. Esta formação óssea pelo osteoblasto requer uma quantidade significativa de energia celular. Especificamente, a síntese e secreção de colágeno têm se mostrado fortemente dependentes de ATP celular: as proporções de ADP e, presumivelmente, o tráfico e a secreção mineralizados requerem ATP 7,8,9,10,11 adicionais. Muitos pesquisadores demonstraram que o processo de osteoblastogênese e função osteoblastogista requer um fornecimento adequado de energia para atender à demanda metabólica de formaçãoóssea 12,13,14,15,16. Portanto, o objetivo deste método é caracterizar o estado bioenergéstico das células primárias e estrômicas murinas ao longo da diferenciação do osteoblasto utilizando o analisador de fluxo metabólico celular em tempo real. Essas técnicas auxiliam no desenvolvimento de uma melhor compreensão da homeostase esquelética, o que pode, em última análise, levar ao desenvolvimento de novas opções terapêuticas capazes de melhorar os transtornos esqueléticos.
O analisador de fluxo metabólico celular em tempo real pode ser usado para medir a taxa de consumo de oxigênio (OCR) e a taxa de acidificação extracelular (ECAR) de osteoblastos vivos, o que corresponde à produção de ATP mitocondrial e glicolítico, respectivamente. Fundamental para essa metodologia é o fato de que um íon H+ por lactato é lançado durante a glicolise na conversão de glicose em lactato, o que altera o pH da mídia refletido nos valores ECAR. Por outro lado, durante o ciclo TCA (ácido tricarboxílico), a fosforilação oxidativa através das mitocôndrias produz CO2 utilizando ou consumindo oxigênio, e, portanto, o monitoramento de OCR é reflexo desse processo metabólico. O analisador mede tanto o OCR quanto o ECAR no microambiente extracelular simultaneamente e em tempo real, o que permite um enorme potencial ao estudar bioenergeticscelulares 6,17. Além disso, a realização desses ensaios é relativamente simples e facilmente personalizável dependendo do objetivo experimental. Técnicas semelhantes têm sido empregadas para entender melhor a regulação metabólica t-célula do sistema imunológico18,19, iniciação do câncer e progressão20, juntamente com vários outros tipos de células contribuindo para síndromes metabólicas21,22.
As vantagens do analisador de fluxo metabólico em tempo real sobre técnicas alternativas incluem (1) a capacidade de medir bioenergésicos celulares de células vivas em tempo real, (2) capacidade de realizar ensaios com um número relativamente pequeno de células (requer até 5.000 células), (3) portas de injeção para manipular paralelamente múltiplos tratamentos em um sistema de alta produtividade de 96 poços, (4) uso de imagens celulares automatizadas sem rótulo radioativo para normalização18, 23,24. Os seguintes métodos visam fornecer uma descrição generalizada, mas detalhada, do monitoramento de bioenergésticos celulares em BMSCs murinas durante a diferenciação do osteoblasto usando o analisador. Incluirá ensaios realizados rotineiramente; no entanto, como acontece com muitas técnicas e métodos, é altamente encorajado que laboratórios individuais determinem detalhes específicos para seus experimentos.
Seleção de ensaios e diferentes tipos de ensaios disponíveis: Uma grande variedade de kits de ensaio e reagentes estão disponíveis para estudar os bioenergésticos das células, garantindo a confiabilidade e consistência dos resultados experimentais. Além disso, o software de desktop também oferece modelos de ensaio que podem ser facilmente personalizados. O ensaio pode ser definido com base nas necessidades do usuário de medir diferentes parâmetros metabólicos. Esses ensaios podem ser modificados de várias maneiras com base no objetivo experimental e/ou na questão científica. Por exemplo, com quatro portas de injeção, vários compostos podem ser injetados na mídia de ensaio para analisar a resposta celular específica a cada via metabólica.
Teste de fenótipo de energia celular: Este ensaio mede o fenótipo metabólico das células vivas e o potencial metabólico. Este ensaio também é recomendado como o primeiro passo para obter uma ideia generalizada de metabolismo específico da via. Uma mistura de oligomicina A-an inibidora de atp synthase e cianeto carbonil 4-(trifluorometoxy) fenilhydrazone (FCCP)-um agente mitocondrial de desacoplamento é injetada para entender o potencial energético celular. A injeção de oligomicina A inibe a síntese de ATP, resultando em um aumento na taxa de glicolise (ECAR) para permitir que as células atendam às suas demandas energéticas; por outro lado, a injeção de FCCP resulta em maior OCR devido à despolarização da membrana mitocondrial. Essencialmente, este ensaio retrata a respiração metabólica basal, e seguindo as injeções duplas, empurra ou estressa, a resposta metabólica. Com base nesses parâmetros, o software então traça OCR e ECAR das células classificando as células como estado aeróbico, quiescente, glicolítico ou energético ao longo do tempo25,26.
Ensaio da taxa de produção em tempo real da ATP: Isso mede a produção de ATP celular simultaneamente a partir da glicolise e da respiração mitocondrial. Este ensaio mede quantitativamente as mudanças metabólicas das duas vias energéticas e fornece dados sobre as taxas de produção atpicondrial e glicolítico atp ao longo do tempo. O ensaio obtém dados basais de OCR e ECAR seguidos pelo cálculo da taxa de produção de ATP mitocondrial através da injeção de oligomicina A e taxa de produção de ATP glicolítico através da injeção de rotenona + mistura de antimicina A (inibição total da função mitocondrial), resultando na acidificação mitocondrial17,27.
Teste de estresse das mitocôndrias celulares (ou teste de estresse mito celular): Isso mede a função mitocondrial através da respiração ligada à ATP, quantifica a bioenergetic celular, identifica a disfunção mitocondrial e mede a resposta das células ao estresse. Vários parâmetros, incluindo capacidade respiratória basal e sobressal, respiração ligada a ATP, respiração máxima e consumo de oxigênio não mitocondrial, podem ser obtidos em um ensaio. Este ensaio envolve injeções sequenciais de oligomicina A, FCCP (agente de desacoplamento mitocondrial), uma mistura de inibidores de rotenona/antimicina A para analisar eficientemente o efeito destes na função mitocondrial28.
Teste de flexibilidade mito combustível flex: Isso mede a taxa de respiração mitocondrial pela oxidação dos três combustíveis mitocondriais primários pela presença e ausência de seus inibidores. A inibição sequencial de glicose, glutamina e ácidos graxos auxilia na medição da dependência, capacidade e flexibilidade das células e da dependência das células em várias vias celulares para atender à demanda energética. Quando as mitocôndrias não conseguem atender às demandas do caminho bloqueado de interesse oxidando outros combustíveis, as células entram em um estado de dependência. A capacidade das células é calculada pela inibição das outras duas vias alternativas seguidas pela inibição da via de interesse. A flexibilidade das células ajuda a entender a capacidade das mitocôndrias de compensar e atender às necessidades de combustível da via inibida. É calculado subtraindo a dependência das células da capacidade das células. Três inibidores diferentes são usados independentemente ou como uma mistura de dois para calcular efetivamente os parâmetros de ensaio. 2-ciano-3-(1-fenil-1H-indol-3-yl)-2-ácido propenóico (UK5099) inibe a oxidação da glicose bloqueando o portador de piruvato em glicólise. Bis-2-(5-fenillacetamido-1,3,4-thiadiazol-2-yl) (BPTES) sulfeto etílico inibe a via de oxidação da glutamina, e o etomoxir inibe a oxidação de ácidos graxos de cadeia longa29.
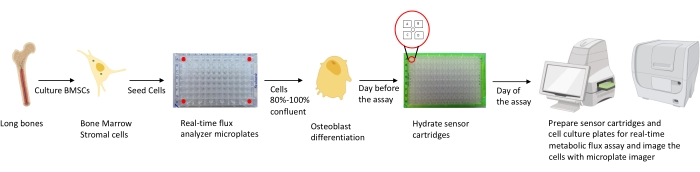
Figura 1: Representação esquemática da metodologia de cultivo e preparação de osteoblastos para análise. Os BMSCs murinos são isolados de ossos longos, cultivados e semeados em placas de 96 poços a 25.000 células/densidade de poços. A culização dessas células em mídia específica do Osteoblast é iniciada quando elas atingem 80%-100% de confluência para iniciar sua diferenciação. Os ensaios são realizados em diferentes estágios de diferenciação. As placas do cartucho estão hidratadas um dia antes do ensaio. No dia do ensaio, diferentes inibidores são injetados nas portas dos cartuchos do sensor com base nos requisitos do ensaio, e um buffer de calibração é adicionado à placa de calibração de 96 poços. Após a calibração, é realizado o ensaio de fluxo metabólico de células em tempo real, seguido por imagens da microplacão da cultura celular usando o imager microplalá para normalizar os dados do analisador de fluxo metabólico celular em tempo real com a contagem celular. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
O analisador de fluxo metabólico celular em tempo real pode ser usado para explorar energias celulares em diferentes condições. O protocolo ilustra o isolamento eficiente dos BMSCs, a cultura de células em placas de cultura celular apropriadas e sua diferenciação com os osteoblastos maduros, que podem ser usados para vários ensaios usando o analisador de fluxo extracelular. Além disso, as etapas críticas do ensaio de fluxo metabólico celular em tempo real, incluindo hidratação de cartuchos de sensores, carreg…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi apoiado pelo Instituto Nacional de Saúde (NIH) Instituto Nacional de Artrite e Doenças Musculoesqueléticos e de Pele (NIAMS) Grant AR072123 e Instituto Nacional de Envelhecimento (NIA) Grant AG069795 (para ERR).
Materials
| 0.25% Trypsin EDTA | Sigma-Aldrich | T4049 | |
| 2-cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid | Sigma – Aldrich | PZ0160 | UK5099 |
| Antimycin A | Sigma – Aldrich | A8674 | |
| Ascorbic acid | Sigma-Aldrich | A4544-100G | |
| Bis-2-(5-phenylacetamido-1,3,4-thiadiazol-2-yl)ethyl sulfide | Sigma – Aldrich | SML0601 | BPTES |
| Carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone | Sigma – Aldrich | C2920 | FCCP |
| Cytation 5 imaging reader | BioTek | N/A | Microplate imager |
| Etomoxir sodium salt hydrate | Sigma – Aldrich | E1905 | |
| Hoechst 33342 Solution (20 mM) | Thermo Scientific | 62249 | |
| Insulin | Sigma – Aldrich | I6634 | |
| Oleic Acid-Albumin from bovine serum | Sigma – Aldrich | O3008 | |
| Oligomycin A – 5 mg | Sigma – Aldrich | 75351 | |
| Rotenone | Sigma – Aldrich | R8875-1G | |
| Seahorse XF 1.0 M Glucose Solution | Agilent Technologies | 103577-100 | |
| Seahorse XF 100mM Pyruvate Solution | Agilent Technologies | 103578-100 | |
| Seahorse XF 200mM Glutamine solution | Agilent Technologies | 103579-100 | |
| Seahorse XF DMEM media | Agilent Technologies | 103575-100 | DMEM assay media eith 5mM HEPES, pH 7.4, without phenol red, sodium bicarbonate, glucose, pyruvate, and L-glutamine |
| Seahorse XFe96 Analyzer | Agilent Technologies | S7800B | Real- Time Metabolic flux analyzer |
| Seahorse XFe96 FluxPak | Agilent Technologies | 102416-100 | Includes XFe96 Sensor cartridges, Cell culture microplates, and Seahorse XF Calibrant solution |
| The Cell imaging 1.1.0.11 software | Agilent Technologies – BioTek | ||
| Wave software 2.6.1 | Agilent Technologies | ||
| β-glycerol phosphate | Sigma-Aldrich | G9422-50G |
References
- Rodan, G. A. Bone homeostasis. Proceedings of the National Academy of Sciences of the United States of America. 95 (23), 13361-13362 (1998).
- Nakahama, K. I. Cellular communications in bone homeostasis and repair. Cellular and Molecular Life Sciences. 67 (23), 4001-4009 (2010).
- Kim, J. M., Lin, C., Stavre, Z., Greenblatt, M. B., Shim, J. H. Osteoblast-osteoclast communication and bone homeostasis. Cells. 9 (9), 2073 (2020).
- Gao, J., et al. SIRT3/SOD2 maintains osteoblast differentiation and bone formation by regulating mitochondrial stress. Cell Death and Differentiation. 25 (2), 229-240 (2018).
- Baron, R. Molecular mechanisms of bone resorption by the osteoclast. The Anatomical Record. 224 (2), 317-324 (1989).
- Tian, L., Rosen, C. J., Guntur, A. R. Mitochondrial Function and Metabolism of Cultured Skeletal Cells. Methods in Molecular Biology. 2230, 437-447 (2021).
- Zanotelli, M. R., et al. Regulation of ATP utilization during metastatic cell migration by collagen architecture. Molecular Biology of the Cell. 29 (1), 1-9 (2018).
- Gonzales, S., Wang, C., Levene, H., Cheung, H. S., Huang, C. Y. C. ATP promotes extracellular matrix biosynthesis of intervertebral disc cells. Cell and Tissue Research. 359 (2), 635-642 (2015).
- Kruse, N. J., Bornstein, P. The metabolic requirements for transcellular movement and secretion of collagen. Journal of Biological Chemistry. 250 (13), 4841-4847 (1975).
- Rendina-Ruedy, E., Guntur, A. R., Rosen, C. J. Intracellular lipid droplets support osteoblast function. Adipocyte. 6 (3), 250-258 (2017).
- Sinnott-Armstrong, N., et al. A regulatory variant at 3q21.1 confers an increased pleiotropic risk for hyperglycemia and altered bone mineral density. Cell Metabolism. 33 (3), 615-628 (2021).
- Esen, E., Lee, S. Y., Wice, B. M., Long, F. PTH promotes bone anabolism by stimulating aerobic glycolysis via IGF signaling. Journal of Bone and Mineral Research. 30 (11), 1959-1968 (2015).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: I. Normal bone. Journal of Biological Chemistry. 235, 1206-1210 (1960).
- Borle, A. B., Nichols, N., Nichols, G. Metabolic studies of bone in vitro: II. The metabolic patterns of accretion and resorption. Journal of Biological Chemistry. 235, 1211-1214 (1960).
- Adamek, G., Felix, R., Guenther, H. L., Fleisch, H. Fatty acid oxidation in bone tissue and bone cells in culture. Characterization and hormonal influences. The Biochemical Journal. 248 (1), 129-137 (1987).
- Frey, J. L., et al. Wnt-Lrp5 signaling regulates fatty acid metabolism in the osteoblast. Molecular and Cellular Biology. 35 (11), 1979-1991 (2015).
- Romero, N., Rogers, G., Neilson, A., Dranka, B. P. . Quantifying cellular ATP production rate using agilent seahorse XF technology. , (2018).
- vander Windt, G., Chang, C., Pearce, E. Measuring bioenergetics in T cells using a Seahorse Extracellular Flux Analyzer. Current Protocols in Immunology. 113, 1 (2016).
- Traba, J., Miozzo, P., Akkaya, B., Pierce, S. K., Akkaya, M. An optimized protocol to analyze glycolysis and mitochondrial respiration in lymphocytes. Journal of Visualized Experiments:JoVE. (117), e54918 (2016).
- Noel, P., et al. Preparation and metabolic assay of 3-dimensional spheroid co-cultures of pancreatic cancer cells and fibroblasts. Journal of Visualized Experiments:JoVE. (126), e56081 (2017).
- Nicholls, D., et al. Bioenergetic profile experiment using C2C12 myoblast cells. Journal of Visualized Experiments: JoVE. (46), e2511 (2010).
- Sakamuri, S. S. V. P., et al. Measurement of respiratory function in isolated cardiac mitochondria using Seahorse XFe24 Analyzer: applications for aging research. GeroScience. 40 (3), 347-356 (2018).
- . What are the advantages of using Seahorse XF technology Available from: https://wwwagilent.com/en/support/cell-analysis/advantages-of-using-xf-tech (2018)
- Horan, M. P., Pichaud, N., Ballard, J. W. O. Review: Quantifying mitochondrial dysfunction in complex diseases of aging. Journals of Gerontology – Series A Biological Sciences and Medical Sciences. 67 (10), 1022-1035 (2012).
- . XF cell energy phenotype test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740884 (2021)
- Leung, D. T. H., Chu, S. Measurement of oxidative stress: Mitochondrial function using the seahorse system. Methods in Molecular Biology. 1710, 285-293 (2018).
- . XF ATP rate assay Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740889 (2021)
- . XF cell mito stress test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740885 (2021)
- . XF cell mito fuel flex test Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-assay-kits-reagents-cell-assay-media/seahorse-xf-cell-energy-phenotype-test-kit-740888 (2021)
- Maridas, D. E., Rendina-Ruedy, E., Le, P. T., Rosen, C. J. Isolation, culture, and differentiation of bone marrow stromal cells and osteoclast progenitors from mice. Journal of Visualized Experiments: JoVE. (131), e56750 (2018).
- Wei, J., et al. Glucose uptake and Runx2 synergize to orchestrate osteoblast differentiation and bone formation. Cell. 161 (7), 1576-1591 (2015).
- Zoch, M. L., Abou, D. S., Clemens, T. L., Thorek, D. L. J., Riddle, R. C. In vivo radiometric analysis of glucose uptake and distribution in mouse bone. Bone Research. 4, 16004 (2016).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Kam, Y., Jastromb, N., Clayton, J., Held, P., Dranka, B. . Normalization of agilent seahorse XF data by in-situ cell counting using a BioTek cytation 5 application note. , (2017).

