ביטוי חיידקי וטיהור של מטריקס אנושי Metalloproteinase-3 באמצעות כרומטוגרפיה זיקה
Summary
טיהור התג שלו, דיאליזה, והפעלה מועסקים כדי להגדיל את התשואות של מסיס, מטריצה פעילה metalloproteinase-3 ביטוי חלבון תחום קטליטי בחיידקים. שברי חלבון מנותחים באמצעות ג’ל SDS-PAGE.
Abstract
מטריצה metalloproteinases (MMPs) שייכים למשפחה של פרוטאזים מצינזין עם תפקידים מרכזיים מטריצה חוץ תאית (ECM) השפלה ושיפוץ, כמו גם אינטראקציות עם מספר גורמי גדילה וציטוקינים. ביטוי יתר של MMPs ספציפיים אחראי במספר מחלות כגון סרטן, מחלות ניווניות ומחלות לב וכלי דם. MMPs היו מרכז תשומת הלב לאחרונה כמטרות לפתח טיפולית שיכולה לטפל במחלות בקורלציה MMP overexpression.
כדי ללמוד את מנגנון ה- MMP בפתרון, נדרשות שיטות ביטוי וטיהור חלבונים רקומביננטיות מקלות וחזקות יותר לייצור MMPs פעילים ומסיסים יותר. עם זאת, התחום הקטליטי של רוב MMPs לא יכול לבוא לידי ביטוי Escherichia coli (E. coli) בצורה מסיסת בשל חוסר מכונות פוסט-טרנסלטיות, בעוד מערכות ביטוי יונקים הם בדרך כלל יקרים ויש להם תשואות נמוכות יותר. גופי הכללת MMP חייבים לעבור את התהליך המייגע והמייגע של טיהור נרחב ושיפוץ מחדש, מה שמפחית באופן משמעותי את התשואה של MMPs בקונפורמציה מקומית. מאמר זה מציג פרוטוקול באמצעות Rosetta2(DE3)pLysS (להלן R2DP) תאים כדי לייצר מטריצה metalloproteinase-3 תחום קטליטי (MMP-3cd), המכיל N-מסוף His-tag ואחריו pro-domain (Hisx6-pro-MMP-3cd) לשימוש בטיהור זיקה. תאי R2DP משפרים את הביטוי של חלבונים אאוקריוטים באמצעות פלסמיד עמיד בפני כלורמפניקול המכיל קודונים נדירים בדרך כלל במערכות ביטוי חיידקיות. בהשוואה לקו התא המסורתי המועדף על ביטוי חלבון רקומביננטי, BL21(DE3), טיהור באמצעות זן חדש זה שיפר את התשואה של Hisx6-pro-MMP-3cd מטוהר. לאחר ההפעלה וההתפלה, התחום המקצועי נבקע יחד עם ה- N-terminal His-tag, ומספק MMP-3cd פעיל לשימוש מיידי באינספור יישומי הפריה חוץ גופית . שיטה זו אינה דורשת ציוד יקר או חלבוני היתוך מורכבים ומתארת ייצור מהיר של MMPs אנושיים רקומביננטיים בחיידקים.
Introduction
רוב החלבונים האוקריוטים המורכבים עוברים שינויים פוסט-טרנסליים מורכבים לאחר ההבעה, הדורשים קיפול חלבונים בסיוע גבוה וגורמים משותפים כדי להיות פונקציונליים1. ייצור כמויות גדולות של חלבון אנושי מסיס בפונדקאי חיידקי נותר אתגר משמעותי בשל עלויות גבוהות והיעדר שיטות ביטוי וטיהור חזקות, אפילו לניסויי מעבדה בקנה מידה קטן יותר2,3. MMPs, אנדופטידסים אנושיים עם משקל מולקולרי גדול, מתבטאים בדרך כלל כגופי הכללה בלתי מסיסים כאשר הם באים לידי ביטוי ב– E. coli. הפקת MMPs אנושיים מסיסים מובילה לעתים קרובות לתהליך solubilization מייגע וגוזל זמן רב4.
ל- MMPs יש תפקידים קריטיים הן בתהליכים פיזיולוגיים והן בתהליכים פתוגניים. MMPs אנושיים הם משפחה של 23 אנדופטידסים אבץ, מסווגים לפי מבנה ומצע ספציפיים, ובאים לידי ביטוי דיפרנציאלי למרות תחום קטליטי שמור מאוד 5,6. MMPs מופרשים כמו זימוגנים לא פעילים, מוסדר באמצעות הפעלה פוסט-טרנסלטית ומעכבים אנדוגני שלהם, מעכבי רקמות של metalloproteinases (TIMPs)7,8,9,10. למרות שהוכרו בתחילה על תפקידם במחזור ECM, MMPs היו מעורבים גם בפיתוח, מורפוגנזה, תיקון רקמות, ושיפוץ8. Dysregulation של MMPs נקשרה באופן בולט לסרטן יחד עם מחלות ניווניות, לב וכלי דם, פיברוטיות, בין מחלות אחרות5,7.
הפיתוח של שיטות ייצור MMP חזקות בקנה מידה גדול הוא קריטי כדי להבטיח את הצלחתם של מחקרים עתידיים של מנגנוני MMP באמצעות בדיקות ביוכימיות ומבוססות תאים. MMPs שונים התבטאו בעבר בחיידקים11, כולל MMPs מתויגים Hisx6, מבלי לשנות את פעילות ה- MMP12,13,14,15. עם זאת, שיטות אלה כוללות צעדים מייגעים וארוכים שעשויים להיות קשים לשכפול.
תאי יונקים יכולים לשמש גם כדי לבטא חלבונים אנושיים רבים ושונים תוך הבטחת השינויים הפוסט-טרנסליים הנכונים16. למרות שמערכת הביטוי של היונקים היא בחירה אידיאלית לייצר חלבונים אנושיים רקומביננטיים עם שינויים נכונים לאחר התרגום, החסרונות העיקריים של שיטה זו הם תשואות נמוכות ראשוניות, מדיה צמיחה יקרה ורגנטים, צירי זמן ארוכים כדי להגיע לקווי ביטוי יציבים, וסיכון לזיהום עם מינים אחרים כגון פטריות או חיידקים2,11 . יתר על כן, ייצור MMP בשורות תאי יונקים מניב זיהומים מחלבונים תאיים הקשורים כגון TIMPs או פיברונקטין11. שלא כמו צמיחת התאים האיטית שנצפתה בתאי יונקים, מערכת הביטוי החיידקית מציעה ייצור חלבון בקנה מידה גדול בפרק זמן קצר יחד עם מדיה פשוטה יותר ודרישות צמיחה. עם זאת, בשל היעדר חלבונים תאיים אחרים הקשורים (כלומר, TIMPs) במערכות ביטוי חיידקי, MMPs פעיל בריכוזים גבוהים יותר כפופים השפלה באמצעות autoproteolysis, וכתוצאה מכך תשואה MMP ירודה17.
מאמר זה מתאר שיטה מפורטת לביטוי חיידקי, טיהור והפעלה של Hisx6-pro-MMP-3cd רקומביננטי באמצעות E. coli כפונדקאי ביטוי בשל סבירותו, פשטותו, והצלחה בהפקת תשואות גבוהות יותר של MMPs2,3,18. מאז E. coli חסר את מכונות קיפול חלבון ועיבוד פוסט-טרנסלנטי הנדרש עבור MMPs רקומביננטי וחלבונים מורכבים אחרים, זנים רבים E. coli תוכננו כדי להתגבר על מגבלות אלה, מה שהופך את E. coli פונדקאי מתאים יותר לביטוי של MMP-3cd אנושי רקומביננטי, 19,20 . לדוגמה, זן R2DP המשמש במחקר זה משפר את הביטוי האוקריוטי על ידי אספקת פלסמיד עמיד בפני כלורמפניקול המכיל קודונים המשמשים לעתים רחוקות E. coli.
כפי שמתואר בפרוטוקול זה, לאחר הבעת יתר של גופי הכללה טהורים יחסית מווקטור pET-3a (איור 1) בתאי R2DP, חלבוני Hisx6-pro-MMP-3 קטליטי (MMP-3cd) מופקים ומנוטרלים4. Hisx6-pro-MMP-3cd3,19 היה מטוהר באמצעות כרומטוגרפיה תג זיקה. לאחר refolding ודיאליזה, pro-MMP-3cd (זימוגן) הופעל על ידי אצטט 4-aminophenylmercuric (APMA), וניתוח SDS-PAGE משמש להערכת התשואות ואת הצורך בטיהור נוסף5,21. פרוטוקול זה מתאר ביטוי, טיהור והפעלה של MMP-3cd מסיס כדוגמה. עם זאת, הוא עשוי לשמש גם כמדריך לביטוי של MMPs ופרוטאזים אנושיים אחרים עם ביטוי דומה, ומנגנוני הפעלה (איור 2). עבור חלבונים אחרים שאינם MMP-3cd, הקורא מומלץ לקבוע קומפוזיציות חיץ אופטימליות ושיטות עבור חלבון היעד שלהם לפני ניסיון פרוטוקול זה.
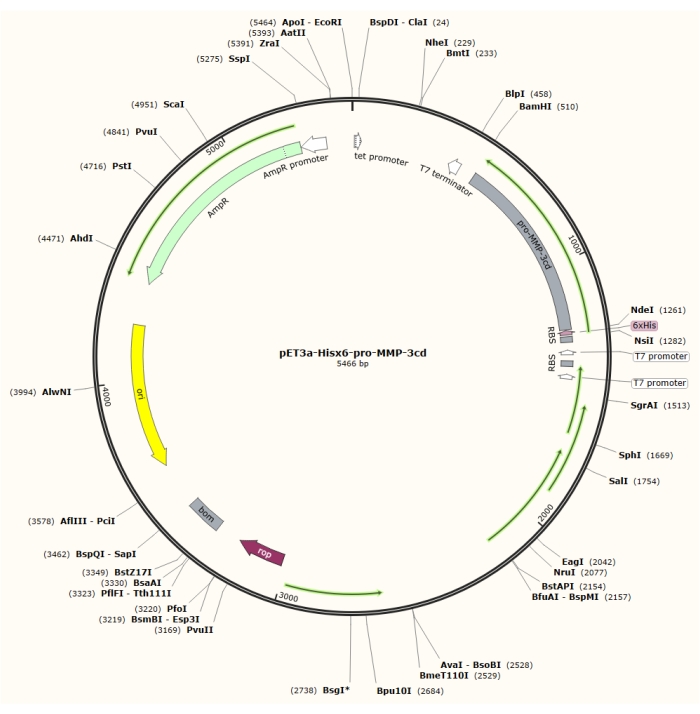
איור 1: מפת פלסמיד של הפלסמיד pET-3a-Hisx6-pro-MMP-3cd plasmid. וקטור pET-3a כולל גן עמידות אמפיצילין. רצף תגים מסוג N-terminal Hisx6 משוכפל לתוך וקטור מבוסס pET-3a, כולל פרו-MMP-3cd, כדי להניב את המבנה pET-3a-Hisx6-pro-MMP-3cd תחת שליטה של מקדם T7 בין אתרי ההגבלה BamHI ו- NdeI. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
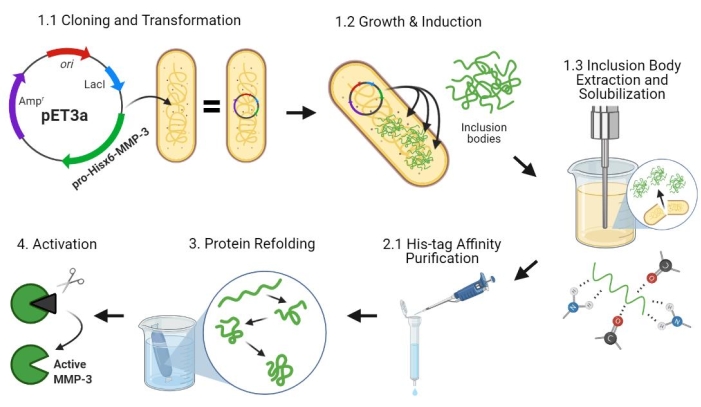
איור 2: ביטוי חיידקי של פלסמיד פרו-MMP-3cd, טיהור, שכפול מחדש והפעלה. 1.1: pET-3a-Hisx6-pro-MMP-3cd פלסמיד הפך לתאי BL21(DE3) או R2DP. 1.2: ביטוי חלבון פרו-MMP-3cd הושרה באמצעות IPTG. 1.3: תמוגה כימית ו sonication משמשים כדי לחלץ Hisx6-pro-MMP-3cd חלבונים כי הם בעיקר מסיסים ונמצאים בגופי ההכללה. אוריאה שימשה כדי denature ו solubilize חלבון מגופי הכללה. 2.1. חלבון Hisx6-pro-MMP-3cd מטוהר באמצעות טיהור כרומטוגרפיה של זיקה. 3. Hisx6-pro-MMP-3cd המנוטרל נפרש לאט במהלך דיאליזה באמצעות הסרה הדרגתית של אוריאה מהחוצץ. 4. לבסוף, חלבון MMP-3cd משוחזר הופעל באמצעות APMA על ידי הסרת תחום N-מסוף פרו פפטיד. APMA מוסר מאוחר יותר מהפתרון באמצעות התפלה. המספרים תואמים למקטעי פרוטוקול המתארים שלבים אלה. קיצורים: MMP-3cd = מטריקס metalloproteinase-3 תחום קטליטי; APMA = אצטט 4-אמינופניל-מרקורי. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
Representative Results
Discussion
הייצור בקנה מידה גדול של MMPs מסיסים, אנושיים, רקומביננטיים נשאר משימה מאתגרת. תאי יונקים יכולים לבטא MMPs פונקציונליים בעלויות גבוהות וזמני המתנה ארוכים, ואילו E. coli מייצר במהירות כמויות גבוהות של גופי הכללת MMP שיש לטהר ולטפח מחדש 11,16. תאי R2DP מגדילים באופן מ…
Disclosures
The authors have nothing to disclose.
Acknowledgements
המחברים רוצים להודות לד”ר אווט רדיסקי ואלכסנדרה הוקלה במרפאת מאיו בג’קסונוויל, פלורידה, על כך שסיפקו את הפלסמיד pET-3a-pro-MMP-3cd כתבנית לשיבוט הגן Hisx6pro-MMP-3cd, ואת הערותיהם, יחד עם ד”ר פול הארטלי ממרכז הגנומיקה של נבאדה באוניברסיטת נבאדה, רינו, לרצף DNA. המחברים רוצים גם להודות לקסנדרה הרגנרדר על שעזרה עם חלק מביטוי החלבון. מ.ר.ס. רוצה להודות למענק NIH-P20 GM103650-COBRE אינטגרטיבי למדעי המוח ולפרס מענק הזרעים MICRO MICRO של UNR R&D.
Materials
| 0.22 µm sterile filter | Sigma Aldrich | SLGP033RS | Used to remove some contaminants from the protein extract before purification, and prevent the Ni-NTA column from clogging |
| 1 L Erlenmeyer flasks | Thermo Fisher Scientific | S76106F | n/a |
| 1 L glass bottles | Thermo Fisher Scientific | 06-414-1D | n/a |
| 1.5 mL microfuge tubes | Thermo Fisher Scientific | 02-682-002 | n/a |
| 15 mL conical tubes | Thermo Fisher Scientific | 339650 | n/a |
| 18 G, 1-in. beveled needle | Amazon | B07S7VBHM2 | Used in combination with the dialysis casette |
| 2 mL desalting column | Thermo Fisher Scientific | 89890 | Removes APMA following activation |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Thermo Fisher Scientific | AAA1610422 | n/a |
| 250 mL conical bottle cushions | Thermo Fisher Scientific | 05-538-53A | Stabilize conical bottles during large-volume centrifugation |
| 250 mL conical bottles | Thermo Fisher Scientific | 05-538-53 | n/a |
| 400 mL stirred cell | Sigma Aldrich | UFSC40001 | Re-concentrates a much larger volume than the centrifugal filter unit. Rosetta2(DE3)pLysS cells produce high volumes of protein that may exceed the 15 mL limit of the centrifugal filter unit |
| 4-aminophenylmercuric acetate (APMA) | Sigma Aldrich | A9563-5G | Activates MMP-3 by cleaving the propeptide |
| 5 mL syringe | Thermo Fisher Scientific | NC0829167 | Used in combination with the dialysis casette |
| 50 mL conical tubes | Thermo Fisher Scientific | 339650 | Used for storage in many purification steps |
| 50 mL re-concentration tube | Sigma Aldrich | UFC901024D | Used for re-concentrating protein samples after dialysis or removing contaminants |
| Agar | Thermo Fisher Scientific | BP1423-500 | Buffer ingredient that solidifies autoclaved LB media upon cooling |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | Antibiotic used with pET3a vector; used at 100 µg/mL in LB media |
| BamHI | NEB | R3136S | Restriction enzyme to be used with the pET3a vector |
| Calcium chloride (CaCl2) | Thermo Fisher Scientific | 600-30-23 | The calcium ion stabilizes MMP structure |
| Cell spreaders | Thermo Fisher Scientific | 50-189-7544 | Can be used to spread cells across a petri dish after transformation |
| Chloramphenicol | Thermo Fisher Scientific | 22-055-125GM | Antibiotic used with pET3a vector; used at 34 µg/mL in LB media |
| Dialysis Buffer 1 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 4 M Urea. |
| Dialysis Buffer 2 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 2 M Urea. |
| Dialysis Buffer 3 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2 , 1 µM ZnCl2. |
| Dialysis clips | Thermo Fisher Scientific | 68011 | Used in combination with snakeskin dialysis tubing |
| Dialysis tubing | Thermo Fisher Scientific | 88243 | Alternative dialysis method that holds much larger sample volumes, but with higher risk of sample loss |
| Digest buffer | NEB | B7204S | Buffer used in digesting the pET3a vector |
| Disposable cuvettes | Thermo Fisher Scientific | 21-200-257 | Used to measure the bacterial culture OD during growth and expression |
| Dithiothreitol (DTT) | Thermo Fisher Scientific | D107125G | Assists with protein denaturation by reducing any disulfide bonds |
| DNA assembly mix | NEB | E2621S | Used to ligate the Hisx6-pro-MMP-3cd PCR product and digested pET3a vector |
| DNase I | NEB | M0303S | Endonuclease for degrading unfavorable DNA contaminants that could later affect protein purification |
| Ethanol | Thermo Fisher Scientific | A995-4 | n/a |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Fisher Scientific | J15694-AE | Used in denaturation. Prevents oxidation and subsequent formation of disulfide bonds |
| Gel recovery kit | Promega | A9281 | Isolates and purifies DNA from agarose gels |
| Glycerol | Thermo Fisher Scientific | G33-500 | Used for making glycerol stocks, which are frozen at -80 °C |
| Gravity flow column | BioRad | 7321010 | Used for Ni-NTA purification of recombinantly His-tagged proteins |
| Guanidine hydrochloride (GdnHCl) | Thermo Fisher Scientific | AAA135430B | Second chaotropic agent used for disrupting protein secondary structure. |
| High-transformation efficiency cells | NEB | C2987 | High-transformation efficiency cells with greater chance of success for cloning the N-terminal His-tag into the pET3a-pro-MMP-3cd construct |
| HT Elution Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 250 mM imidazole. Adjust pH to 7.4 |
| HT Equilibration Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea. Adjust pH to 7.4 |
| HT Regeneration Buffer | n/a | n/a | 20 mM MES, 0.1 M NaCl. Adjust pH to 5.0 |
| HT Wash Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 25 mM imidazole. Adjust pH to 7.4 |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | A144C-212 | Used to pH buffers |
| Imidazole | Thermo Fisher Scientific | AAA1022122 | Mimics the histidine side group. Used to separate non-specifically binding proteins from the his-tagged target protein |
| Inclusion Body Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 5 mM DTT, 2% v/v Triton X 100, 0.5 M Urea. Adjust pH to 8.0 |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | FERR0392 | A reagent that induces target gene expression in pET3a. Make 0.5 mL 1 M aliquots, filter sterilize and store in -20 °C |
| LB Amp CamR media | n/a | n/a | To be poured into a sterible 1 L bottle or 1 L flask. For 1 L, add 25 g LB Broth. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Amp CamR plates | n/a | n/a | To be poured into sterile petri dishes. Pour until the petri dish lid is completely covered. 1 L of media yields 40-60 plates. For 1 L: 25 g LB Broth, 16 g Agar. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Broth | Thermo Fisher Scientific | BP1426-2 | Pre-mixed with tryptone, yeast extract, and sodium chloride |
| Lysis Buffer | n/a | n/a | 50 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 0.133 g/mL lysozyme, 0.49% v/v Triton X-100. Adjust pH to 8.0 |
| Lysozyme | MP Biomedicals | 195303 | Used in protein extraction. Enzyme that lyses bacterial cell walls |
| Miniprep kit | Promega | A1330 | If successful, extracts the pET3a-pro-MMP-3cd construct from transformants |
| NdeI | NEB | R0111S | Restriction enzyme to be used with the pET3a vector |
| Ni-NTA resin | Thermo Fisher Scientific | PI88221 | Used to bind recombinant his-tagged proteins. This strong interaction can be displaced with higher concentrations of imidazole |
| PCR mix | NEB | M0492S | A PCR reagent for inserting an N-terminal his-tag into the pET3a-pro-MMP-3cd vector |
| pET plasmid | Addgene | n/a | The pET3a vector offers ampicillin resistance, inducible expression of a target gene, and sequencing with T7 primers |
| Petri dishes | VWR | 25384-342 | Used for plating transformants on LB agar media |
| R2DP cells | Novagen | 714033 | BL21 derivatives with enhanced expression of eukaryotic proteins. Contain tRNAs of codons found to be rare in e. coli |
| SOC growth media | NEB | B9020S | Non-selective growth media for rapid growth during transformation |
| Sodium chloride (NaCl) | Thermo Fisher Scientific | BP358-1 | Used in buffers and helps with protein stability |
| Sodium deoxycholate | Thermo Fisher Scientific | PI89905 | Detergent used in protein extraction. Lyses cell walls |
| Solubilization Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 10 mM DTT, 6 M Urea. Adjust pH to 8.0 |
| Tris base | Thermo Fisher Scientific | BP152-1 | Common buffer used in the physiological pH range. Temperature-sensitive |
| Triton X-100 | Thermo Fisher Scientific | M1122980101 | Detergent used for cell lysis |
| Urea | Thermo Fisher Scientific | AAJ75826A7 | First chaotropic agent for disrupting protein secondary structure |
| Zinc chloride (ZnCl2) | Thermo Fisher Scientific | AAA162810E | Stabilizes MMP structure. The zinc ion is found in the catalytic site of MMP-3 |
References
- Portolano, N., et al. Recombinant protein expression for structural biology in HEK 293F suspension cells: A novel and accessible approach. Journal of Visualized Experiments: JoVE. (92), e51897 (2014).
- Subedi, G. P., Johnson, R. W., Moniz, H. A., Moremen, K. W., Barb, A. High yield expression of recombinant human proteins with the transient transfection of HEK293 cells in suspension. Journal of Visualized Experiments: JoVE. (106), e53568 (2015).
- Nilvebrant, J., Alm, T., Hober, S. Orthogonal protein purification facilitated by a small bispecific affinity tag. Journal of Visualized Experiments: JoVE. (59), e3370 (2012).
- Yang, Z., et al. Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-step-denaturing and refolding method. PLoS One. 6 (7), 22981 (2011).
- Hu, X., Beeton, C. Detection of functional matrix metalloproteinases by zymography. Journal of Visualized Experiments: JoVE. (45), e2445 (2010).
- Radisky, E. S., Raeeszadeh-Sarmazdeh, M., Radisky, D. C. Therapeutic potential of matrix metalloproteinase inhibition in breast cancer. Journal of Cellular Biochemistry. 118 (11), 3531-3548 (2017).
- Raeeszadeh-Sarmazdeh, M., Do, L. D., Hritz, B. G. Metalloproteinases and their inhibitors: Potential for the development of new therapeutics. Cells. 9 (5), 1313 (2020).
- Nagase, H., Visse, R., Murphy, G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular Research. 69 (3), 562-573 (2006).
- Raeeszadeh-Sarmazdeh, M., et al. Directed evolution of the metalloproteinase inhibitor TIMP-1 reveals that its N- and C-terminal domains cooperate in matrix metalloproteinase recognition. Journal of Biological Chemistry. 294 (24), 9476-9488 (2019).
- Batra, J., et al. Matrix metalloproteinase-10 (MMP-10) interaction with tissue inhibitors of metalloproteinases TIMP-1 and TIMP-2. Journal of Biological Chemistry. 287 (19), 15935-15946 (2012).
- Singh, K. K., Jain, R., Ramanan, H., Saini, D. K., Galea, C. A. Expression and purification of matrix metalloproteinases in Escherichia coli. Matrix Metalloproteases. , 3-16 (2017).
- Manka, S. W., et al. Structural insights into triple-helical collagen cleavage by matrix metalloproteinase 1. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12461-12466 (2012).
- Gomis-Ruth, F. X., et al. Mechanism of inhibition of the human matrix metalloproteinase stromelysin-1 by TIMP-1. Nature. 389 (6646), 77-81 (1997).
- Shirian, J., et al. Converting a broad matrix metalloproteinase family inhibitor into a specific inhibitor of MMP-9 and MMP-14. FEBS Letters. 592 (7), 1122-1134 (2018).
- Li, C., et al. Purification of recombinant histidine-tagged catalytic domain of MMP-13 in one step using affinity column and renaturation of it with histidine tag. Journal of Liquid Chromatography & Related Technologies. 37 (15), 2118-2130 (2014).
- Aydin, H., Azimi, F. C., Cook, J. D., Lee, J. E. A convenient and general expression platform for the production of secreted proteins from human cells. Journal of Visualized Experiments: JoVE. (65), e4041 (2012).
- McNiff, M. L., Haynes, E. P., Dixit, N., Gao, F. P., Laurence, J. S. Thioredoxin fusion construct enables high-yield production of soluble, active matrix metalloproteinase-8 (MMP-8) in Escherichia coli. Protein Expression and Purification. 122, 64-71 (2016).
- Maity, R., et al. GST-His purification: A two-step affinity purification protocol yielding full-length purified proteins. Journal of Visualized Experiments: JoVE. (80), e50320 (2013).
- Stefan, A., Ceccarelli, A., Conte, E., Montón Silva, A., Hochkoeppler, A. The multifaceted benefits of protein co-expression in Escherichia coli. Journal of Visualized Experiments: JoVE. (96), e52431 (2015).
- Yadavalli, R., Sam-Yellowe, T. HeLa based cell free expression systems for expression of Plasmodium rhoptry proteins. Journal of Visualized Experiments: JoVE. (100), e52772 (2015).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 magnetosome associated protein MamAΔ41. Journal of Visualized Experiments: JoVE. (37), e1844 (2010).

