Expression bactérienne et purification de la métalloprotéinase-3 à matrice humaine par chromatographie d’affinité
Summary
La purification, la dialyse et l’activation de son étiquette sont utilisées pour augmenter les rendements de l’expression des protéines solubles du domaine catalytique de la métalloprotéinase-3 à matrice active chez les bactéries. Les fractions protéiques sont analysées via des gels SDS-PAGE.
Abstract
Les métalloprotéinases matricielles (MMP) appartiennent à la famille des protéases de metzincine avec des rôles centraux dans la dégradation et le remodelage de la matrice extracellulaire (ECM), ainsi que dans les interactions avec plusieurs facteurs de croissance et cytokines. La surexpression de MMP spécifiques est responsable de plusieurs maladies telles que le cancer, les maladies neurodégénératives et les maladies cardiovasculaires. Les MMP ont récemment été au centre de l’attention en tant que cibles pour développer des thérapies capables de traiter les maladies corrélées à la surexpression de la MMP.
Pour étudier le mécanisme MMP en solution, des méthodes d’expression et de purification des protéines recombinantes plus faciles et plus robustes sont nécessaires pour la production de MMP actifs et solubles. Cependant, le domaine catalytique de la plupart des MMP ne peut pas être exprimé chez Escherichia coli (E. coli) sous forme soluble en raison de l’absence de mécanisme post-traductionnel, alors que les systèmes d’expression des mammifères sont généralement coûteux et ont des rendements plus faibles. Les corps d’inclusion MMP doivent subir le processus fastidieux et laborieux de purification et de repliement approfondis, réduisant considérablement le rendement des MMP en conformation native. Cet article présente un protocole utilisant des cellules Rosetta2(DE3)pLysS (ci-après dénommées R2DP) pour produire le domaine catalytique de la métalloprotéinase matricielle-3 (MMP-3cd), qui contient une étiquette His-terminalE N suivie d’un pro-domaine (Hisx6-pro-MMP-3cd) pour une utilisation dans la purification d’affinité. Les cellules R2DP améliorent l’expression des protéines eucaryotes grâce à un plasmide résistant au chloramphénicol contenant des codons normalement rares dans les systèmes d’expression bactérienne. Par rapport à la lignée cellulaire traditionnelle de choix pour l’expression des protéines recombinantes, BL21 (DE3), la purification à l’aide de cette nouvelle souche a amélioré le rendement en Hisx6-pro-MMP-3cd purifié. Lors de l’activation et du dessalement, le domaine pro est clivé avec le N-terminal His-tag, fournissant un MMP-3cd actif pour une utilisation immédiate dans d’innombrables applications in vitro . Cette méthode ne nécessite pas d’équipement coûteux ou de protéines de fusion complexes et décrit la production rapide de MMP humains recombinants chez les bactéries.
Introduction
La plupart des protéines eucaryotes complexes subissent des modifications post-traductionnelles élaborées après leur expression, nécessitant un repliement des protéines hautement assisté et des cofacteurs pour être fonctionnels1. La production de grandes quantités de protéines humaines solubles dans un hôte bactérien reste un défi important en raison des coûts élevés et du manque de méthodes d’expression et de purification robustes, même pour des expériences de laboratoire à plus petite échelle2,3. Les MMP, des endopeptidases humaines de grand poids moléculaire, sont généralement exprimées sous forme de corps d’inclusion insolubles lorsqu’elles sont exprimées dans E. coli. L’extraction des MMP humains solubles conduit souvent à un processus de solubilisation et de repli laborieux et long4.
Les MMP jouent un rôle essentiel dans les processus physiologiques et pathogènes. Les MMP humains sont une famille de 23 endopeptidases de zinc, classées par structure et spécificité du substrat, et exprimées différemment en dépit d’un domaine catalytique hautement conservé5,6. Les MMP sont sécrétés sous forme de zymogènes inactifs, régulés par activation post-traductionnelle et leurs inhibiteurs endogènes, inhibiteurs tissulaires des métalloprotéinases (TIMPs)7,8,9,10. Bien qu’initialement reconnus pour leur rôle dans le renouvellement de l’ECM, les MMP ont également été impliqués dans le développement, la morphogenèse, la réparation des tissus et le remodelage8. La dérégulation des MMP a été notamment liée au cancer ainsi qu’aux maladies neurodégénératives, cardiovasculaires et fibrotiques, entre autres maladies5,7.
Le développement de méthodes robustes de production de MMP à grande échelle est essentiel pour assurer le succès des études futures des mécanismes MMP par le biais de tests biochimiques et cellulaires. Divers MMP ont déjà été exprimés dans des bactéries11, y compris des MMP marqués Hisx6, sans modifier l’activité MMP12,13,14,15. Cependant, ces méthodes comprennent des étapes longues et fastidieuses qui peuvent être difficiles à reproduire.
Les cellules de mammifères peuvent également être utilisées pour exprimer de nombreuses protéines humaines différentes tout en assurant les modifications post-traductionnelles appropriées16. Bien que le système d’expression des mammifères soit un choix idéal pour produire des protéines humaines recombinantes avec des modifications post-traductionnelles appropriées, les principaux inconvénients de cette méthode sont les faibles rendements initiaux, les milieux de croissance et les réactifs coûteux, les longs délais pour atteindre des lignes d’expression stables et le risque de contamination par d’autres espèces telles que les champignons ou les bactéries2,11 . De plus, la production de MMP dans les lignées cellulaires de mammifères produit des impuretés à partir de protéines cellulaires associées telles que les TIMPs ou les fibronectines11. Contrairement à la croissance cellulaire lente observée dans les cellules de mammifères, le système d’expression bactérienne offre une production de protéines à grande échelle dans un court laps de temps ainsi que des milieux plus simples et des besoins de croissance. Cependant, en raison de l’absence d’autres protéines cellulaires associées (c.-à-d. les TIMPs) dans les systèmes d’expression bactérienne, les MMP actifs à des concentrations plus élevées sont sujets à la dégradation par autoprotéolyse, ce qui entraîne un faible rendement en MMP17.
Cet article décrit une méthode détaillée pour l’expression bactérienne, la purification et l’activation de Hisx6-pro-MMP-3cd recombinant en utilisant E. coli comme hôte d’expression en raison de son prix abordable, de sa simplicité et de son succès dans la production de rendements plus élevés de MMP2,3,18. Étant donné qu’E. coli n’a pas la machinerie de repliement des protéines et le traitement post-traductionnel requis pour les MMP recombinants et d’autres protéines complexes, de nombreuses souches d’E. coli ont été conçues pour surmonter ces limitations, faisant d’E. coli un hôte plus approprié pour l’expression de MMP-3cd humain recombinant,19,20 . Par exemple, la souche R2DP utilisée dans cette étude améliore l’expression eucaryote en fournissant un plasmide résistant au chloramphénicol contenant des codons rarement utilisés chez E. coli.
Comme décrit dans ce protocole, après surexpression de corps d’inclusion relativement purs du vecteur pET-3a (Figure 1) dans les cellules R2DP, les protéines du domaine catalytique Hisx6-pro-MMP-3 (MMP-3cd) sont extraites et dénaturées4. Hisx6-pro-MMP-3cd3,19 a été purifié par chromatographie par étiquette d’affinité. Lors du repliement et de la dialyse, le pro-MMP-3cd (zymogène) a été activé par l’acétate de 4-aminophénylmercurique (APMA), et l’analyse SDS-PAGE est utilisée pour évaluer les rendements et la nécessité d’une purification supplémentaire5,21. Ce protocole décrit l’expression, la purification et l’activation de MMP-3cd soluble à titre d’exemple. Cependant, il peut également être utilisé comme guide pour l’expression d’autres MMP et protéases humaines ayant une expression similaire, et des mécanismes d’activation (Figure 2). Pour d’autres protéines autres que MMP-3cd, il est conseillé au lecteur de déterminer les compositions tampons optimales et les méthodes pour leur protéine cible avant d’essayer ce protocole.
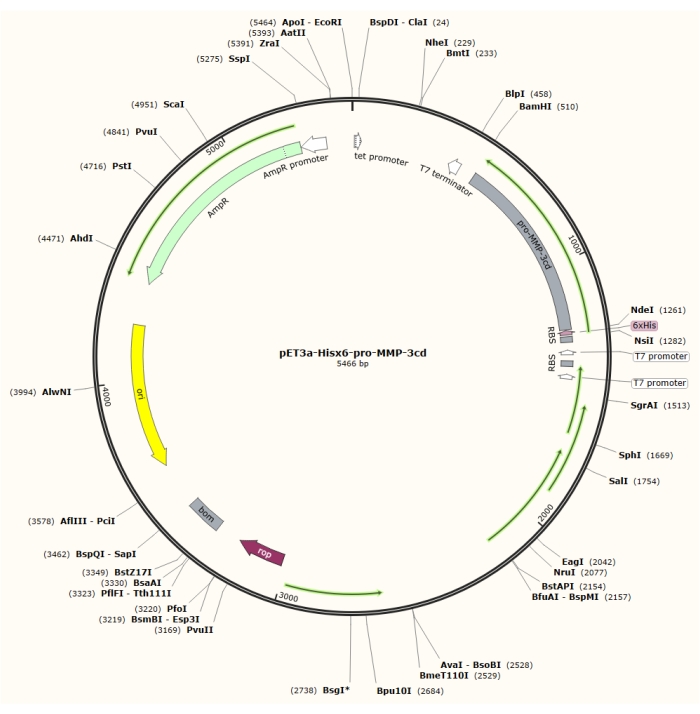
Figure 1 : Carte plasmidique du plasmide pET-3a-Hisx6-pro-MMP-3cd. Le vecteur pET-3a comprend un gène de résistance à l’ampicilline. Une séquence de balises Hisx6 n-terminales est clonée dans le vecteur pET-3a, y compris pro-MMP-3cd, pour donner la construction pET-3a-Hisx6-pro-MMP-3cd sous contrôle du promoteur T7 entre les sites de restriction BamHI et NdeI. Veuillez cliquer ici pour voir une version agrandie de cette figure.
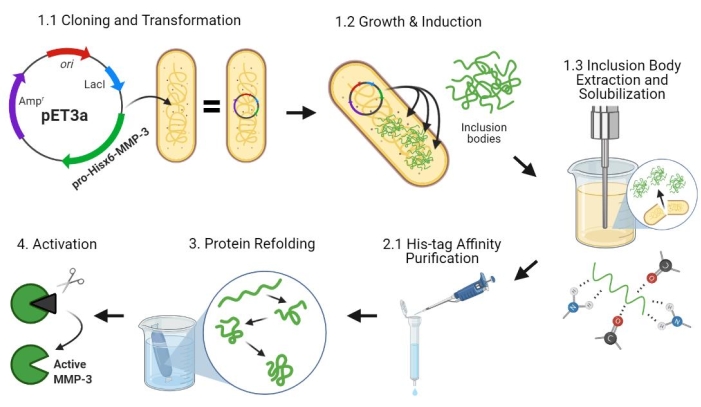
Figure 2 : Expression bactérienne du pro-MMP-3cd, purification, repliement et activation. 1.1 : Le plasmide pET-3a-Hisx6-pro-MMP-3cd a été transformé en cellules BL21(DE3) ou R2DP. 1.2 : L’expression de la protéine Pro-MMP-3cd a été induite à l’aide de l’IPTG. 1.3: La lyse chimique et la sonication sont utilisées pour extraire les protéines Hisx6-pro-MMP-3cd qui sont principalement insolubles et présentes dans les corps d’inclusion. L’urée a été utilisée pour dénaturer et solubiliser les protéines des corps d’inclusion. 2.1. La protéine Hisx6-pro-MMP-3cd dénaturée a été purifiée par purification par chromatographie d’affinité. 3. L’Hisx6-pro-MMP-3cd élué a été lentement replié pendant la dialyse par élimination progressive de l’urée du tampon. 4. Enfin, la protéine MMP-3cd repliée a été activée à l’aide de l’APMA en supprimant le domaine pro-peptidique N-terminal. L’APMA est ensuite retiré de la solution par dessalement. Les numéros correspondent aux sections du protocole décrivant ces étapes. Abréviations : MMP-3cd = Matrice métalloprotéinase-3 domaine catalytique ; APMA = acétate de 4-aminophénylmercurique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
La production à grande échelle de MMP solubles, humains et recombinants reste une tâche difficile. Les cellules de mammifères peuvent exprimer des MMP fonctionnels à des coûts élevés et de longs temps d’attente, tandis que E. coli produit rapidement de grandes quantités de corps d’inclusion MMP qui doivent être purifiés et repliés11,16. Les cellules R2DP augmentent considérablement le rendement des corps d’inclusion MMP, permettant un …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Les auteurs aimeraient remercier le Dr Evette Radisky et Alexandra Hockla de la Mayo Clinic de Jacksonville, en Floride, pour avoir fourni le plasmide pET-3a-pro-MMP-3cd comme modèle de clonage du gène Hisx6pro-MMP-3cd, ainsi que le Dr Paul Hartley du Nevada Genomics Center de l’Université du Nevada, Reno, pour le séquençage de l’ADN. Les auteurs aimeraient également remercier Cassandra Hergenrader pour avoir aidé à une partie de l’expression des protéines. M.R.-S. tient à remercier la subvention NIH-P20 GM103650-COBRE Integrative Neuroscience et le prix UNR R&D mICRO SEED Grant Award.
Materials
| 0.22 µm sterile filter | Sigma Aldrich | SLGP033RS | Used to remove some contaminants from the protein extract before purification, and prevent the Ni-NTA column from clogging |
| 1 L Erlenmeyer flasks | Thermo Fisher Scientific | S76106F | n/a |
| 1 L glass bottles | Thermo Fisher Scientific | 06-414-1D | n/a |
| 1.5 mL microfuge tubes | Thermo Fisher Scientific | 02-682-002 | n/a |
| 15 mL conical tubes | Thermo Fisher Scientific | 339650 | n/a |
| 18 G, 1-in. beveled needle | Amazon | B07S7VBHM2 | Used in combination with the dialysis casette |
| 2 mL desalting column | Thermo Fisher Scientific | 89890 | Removes APMA following activation |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Thermo Fisher Scientific | AAA1610422 | n/a |
| 250 mL conical bottle cushions | Thermo Fisher Scientific | 05-538-53A | Stabilize conical bottles during large-volume centrifugation |
| 250 mL conical bottles | Thermo Fisher Scientific | 05-538-53 | n/a |
| 400 mL stirred cell | Sigma Aldrich | UFSC40001 | Re-concentrates a much larger volume than the centrifugal filter unit. Rosetta2(DE3)pLysS cells produce high volumes of protein that may exceed the 15 mL limit of the centrifugal filter unit |
| 4-aminophenylmercuric acetate (APMA) | Sigma Aldrich | A9563-5G | Activates MMP-3 by cleaving the propeptide |
| 5 mL syringe | Thermo Fisher Scientific | NC0829167 | Used in combination with the dialysis casette |
| 50 mL conical tubes | Thermo Fisher Scientific | 339650 | Used for storage in many purification steps |
| 50 mL re-concentration tube | Sigma Aldrich | UFC901024D | Used for re-concentrating protein samples after dialysis or removing contaminants |
| Agar | Thermo Fisher Scientific | BP1423-500 | Buffer ingredient that solidifies autoclaved LB media upon cooling |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | Antibiotic used with pET3a vector; used at 100 µg/mL in LB media |
| BamHI | NEB | R3136S | Restriction enzyme to be used with the pET3a vector |
| Calcium chloride (CaCl2) | Thermo Fisher Scientific | 600-30-23 | The calcium ion stabilizes MMP structure |
| Cell spreaders | Thermo Fisher Scientific | 50-189-7544 | Can be used to spread cells across a petri dish after transformation |
| Chloramphenicol | Thermo Fisher Scientific | 22-055-125GM | Antibiotic used with pET3a vector; used at 34 µg/mL in LB media |
| Dialysis Buffer 1 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 4 M Urea. |
| Dialysis Buffer 2 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 2 M Urea. |
| Dialysis Buffer 3 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2 , 1 µM ZnCl2. |
| Dialysis clips | Thermo Fisher Scientific | 68011 | Used in combination with snakeskin dialysis tubing |
| Dialysis tubing | Thermo Fisher Scientific | 88243 | Alternative dialysis method that holds much larger sample volumes, but with higher risk of sample loss |
| Digest buffer | NEB | B7204S | Buffer used in digesting the pET3a vector |
| Disposable cuvettes | Thermo Fisher Scientific | 21-200-257 | Used to measure the bacterial culture OD during growth and expression |
| Dithiothreitol (DTT) | Thermo Fisher Scientific | D107125G | Assists with protein denaturation by reducing any disulfide bonds |
| DNA assembly mix | NEB | E2621S | Used to ligate the Hisx6-pro-MMP-3cd PCR product and digested pET3a vector |
| DNase I | NEB | M0303S | Endonuclease for degrading unfavorable DNA contaminants that could later affect protein purification |
| Ethanol | Thermo Fisher Scientific | A995-4 | n/a |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Fisher Scientific | J15694-AE | Used in denaturation. Prevents oxidation and subsequent formation of disulfide bonds |
| Gel recovery kit | Promega | A9281 | Isolates and purifies DNA from agarose gels |
| Glycerol | Thermo Fisher Scientific | G33-500 | Used for making glycerol stocks, which are frozen at -80 °C |
| Gravity flow column | BioRad | 7321010 | Used for Ni-NTA purification of recombinantly His-tagged proteins |
| Guanidine hydrochloride (GdnHCl) | Thermo Fisher Scientific | AAA135430B | Second chaotropic agent used for disrupting protein secondary structure. |
| High-transformation efficiency cells | NEB | C2987 | High-transformation efficiency cells with greater chance of success for cloning the N-terminal His-tag into the pET3a-pro-MMP-3cd construct |
| HT Elution Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 250 mM imidazole. Adjust pH to 7.4 |
| HT Equilibration Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea. Adjust pH to 7.4 |
| HT Regeneration Buffer | n/a | n/a | 20 mM MES, 0.1 M NaCl. Adjust pH to 5.0 |
| HT Wash Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 25 mM imidazole. Adjust pH to 7.4 |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | A144C-212 | Used to pH buffers |
| Imidazole | Thermo Fisher Scientific | AAA1022122 | Mimics the histidine side group. Used to separate non-specifically binding proteins from the his-tagged target protein |
| Inclusion Body Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 5 mM DTT, 2% v/v Triton X 100, 0.5 M Urea. Adjust pH to 8.0 |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | FERR0392 | A reagent that induces target gene expression in pET3a. Make 0.5 mL 1 M aliquots, filter sterilize and store in -20 °C |
| LB Amp CamR media | n/a | n/a | To be poured into a sterible 1 L bottle or 1 L flask. For 1 L, add 25 g LB Broth. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Amp CamR plates | n/a | n/a | To be poured into sterile petri dishes. Pour until the petri dish lid is completely covered. 1 L of media yields 40-60 plates. For 1 L: 25 g LB Broth, 16 g Agar. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Broth | Thermo Fisher Scientific | BP1426-2 | Pre-mixed with tryptone, yeast extract, and sodium chloride |
| Lysis Buffer | n/a | n/a | 50 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 0.133 g/mL lysozyme, 0.49% v/v Triton X-100. Adjust pH to 8.0 |
| Lysozyme | MP Biomedicals | 195303 | Used in protein extraction. Enzyme that lyses bacterial cell walls |
| Miniprep kit | Promega | A1330 | If successful, extracts the pET3a-pro-MMP-3cd construct from transformants |
| NdeI | NEB | R0111S | Restriction enzyme to be used with the pET3a vector |
| Ni-NTA resin | Thermo Fisher Scientific | PI88221 | Used to bind recombinant his-tagged proteins. This strong interaction can be displaced with higher concentrations of imidazole |
| PCR mix | NEB | M0492S | A PCR reagent for inserting an N-terminal his-tag into the pET3a-pro-MMP-3cd vector |
| pET plasmid | Addgene | n/a | The pET3a vector offers ampicillin resistance, inducible expression of a target gene, and sequencing with T7 primers |
| Petri dishes | VWR | 25384-342 | Used for plating transformants on LB agar media |
| R2DP cells | Novagen | 714033 | BL21 derivatives with enhanced expression of eukaryotic proteins. Contain tRNAs of codons found to be rare in e. coli |
| SOC growth media | NEB | B9020S | Non-selective growth media for rapid growth during transformation |
| Sodium chloride (NaCl) | Thermo Fisher Scientific | BP358-1 | Used in buffers and helps with protein stability |
| Sodium deoxycholate | Thermo Fisher Scientific | PI89905 | Detergent used in protein extraction. Lyses cell walls |
| Solubilization Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 10 mM DTT, 6 M Urea. Adjust pH to 8.0 |
| Tris base | Thermo Fisher Scientific | BP152-1 | Common buffer used in the physiological pH range. Temperature-sensitive |
| Triton X-100 | Thermo Fisher Scientific | M1122980101 | Detergent used for cell lysis |
| Urea | Thermo Fisher Scientific | AAJ75826A7 | First chaotropic agent for disrupting protein secondary structure |
| Zinc chloride (ZnCl2) | Thermo Fisher Scientific | AAA162810E | Stabilizes MMP structure. The zinc ion is found in the catalytic site of MMP-3 |
References
- Portolano, N., et al. Recombinant protein expression for structural biology in HEK 293F suspension cells: A novel and accessible approach. Journal of Visualized Experiments: JoVE. (92), e51897 (2014).
- Subedi, G. P., Johnson, R. W., Moniz, H. A., Moremen, K. W., Barb, A. High yield expression of recombinant human proteins with the transient transfection of HEK293 cells in suspension. Journal of Visualized Experiments: JoVE. (106), e53568 (2015).
- Nilvebrant, J., Alm, T., Hober, S. Orthogonal protein purification facilitated by a small bispecific affinity tag. Journal of Visualized Experiments: JoVE. (59), e3370 (2012).
- Yang, Z., et al. Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-step-denaturing and refolding method. PLoS One. 6 (7), 22981 (2011).
- Hu, X., Beeton, C. Detection of functional matrix metalloproteinases by zymography. Journal of Visualized Experiments: JoVE. (45), e2445 (2010).
- Radisky, E. S., Raeeszadeh-Sarmazdeh, M., Radisky, D. C. Therapeutic potential of matrix metalloproteinase inhibition in breast cancer. Journal of Cellular Biochemistry. 118 (11), 3531-3548 (2017).
- Raeeszadeh-Sarmazdeh, M., Do, L. D., Hritz, B. G. Metalloproteinases and their inhibitors: Potential for the development of new therapeutics. Cells. 9 (5), 1313 (2020).
- Nagase, H., Visse, R., Murphy, G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular Research. 69 (3), 562-573 (2006).
- Raeeszadeh-Sarmazdeh, M., et al. Directed evolution of the metalloproteinase inhibitor TIMP-1 reveals that its N- and C-terminal domains cooperate in matrix metalloproteinase recognition. Journal of Biological Chemistry. 294 (24), 9476-9488 (2019).
- Batra, J., et al. Matrix metalloproteinase-10 (MMP-10) interaction with tissue inhibitors of metalloproteinases TIMP-1 and TIMP-2. Journal of Biological Chemistry. 287 (19), 15935-15946 (2012).
- Singh, K. K., Jain, R., Ramanan, H., Saini, D. K., Galea, C. A. Expression and purification of matrix metalloproteinases in Escherichia coli. Matrix Metalloproteases. , 3-16 (2017).
- Manka, S. W., et al. Structural insights into triple-helical collagen cleavage by matrix metalloproteinase 1. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12461-12466 (2012).
- Gomis-Ruth, F. X., et al. Mechanism of inhibition of the human matrix metalloproteinase stromelysin-1 by TIMP-1. Nature. 389 (6646), 77-81 (1997).
- Shirian, J., et al. Converting a broad matrix metalloproteinase family inhibitor into a specific inhibitor of MMP-9 and MMP-14. FEBS Letters. 592 (7), 1122-1134 (2018).
- Li, C., et al. Purification of recombinant histidine-tagged catalytic domain of MMP-13 in one step using affinity column and renaturation of it with histidine tag. Journal of Liquid Chromatography & Related Technologies. 37 (15), 2118-2130 (2014).
- Aydin, H., Azimi, F. C., Cook, J. D., Lee, J. E. A convenient and general expression platform for the production of secreted proteins from human cells. Journal of Visualized Experiments: JoVE. (65), e4041 (2012).
- McNiff, M. L., Haynes, E. P., Dixit, N., Gao, F. P., Laurence, J. S. Thioredoxin fusion construct enables high-yield production of soluble, active matrix metalloproteinase-8 (MMP-8) in Escherichia coli. Protein Expression and Purification. 122, 64-71 (2016).
- Maity, R., et al. GST-His purification: A two-step affinity purification protocol yielding full-length purified proteins. Journal of Visualized Experiments: JoVE. (80), e50320 (2013).
- Stefan, A., Ceccarelli, A., Conte, E., Montón Silva, A., Hochkoeppler, A. The multifaceted benefits of protein co-expression in Escherichia coli. Journal of Visualized Experiments: JoVE. (96), e52431 (2015).
- Yadavalli, R., Sam-Yellowe, T. HeLa based cell free expression systems for expression of Plasmodium rhoptry proteins. Journal of Visualized Experiments: JoVE. (100), e52772 (2015).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 magnetosome associated protein MamAΔ41. Journal of Visualized Experiments: JoVE. (37), e1844 (2010).

