Bakterielle Expression und Aufreinigung der humanen Matrix-Metalloproteinase-3 mittels Affinitätschromatographie
Summary
His-Tag-Reinigung, Dialyse und Aktivierung werden eingesetzt, um die Ausbeute an löslicher, aktiver Matrix-Metalloproteinase-3-katalytischer Domänenproteinexpression in Bakterien zu erhöhen. Proteinfraktionen werden über SDS-PAGE-Gele analysiert.
Abstract
Matrix-Metalloproteinasen (MMPs) gehören zur Familie der Metzincinproteasen mit zentralen Rollen beim Abbau und Remodeling der extrazellulären Matrix (ECM) sowie bei Wechselwirkungen mit mehreren Wachstumsfaktoren und Zytokinen. Die Überexpression spezifischer MMPs ist für verschiedene Krankheiten wie Krebs, neurodegenerative Erkrankungen und Herz-Kreislauf-Erkrankungen verantwortlich. MMPs standen in letzter Zeit im Mittelpunkt der Aufmerksamkeit als Ziele für die Entwicklung von Therapeutika, die Krankheiten behandeln können, die mit MMP-Überexpression korrelieren.
Um den MMP-Mechanismus in Lösung zu untersuchen, sind einfachere und robustere rekombinante Proteinexpressions- und Reinigungsmethoden für die Herstellung von aktiven, löslichen MMPs erforderlich. Der katalytische Bereich der meisten MMPs kann jedoch in Escherichia coli (E. coli) aufgrund fehlender posttranslationaler Mechanismen nicht in löslicher Form exprimiert werden, während Expressionssysteme für Säugetiere in der Regel teuer sind und geringere Erträge aufweisen. MMP-Einschlussgremien müssen den langwierigen und mühsamen Prozess der umfangreichen Reinigung und Wiederfaltung durchlaufen, wodurch die Ausbeute an MMPs in der nativen Konformation erheblich reduziert wird. Dieses Papier stellt ein Protokoll vor, das Rosetta2 (DE3) pLysS-Zellen (im Folgenden als R2DP bezeichnet) verwendet, um eine katalytische Matrix-Metalloproteinase-3-Domäne (MMP-3cd) zu erzeugen, die einen N-terminalen His-Tag gefolgt von einer Pro-Domäne (Hisx6-pro-MMP-3cd) für die Verwendung in der Affinitätsreinigung enthält. R2DP-Zellen verstärken die Expression eukaryotischer Proteine durch ein Chloramphenicol-resistentes Plasmid, das Codons enthält, die normalerweise in bakteriellen Expressionssystemen selten sind. Im Vergleich zur traditionellen Zelllinie der Wahl für die rekombinante Proteinexpression, BL21(DE3), verbesserte die Aufreinigung mit diesem neuen Stamm die Ausbeute an gereinigtem Hisx6-pro-MMP-3cd. Nach der Aktivierung und Entsalzung wird die Pro-Domäne zusammen mit dem N-terminalen His-Tag gespalten, wodurch aktives MMP-3cd für den sofortigen Einsatz in unzähligen In-vitro-Anwendungen bereitgestellt wird. Diese Methode erfordert keine teure Ausrüstung oder komplexe Fusionsproteine und beschreibt die schnelle Produktion von rekombinanten menschlichen MMPs in Bakterien.
Introduction
Die meisten komplexen eukaryotischen Proteine durchlaufen nach der Expression ausgeklügelte posttranslationale Modifikationen, die eine hochunterstützte Proteinfaltung und Co-Faktoren erfordern, um funktionsfähig zu sein1. Die Herstellung großer Mengen löslichen menschlichen Proteins in einem bakteriellen Wirt bleibt aufgrund der hohen Kosten und des Mangels an robusten Expressions- und Reinigungsmethoden eine erhebliche Herausforderung, selbst für kleinere Laborexperimente2,3. MMPs, humane Endopeptidasen mit großem Molekulargewicht, werden normalerweise als unlösliche Einschlusskörper exprimiert, wenn sie in E. coli exprimiert werden. Die Extraktion von löslichen humanen MMPs führt oft zu einem mühsamen, zeitaufwändigen Solubilisierungs- und Umfaltungsprozess4.
MMPs spielen eine entscheidende Rolle sowohl in physiologischen als auch in pathogenen Prozessen. Humane MMPs sind eine Familie von 23 Zink-Endopeptidasen, kategorisiert nach Struktur- und Substratspezifität und differentiell exprimiert trotz einer hochkonservierten katalytischen Domäne5,6. MMPs werden als inaktive Zymogene sezerniert, reguliert durch posttranslationale Aktivierung und ihre endogenen Inhibitoren, Gewebeinhibitoren von Metalloproteinasen (TIMPs)7,8,9,10. Obwohl MMPs ursprünglich für ihre Rolle beim ECM-Umsatz anerkannt waren, waren sie auch an der Entwicklung, Morphogenese, Gewebereparatur und -umgestaltung beteiligt8. Die Dysregulation von MMPs wurde unter anderem mit Krebs sowie neurodegenerativen, kardiovaskulären und fibrotischen Erkrankungen in Verbindung gebracht5,7.
Die Entwicklung robuster MMP-Produktionsmethoden im großen Maßstab ist entscheidend, um den Erfolg zukünftiger Studien von MMP-Mechanismen durch biochemische und zellbasierte Assays sicherzustellen. Verschiedene MMPs wurden zuvor in Bakterien exprimiert11, einschließlich Hisx6-markierter MMPs, ohne die MMP-Aktivität zu verändern12,13,14,15. Diese Methoden umfassen jedoch mühsame, lange Schritte, die möglicherweise schwer zu replizieren sind.
Säugetierzellen können auch verwendet werden, um viele verschiedene menschliche Proteine zu exprimieren und gleichzeitig die richtigen posttranslationalen Modifikationen zu gewährleisten16. Obwohl das Expressionssystem für Säugetiere eine ideale Wahl ist, um rekombinante menschliche Proteine mit geeigneten posttranslationalen Modifikationen herzustellen, sind die Hauptnachteile dieser Methode anfänglich niedrige Ausbeuten, kostspielige Wachstumsmedien und Reagenzien, lange Zeiträume zum Erreichen stabiler Mimiklinien und das Risiko einer Kontamination mit anderen Spezies wie Pilzen oder Bakterien2,11 . Darüber hinaus führt die MMP-Produktion in Zelllinien von Säugetieren zu Verunreinigungen aus assoziierten zellulären Proteinen wie TIMPs oder Fibronektinen11. Im Gegensatz zu dem langsamen Zellwachstum, das in Säugetierzellen beobachtet wird, bietet das bakterielle Expressionssystem eine groß angelegte Proteinproduktion in kurzer Zeit sowie einfachere Medien- und Wachstumsanforderungen. Aufgrund des Fehlens anderer assoziierter zellulärer Proteine (d. h. TIMPs) in bakteriellen Expressionssystemen unterliegen aktive MMPs in höheren Konzentrationen jedoch dem Abbau durch Autoproteolyse, was zu einer schlechten MMP-Ausbeute führt17.
Dieses Papier beschreibt eine detaillierte Methode zur bakteriellen Expression, Reinigung und Aktivierung von rekombinantem Hisx6-pro-MMP-3cd unter Verwendung von E. coli als Ausdruckshost aufgrund seiner Erschwinglichkeit, Einfachheit und seines Erfolgs bei der Erzeugung höherer Ausbeuten von MMPs2,3,18. Da E. coli nicht über die Proteinfaltungsmaschinerie und die posttranslationale Verarbeitung verfügt, die für rekombinante MMPs und andere komplexe Proteine erforderlich sind, wurden viele E. coli-Stämme entwickelt, um diese Einschränkungen zu überwinden, was E. coli zu einem geeigneteren Wirt für die Expression von rekombinantem humanem MMP-3cd macht,19,20 . Zum Beispiel verbessert der in dieser Studie verwendete R2DP-Stamm die eukaryotische Expression, indem er ein chloramphenicolresistentes Plasmid liefert, das Codons enthält, die selten in E. coli verwendet werden.
Wie in diesem Protokoll beschrieben, werden nach Überexpression von relativ reinen Einschlusskörpern aus dem pET-3a-Vektor (Abbildung 1) in R2DP-Zellen Hisx6-pro-MMP-3-Proteine (MMP-3cd) extrahiert und denaturiert4. Hisx6-pro-MMP-3cd3,19 wurde mittels Affinitäts-Tag-Chromatographie gereinigt. Nach der Rückfaltung und Dialyse wurde das Pro-MMP-3cd (Zymogen) durch 4-Aminophenylquecksilberacetat (APMA) aktiviert, und die SDS-PAGE-Analyse wird verwendet, um die Ausbeuten und die Notwendigkeit einer weiteren Reinigung zu bewerten5,21. Dieses Protokoll beschreibt als Beispiel den Ausdruck, die Reinigung und die Aktivierung von löslichem MMP-3cd. Es kann jedoch auch als Leitfaden für die Expression anderer MMPs und menschlicher Proteasen mit ähnlicher Expression und Aktivierungsmechanismen verwendet werden (Abbildung 2). Für andere Proteine als MMP-3cd wird dem Leser empfohlen, optimale Pufferzusammensetzungen und -methoden für sein Zielprotein zu bestimmen, bevor er dieses Protokoll versucht.
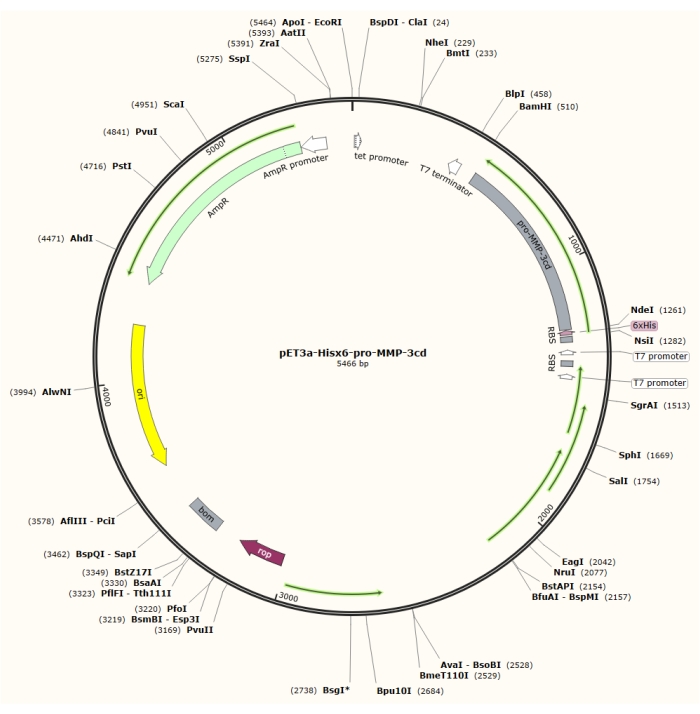
Abbildung 1: Plasmidabbildung des pET-3a-Hisx6-pro-MMP-3cd-Plasmids. Der pET-3a-Vektor enthält ein Ampicillin-Resistenz-Gen. Eine N-terminale Hisx6-Tag-Sequenz wird in den pET-3a-basierten Vektor, einschließlich pro-MMP-3cd, geklont, um das pET-3a-Hisx6-pro-MMP-3cd-Konstrukt unter Kontrolle des T7-Promotors zwischen BamHI- und NdeI-Restriktionssites zu erhalten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
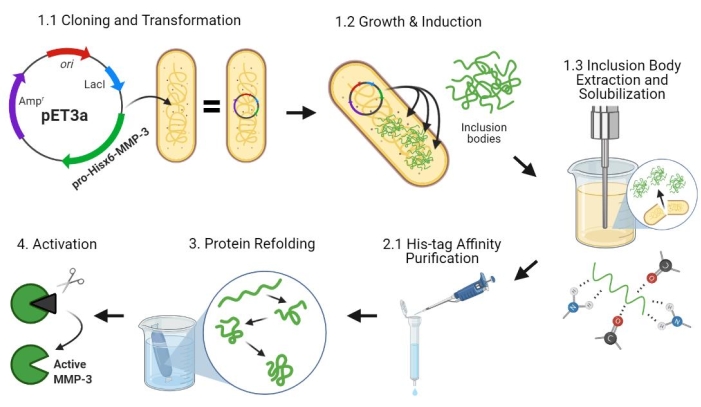
Abbildung 2: Bakterielle Expression von Pro-MMP-3cd, Reinigung, Rückfaltung und Aktivierung . 1.1: pET-3a-Hisx6-pro-MMP-3cd-Plasmid wurde in BL21(DE3)- oder R2DP-Zellen umgewandelt. 1.2: Die Pro-MMP-3cd-Proteinexpression wurde mittels IPTG induziert. 1.3: Chemische Lyse und Beschallung werden verwendet, um Hisx6-pro-MMP-3cd-Proteine zu extrahieren, die hauptsächlich unlöslich sind und in den Einschlusskörpern vorkommen. Harnstoff wurde verwendet, um Protein aus Einschlusskörpern zu denaturieren und zu lösen. 2.1. Das denaturierte Hisx6-pro-MMP-3cd-Protein wurde durch affinitätschromatographische Reinigung gereinigt. 3. Die eluierte Hisx6-pro-MMP-3cd wurde während der Dialyse durch allmähliche Entfernung von Harnstoff aus dem Puffer langsam wieder gefaltet. 4. Schließlich wurde das gefaltete MMP-3cd-Protein mit APMA aktiviert, indem die N-terminale Pro-Peptid-Domäne entfernt wurde. APMA wird später durch Entsalzen aus der Lösung entfernt. Die Zahlen entsprechen den Protokollabschnitten, die diese Schritte beschreiben. Abkürzungen: MMP-3cd = Matrix-Metalloproteinase-3-katalytische Domäne; APMA = 4-Aminophenylquecksilberacetat. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Die großtechnische Produktion von löslichen, humanen, rekombinanten MMPs bleibt eine anspruchsvolle Aufgabe. Säugetierzellen können funktionelle MMPs mit hohen Kosten und langen Wartezeiten exprimieren, während E. coli schnell hohe Mengen an MMP-Einschlusskörpern produzieren, die gereinigt und wieder gefaltet werden müssen11,16. R2DP-Zellen erhöhen die Ausbeute von MMP-Einschlusskörpern signifikant und ermöglichen einen kostengünstigeren und p…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren möchten Dr. Evette Radisky und Alexandra Hockla von der Mayo Clinic in Jacksonville, Florida, für die Bereitstellung des pET-3a-pro-MMP-3cd-Plasmids als Vorlage für die Klonierung des Hisx6pro-MMP-3cd-Gens und ihre Kommentare sowie Dr. Paul Hartley vom Nevada Genomics Center an der University of Nevada, Reno, für die DNA-Sequenzierung danken. Die Autoren möchten auch Cassandra Hergenrader dafür danken, dass sie bei einem Teil der Proteinexpression geholfen hat. M.R.-S. möchte dem NIH-P20 GM103650-COBRE Integrative Neuroscience Grant und dem UNR R&D mICRO SEED Grant Award danken.
Materials
| 0.22 µm sterile filter | Sigma Aldrich | SLGP033RS | Used to remove some contaminants from the protein extract before purification, and prevent the Ni-NTA column from clogging |
| 1 L Erlenmeyer flasks | Thermo Fisher Scientific | S76106F | n/a |
| 1 L glass bottles | Thermo Fisher Scientific | 06-414-1D | n/a |
| 1.5 mL microfuge tubes | Thermo Fisher Scientific | 02-682-002 | n/a |
| 15 mL conical tubes | Thermo Fisher Scientific | 339650 | n/a |
| 18 G, 1-in. beveled needle | Amazon | B07S7VBHM2 | Used in combination with the dialysis casette |
| 2 mL desalting column | Thermo Fisher Scientific | 89890 | Removes APMA following activation |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Thermo Fisher Scientific | AAA1610422 | n/a |
| 250 mL conical bottle cushions | Thermo Fisher Scientific | 05-538-53A | Stabilize conical bottles during large-volume centrifugation |
| 250 mL conical bottles | Thermo Fisher Scientific | 05-538-53 | n/a |
| 400 mL stirred cell | Sigma Aldrich | UFSC40001 | Re-concentrates a much larger volume than the centrifugal filter unit. Rosetta2(DE3)pLysS cells produce high volumes of protein that may exceed the 15 mL limit of the centrifugal filter unit |
| 4-aminophenylmercuric acetate (APMA) | Sigma Aldrich | A9563-5G | Activates MMP-3 by cleaving the propeptide |
| 5 mL syringe | Thermo Fisher Scientific | NC0829167 | Used in combination with the dialysis casette |
| 50 mL conical tubes | Thermo Fisher Scientific | 339650 | Used for storage in many purification steps |
| 50 mL re-concentration tube | Sigma Aldrich | UFC901024D | Used for re-concentrating protein samples after dialysis or removing contaminants |
| Agar | Thermo Fisher Scientific | BP1423-500 | Buffer ingredient that solidifies autoclaved LB media upon cooling |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | Antibiotic used with pET3a vector; used at 100 µg/mL in LB media |
| BamHI | NEB | R3136S | Restriction enzyme to be used with the pET3a vector |
| Calcium chloride (CaCl2) | Thermo Fisher Scientific | 600-30-23 | The calcium ion stabilizes MMP structure |
| Cell spreaders | Thermo Fisher Scientific | 50-189-7544 | Can be used to spread cells across a petri dish after transformation |
| Chloramphenicol | Thermo Fisher Scientific | 22-055-125GM | Antibiotic used with pET3a vector; used at 34 µg/mL in LB media |
| Dialysis Buffer 1 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 4 M Urea. |
| Dialysis Buffer 2 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 2 M Urea. |
| Dialysis Buffer 3 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2 , 1 µM ZnCl2. |
| Dialysis clips | Thermo Fisher Scientific | 68011 | Used in combination with snakeskin dialysis tubing |
| Dialysis tubing | Thermo Fisher Scientific | 88243 | Alternative dialysis method that holds much larger sample volumes, but with higher risk of sample loss |
| Digest buffer | NEB | B7204S | Buffer used in digesting the pET3a vector |
| Disposable cuvettes | Thermo Fisher Scientific | 21-200-257 | Used to measure the bacterial culture OD during growth and expression |
| Dithiothreitol (DTT) | Thermo Fisher Scientific | D107125G | Assists with protein denaturation by reducing any disulfide bonds |
| DNA assembly mix | NEB | E2621S | Used to ligate the Hisx6-pro-MMP-3cd PCR product and digested pET3a vector |
| DNase I | NEB | M0303S | Endonuclease for degrading unfavorable DNA contaminants that could later affect protein purification |
| Ethanol | Thermo Fisher Scientific | A995-4 | n/a |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Fisher Scientific | J15694-AE | Used in denaturation. Prevents oxidation and subsequent formation of disulfide bonds |
| Gel recovery kit | Promega | A9281 | Isolates and purifies DNA from agarose gels |
| Glycerol | Thermo Fisher Scientific | G33-500 | Used for making glycerol stocks, which are frozen at -80 °C |
| Gravity flow column | BioRad | 7321010 | Used for Ni-NTA purification of recombinantly His-tagged proteins |
| Guanidine hydrochloride (GdnHCl) | Thermo Fisher Scientific | AAA135430B | Second chaotropic agent used for disrupting protein secondary structure. |
| High-transformation efficiency cells | NEB | C2987 | High-transformation efficiency cells with greater chance of success for cloning the N-terminal His-tag into the pET3a-pro-MMP-3cd construct |
| HT Elution Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 250 mM imidazole. Adjust pH to 7.4 |
| HT Equilibration Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea. Adjust pH to 7.4 |
| HT Regeneration Buffer | n/a | n/a | 20 mM MES, 0.1 M NaCl. Adjust pH to 5.0 |
| HT Wash Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 25 mM imidazole. Adjust pH to 7.4 |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | A144C-212 | Used to pH buffers |
| Imidazole | Thermo Fisher Scientific | AAA1022122 | Mimics the histidine side group. Used to separate non-specifically binding proteins from the his-tagged target protein |
| Inclusion Body Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 5 mM DTT, 2% v/v Triton X 100, 0.5 M Urea. Adjust pH to 8.0 |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | FERR0392 | A reagent that induces target gene expression in pET3a. Make 0.5 mL 1 M aliquots, filter sterilize and store in -20 °C |
| LB Amp CamR media | n/a | n/a | To be poured into a sterible 1 L bottle or 1 L flask. For 1 L, add 25 g LB Broth. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Amp CamR plates | n/a | n/a | To be poured into sterile petri dishes. Pour until the petri dish lid is completely covered. 1 L of media yields 40-60 plates. For 1 L: 25 g LB Broth, 16 g Agar. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Broth | Thermo Fisher Scientific | BP1426-2 | Pre-mixed with tryptone, yeast extract, and sodium chloride |
| Lysis Buffer | n/a | n/a | 50 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 0.133 g/mL lysozyme, 0.49% v/v Triton X-100. Adjust pH to 8.0 |
| Lysozyme | MP Biomedicals | 195303 | Used in protein extraction. Enzyme that lyses bacterial cell walls |
| Miniprep kit | Promega | A1330 | If successful, extracts the pET3a-pro-MMP-3cd construct from transformants |
| NdeI | NEB | R0111S | Restriction enzyme to be used with the pET3a vector |
| Ni-NTA resin | Thermo Fisher Scientific | PI88221 | Used to bind recombinant his-tagged proteins. This strong interaction can be displaced with higher concentrations of imidazole |
| PCR mix | NEB | M0492S | A PCR reagent for inserting an N-terminal his-tag into the pET3a-pro-MMP-3cd vector |
| pET plasmid | Addgene | n/a | The pET3a vector offers ampicillin resistance, inducible expression of a target gene, and sequencing with T7 primers |
| Petri dishes | VWR | 25384-342 | Used for plating transformants on LB agar media |
| R2DP cells | Novagen | 714033 | BL21 derivatives with enhanced expression of eukaryotic proteins. Contain tRNAs of codons found to be rare in e. coli |
| SOC growth media | NEB | B9020S | Non-selective growth media for rapid growth during transformation |
| Sodium chloride (NaCl) | Thermo Fisher Scientific | BP358-1 | Used in buffers and helps with protein stability |
| Sodium deoxycholate | Thermo Fisher Scientific | PI89905 | Detergent used in protein extraction. Lyses cell walls |
| Solubilization Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 10 mM DTT, 6 M Urea. Adjust pH to 8.0 |
| Tris base | Thermo Fisher Scientific | BP152-1 | Common buffer used in the physiological pH range. Temperature-sensitive |
| Triton X-100 | Thermo Fisher Scientific | M1122980101 | Detergent used for cell lysis |
| Urea | Thermo Fisher Scientific | AAJ75826A7 | First chaotropic agent for disrupting protein secondary structure |
| Zinc chloride (ZnCl2) | Thermo Fisher Scientific | AAA162810E | Stabilizes MMP structure. The zinc ion is found in the catalytic site of MMP-3 |
References
- Portolano, N., et al. Recombinant protein expression for structural biology in HEK 293F suspension cells: A novel and accessible approach. Journal of Visualized Experiments: JoVE. (92), e51897 (2014).
- Subedi, G. P., Johnson, R. W., Moniz, H. A., Moremen, K. W., Barb, A. High yield expression of recombinant human proteins with the transient transfection of HEK293 cells in suspension. Journal of Visualized Experiments: JoVE. (106), e53568 (2015).
- Nilvebrant, J., Alm, T., Hober, S. Orthogonal protein purification facilitated by a small bispecific affinity tag. Journal of Visualized Experiments: JoVE. (59), e3370 (2012).
- Yang, Z., et al. Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-step-denaturing and refolding method. PLoS One. 6 (7), 22981 (2011).
- Hu, X., Beeton, C. Detection of functional matrix metalloproteinases by zymography. Journal of Visualized Experiments: JoVE. (45), e2445 (2010).
- Radisky, E. S., Raeeszadeh-Sarmazdeh, M., Radisky, D. C. Therapeutic potential of matrix metalloproteinase inhibition in breast cancer. Journal of Cellular Biochemistry. 118 (11), 3531-3548 (2017).
- Raeeszadeh-Sarmazdeh, M., Do, L. D., Hritz, B. G. Metalloproteinases and their inhibitors: Potential for the development of new therapeutics. Cells. 9 (5), 1313 (2020).
- Nagase, H., Visse, R., Murphy, G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular Research. 69 (3), 562-573 (2006).
- Raeeszadeh-Sarmazdeh, M., et al. Directed evolution of the metalloproteinase inhibitor TIMP-1 reveals that its N- and C-terminal domains cooperate in matrix metalloproteinase recognition. Journal of Biological Chemistry. 294 (24), 9476-9488 (2019).
- Batra, J., et al. Matrix metalloproteinase-10 (MMP-10) interaction with tissue inhibitors of metalloproteinases TIMP-1 and TIMP-2. Journal of Biological Chemistry. 287 (19), 15935-15946 (2012).
- Singh, K. K., Jain, R., Ramanan, H., Saini, D. K., Galea, C. A. Expression and purification of matrix metalloproteinases in Escherichia coli. Matrix Metalloproteases. , 3-16 (2017).
- Manka, S. W., et al. Structural insights into triple-helical collagen cleavage by matrix metalloproteinase 1. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12461-12466 (2012).
- Gomis-Ruth, F. X., et al. Mechanism of inhibition of the human matrix metalloproteinase stromelysin-1 by TIMP-1. Nature. 389 (6646), 77-81 (1997).
- Shirian, J., et al. Converting a broad matrix metalloproteinase family inhibitor into a specific inhibitor of MMP-9 and MMP-14. FEBS Letters. 592 (7), 1122-1134 (2018).
- Li, C., et al. Purification of recombinant histidine-tagged catalytic domain of MMP-13 in one step using affinity column and renaturation of it with histidine tag. Journal of Liquid Chromatography & Related Technologies. 37 (15), 2118-2130 (2014).
- Aydin, H., Azimi, F. C., Cook, J. D., Lee, J. E. A convenient and general expression platform for the production of secreted proteins from human cells. Journal of Visualized Experiments: JoVE. (65), e4041 (2012).
- McNiff, M. L., Haynes, E. P., Dixit, N., Gao, F. P., Laurence, J. S. Thioredoxin fusion construct enables high-yield production of soluble, active matrix metalloproteinase-8 (MMP-8) in Escherichia coli. Protein Expression and Purification. 122, 64-71 (2016).
- Maity, R., et al. GST-His purification: A two-step affinity purification protocol yielding full-length purified proteins. Journal of Visualized Experiments: JoVE. (80), e50320 (2013).
- Stefan, A., Ceccarelli, A., Conte, E., Montón Silva, A., Hochkoeppler, A. The multifaceted benefits of protein co-expression in Escherichia coli. Journal of Visualized Experiments: JoVE. (96), e52431 (2015).
- Yadavalli, R., Sam-Yellowe, T. HeLa based cell free expression systems for expression of Plasmodium rhoptry proteins. Journal of Visualized Experiments: JoVE. (100), e52772 (2015).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 magnetosome associated protein MamAΔ41. Journal of Visualized Experiments: JoVE. (37), e1844 (2010).

