Бактериальная экспрессия и очистка металлопротеиназы-3 матрицы человека с помощью аффинной хроматографии
Summary
Его-меточная очистка, диализ и активация используются для повышения выхода растворимой, активной матриксной металлопротеиназы-3 каталитического домена экспрессии белка у бактерий. Белковые фракции анализируются с помощью гелей SDS-PAGE.
Abstract
Матриксные металлопротеиназы (MMP) принадлежат к семейству протеаз метцинцина с центральной ролью в деградации и ремоделировании внеклеточного матрикса (ECM), а также взаимодействиях с несколькими факторами роста и цитокинами. Сверхэкспрессия специфических MMP ответственна за несколько заболеваний, таких как рак, нейродегенеративные заболевания и сердечно-сосудистые заболевания. В последнее время MMP находятся в центре внимания в качестве мишеней для разработки терапевтических средств, которые могут лечить заболевания, коррелирующие с гиперэкспрессией MMP.
Для изучения механизма MMP в растворе необходимы более легкие и надежные методы экспрессии и очистки рекомбинантного белка для производства активных, растворимых MMP. Однако каталитический домен большинства MMP не может быть выражен в Escherichia coli (E. coli) в растворимой форме из-за отсутствия посттрансляционного механизма, тогда как системы экспрессии млекопитающих обычно являются дорогостоящими и имеют более низкие выходы. Органы включения MMP должны пройти утомительный и трудоемкий процесс обширной очистки и переворачивания, значительно снижая выход MMP в нативной конформации. В данной работе представлен протокол с использованием клеток Rosetta2(DE3)pLysS (далее именуемых R2DP) для получения матричного металлопротеиназы-3 каталитического домена (MMP-3cd), который содержит N-концевую His-метку, за которой следует про-домен (Hisx6-pro-MMP-3cd) для использования в аффинной очистке. Клетки R2DP усиливают экспрессию эукариотических белков через резистентную к хлорамфениколу плазмиду, содержащую кодоны, обычно редкие в системах экспрессии бактерий. По сравнению с традиционной клеточной линией выбора для экспрессии рекомбинантного белка, BL21(DE3), очистка с использованием этого нового штамма улучшила выход очищенного Hisx6-pro-MMP-3cd. После активации и обессоливания домен pro расщепляется вместе с N-терминалом His-tag, обеспечивая активный MMP-3cd для немедленного использования в бесчисленных приложениях in vitro . Этот метод не требует дорогостоящего оборудования или сложного слияния белков и описывает быстрое производство рекомбинантных человеческих MMP в бактериях.
Introduction
Большинство сложных эукариотических белков подвергаются сложным посттрансляционным модификациям после экспрессии, требуя высокоэффективного сворачивания белка и кофакторов, чтобы быть функциональными1. Производство большого количества растворимого человеческого белка в бактериальном хозяине остается серьезной проблемой из-за высоких затрат и отсутствия надежных методов экспрессии и очистки, даже для небольших лабораторных экспериментов2,3. MMP, эндопептидазы человека с большой молекулярной массой, обычно экспрессируются в виде нерастворимых тел включения при экспрессии в E. coli. Экстракция растворимых человеческих MMP часто приводит к трудоемкому, трудоемкому процессу солюбилизации и повторного складывания4.
MMP играют решающую роль как в физиологических, так и в патогенных процессах. Человеческие MMP представляют собой семейство из 23 эндопептидаз цинка, классифицированных по структуре и специфичности субстрата и дифференциально выраженных, несмотря на высокосохраняемый каталитический домен5,6. ММП секретируются в виде неактивных зимогенов, регулируемых посредством посттрансляционной активации и их эндогенных ингибиторов, тканевых ингибиторов металлопротеиназ (ТИМП)7,8,9,10. Хотя первоначально признана их роль в обороте ECM, MMP также были вовлечены в разработку, морфогенез, восстановление тканей и ремоделирование8. Дисрегуляция MMP была особенно связана с раком наряду с нейродегенеративными, сердечно-сосудистыми и фиброзными заболеваниями, среди других заболеваний5,7.
Разработка надежных крупномасштабных методов производства MMP имеет решающее значение для обеспечения успеха будущих исследований механизмов MMP с помощью биохимических и клеточных анализов. Различные MMP ранее экспрессировались в бактериях11, включая MMP с тегами Hisx6, без изменения активности MMP12,13,14,15. Однако эти методы включают утомительные, длительные шаги, которые может быть трудно воспроизвести.
Клетки млекопитающих также могут быть использованы для экспрессии многих различных человеческих белков, обеспечивая при этом надлежащие посттрансляционные модификации16. Хотя система экспрессии млекопитающих является идеальным выбором для получения рекомбинантных человеческих белков с надлежащими посттрансляционными модификациями, основными недостатками этого метода являются начальные низкие выходы, дорогостоящие питательные среды и реагенты, длительные сроки достижения стабильных линий экспрессии и риск заражения другими видами, такими как грибы или бактерии2,11 . Кроме того, производство MMP в клеточных линиях млекопитающих дает примеси из ассоциированных клеточных белков, таких как TIMPs или фибронектины11. В отличие от медленного роста клеток, наблюдаемого в клетках млекопитающих, система экспрессии бактерий предлагает крупномасштабное производство белка за короткий период времени наряду с более простыми средами и потребностями роста. Однако из-за отсутствия других ассоциированных клеточных белков (т.е. ТИМП) в системах экспрессии бактерий активные MMP в более высоких концентрациях подвергаются деградации в результате аутопротеолиза, что приводит к низкому выходу MMP17.
В данной работе описан подробный метод бактериальной экспрессии, очистки и активации рекомбинантного Hisx6-pro-MMP-3cd с использованием E. coli в качестве хозяина экспрессии благодаря его доступности, простоте и успеху в получении более высоких выходов MMP2,3,18. Поскольку E. coli не имеет механизма сворачивания белка и посттрансляционной обработки, необходимых для рекомбинантных MMP и других сложных белков, многие штаммы E. coli были разработаны для преодоления этих ограничений, что делает E. coli более подходящим хозяином для экспрессии рекомбинантного человеческого MMP-3cd,19,20 . Например, штамм R2DP, используемый в этом исследовании, усиливает эукариотическую экспрессию, поставляя резистентную к хлорамфениколу плазмиду, содержащую кодоны, редко используемые в E. coli.
Как описано в этом протоколе, после сверхэкспрессии относительно чистых тел включения из вектора pET-3a (рисунок 1) в клетках R2DP белки каталитического домена Hisx6-pro-MMP-3 (MMP-3cd) экстрагируются и денатурируются4. Hisx6-pro-MMP-3cd3,19 очищали с помощью аффинной метки хроматографии. При рефолдинге и диализе про-MMP-3cd (зимоген) активировали 4-аминофенилртумучевым ацетатом (APMA), а анализ SDS-PAGE используется для оценки выходов и необходимости дальнейшей очистки5,21. Этот протокол описывает экспрессию, очистку и активацию растворимого MMP-3cd в качестве примера. Тем не менее, он также может быть использован в качестве руководства для экспрессии других MMP и человеческих протеаз с аналогичной экспрессией и механизмами активации (рисунок 2). Для других белков, отличных от MMP-3cd, читателю рекомендуется определить оптимальные буферные композиции и методы для их целевого белка, прежде чем пытаться использовать этот протокол.
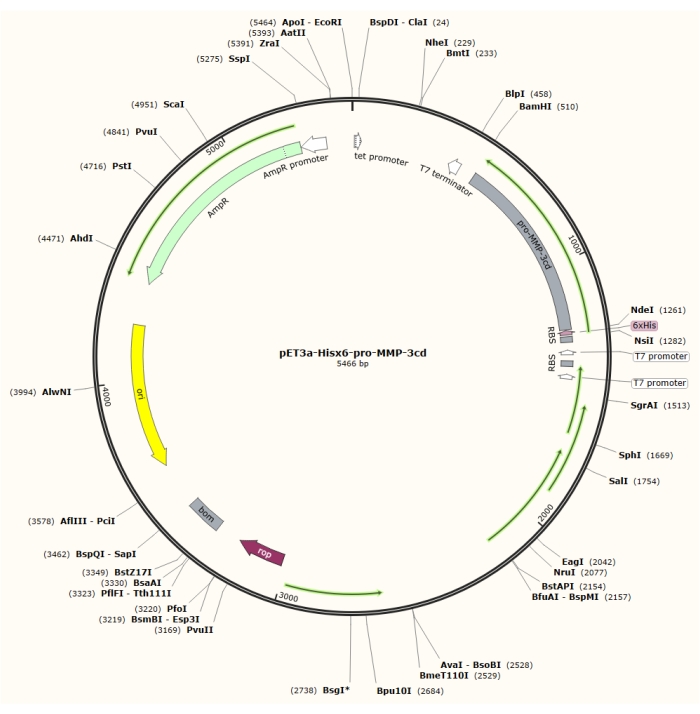
Рисунок 1: Плазмидная карта плазмиды pET-3a-Hisx6-pro-MMP-3cd. Вектор pET-3a включает ген устойчивости к ампициллину. N-концевая последовательность Hisx6-tag клонируется в вектор на основе pET-3a, включая pro-MMP-3cd, чтобы получить конструкцию pET-3a-Hisx6-pro-MMP-3cd под контролем промотора T7 между сайтами ограничения BamHI и NdeI. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
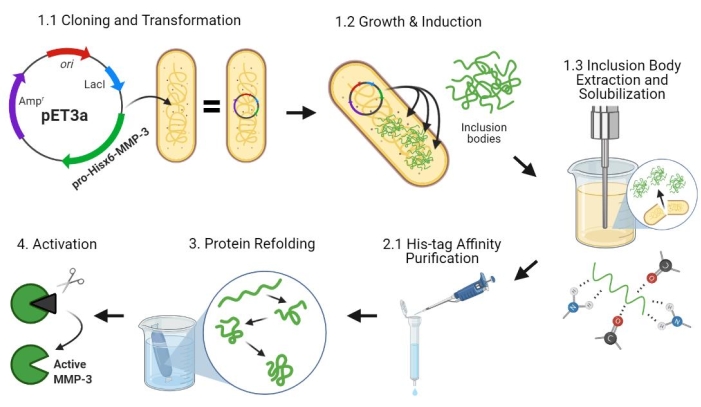
Рисунок 2: Бактериальная экспрессия про-MMP-3cd, очистка, рефолдация и активация. 1.1: плазмида pET-3a-Hisx6-pro-MMP-3cd трансформировалась в клетки BL21(DE3) или R2DP. 1.2: Экспрессия белка Pro-MMP-3cd была индуцирована с использованием IPTG. 1.3: Химический лизис и обработка ультразвуком используются для извлечения белков Hisx6-pro-MMP-3cd, которые в основном нерастворимы и обнаруживаются в телах включения. Мочевина использовалась для денатурации и солюбилизации белка из тел включения. 2.1. Денатурированный белок Hisx6-pro-MMP-3cd очищали с помощью аффинной хроматографической очистки. 3. Элюированный Hisx6-pro-MMP-3cd медленно переворачивался во время диализа путем постепенного удаления мочевины из буфера. 4. Наконец, восстановленный белок MMP-3cd был активирован с использованием APMA путем удаления N-концевого пропептидного домена. APMA позже удаляется из раствора путем обессоливания. Номера соответствуют разделам протокола, описывающим эти шаги. Сокращения: MMP-3cd = Матричный металлопротеиназы-3 каталитический домен; APMA = 4-аминофенилртутный ацетат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Крупномасштабное производство растворимых, человеческих, рекомбинантных MMP остается сложной задачей. Клетки млекопитающих могут экспрессировать функциональные MMP при высоких затратах и длительном времени ожидания, тогда как E. coli быстро производит большое количество тел включен…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Авторы хотели бы поблагодарить доктора Эветт Радиски и Александру Хокла из клиники Майо в Джексонвилле, штат Флорида, за предоставление плазмиды pET-3a-pro-MMP-3cd в качестве шаблона для клонирования гена Hisx6pro-MMP-3cd, и их комментарии вместе с доктором Полом Хартли из Центра геномики Невады в Университете Невады, Рино, для секвенирования ДНК. Авторы также хотели бы поблагодарить Кассандру Хергенрайдер за помощь с частью экспрессии белка. М.Р.-С. хотели бы поблагодарить грант NIH-P20 GM103650-COBRE Integrative Neuroscience и грант UNR R&D mICRO SEED Grant Award.
Materials
| 0.22 µm sterile filter | Sigma Aldrich | SLGP033RS | Used to remove some contaminants from the protein extract before purification, and prevent the Ni-NTA column from clogging |
| 1 L Erlenmeyer flasks | Thermo Fisher Scientific | S76106F | n/a |
| 1 L glass bottles | Thermo Fisher Scientific | 06-414-1D | n/a |
| 1.5 mL microfuge tubes | Thermo Fisher Scientific | 02-682-002 | n/a |
| 15 mL conical tubes | Thermo Fisher Scientific | 339650 | n/a |
| 18 G, 1-in. beveled needle | Amazon | B07S7VBHM2 | Used in combination with the dialysis casette |
| 2 mL desalting column | Thermo Fisher Scientific | 89890 | Removes APMA following activation |
| 2-(N-Morpholino)ethanesulfonic acid (MES) | Thermo Fisher Scientific | AAA1610422 | n/a |
| 250 mL conical bottle cushions | Thermo Fisher Scientific | 05-538-53A | Stabilize conical bottles during large-volume centrifugation |
| 250 mL conical bottles | Thermo Fisher Scientific | 05-538-53 | n/a |
| 400 mL stirred cell | Sigma Aldrich | UFSC40001 | Re-concentrates a much larger volume than the centrifugal filter unit. Rosetta2(DE3)pLysS cells produce high volumes of protein that may exceed the 15 mL limit of the centrifugal filter unit |
| 4-aminophenylmercuric acetate (APMA) | Sigma Aldrich | A9563-5G | Activates MMP-3 by cleaving the propeptide |
| 5 mL syringe | Thermo Fisher Scientific | NC0829167 | Used in combination with the dialysis casette |
| 50 mL conical tubes | Thermo Fisher Scientific | 339650 | Used for storage in many purification steps |
| 50 mL re-concentration tube | Sigma Aldrich | UFC901024D | Used for re-concentrating protein samples after dialysis or removing contaminants |
| Agar | Thermo Fisher Scientific | BP1423-500 | Buffer ingredient that solidifies autoclaved LB media upon cooling |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | Antibiotic used with pET3a vector; used at 100 µg/mL in LB media |
| BamHI | NEB | R3136S | Restriction enzyme to be used with the pET3a vector |
| Calcium chloride (CaCl2) | Thermo Fisher Scientific | 600-30-23 | The calcium ion stabilizes MMP structure |
| Cell spreaders | Thermo Fisher Scientific | 50-189-7544 | Can be used to spread cells across a petri dish after transformation |
| Chloramphenicol | Thermo Fisher Scientific | 22-055-125GM | Antibiotic used with pET3a vector; used at 34 µg/mL in LB media |
| Dialysis Buffer 1 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 4 M Urea. |
| Dialysis Buffer 2 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2, 1 µM ZnCl2, 2 M Urea. |
| Dialysis Buffer 3 | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 150 mM NaCl, 10 mM CaCl2 , 1 µM ZnCl2. |
| Dialysis clips | Thermo Fisher Scientific | 68011 | Used in combination with snakeskin dialysis tubing |
| Dialysis tubing | Thermo Fisher Scientific | 88243 | Alternative dialysis method that holds much larger sample volumes, but with higher risk of sample loss |
| Digest buffer | NEB | B7204S | Buffer used in digesting the pET3a vector |
| Disposable cuvettes | Thermo Fisher Scientific | 21-200-257 | Used to measure the bacterial culture OD during growth and expression |
| Dithiothreitol (DTT) | Thermo Fisher Scientific | D107125G | Assists with protein denaturation by reducing any disulfide bonds |
| DNA assembly mix | NEB | E2621S | Used to ligate the Hisx6-pro-MMP-3cd PCR product and digested pET3a vector |
| DNase I | NEB | M0303S | Endonuclease for degrading unfavorable DNA contaminants that could later affect protein purification |
| Ethanol | Thermo Fisher Scientific | A995-4 | n/a |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Fisher Scientific | J15694-AE | Used in denaturation. Prevents oxidation and subsequent formation of disulfide bonds |
| Gel recovery kit | Promega | A9281 | Isolates and purifies DNA from agarose gels |
| Glycerol | Thermo Fisher Scientific | G33-500 | Used for making glycerol stocks, which are frozen at -80 °C |
| Gravity flow column | BioRad | 7321010 | Used for Ni-NTA purification of recombinantly His-tagged proteins |
| Guanidine hydrochloride (GdnHCl) | Thermo Fisher Scientific | AAA135430B | Second chaotropic agent used for disrupting protein secondary structure. |
| High-transformation efficiency cells | NEB | C2987 | High-transformation efficiency cells with greater chance of success for cloning the N-terminal His-tag into the pET3a-pro-MMP-3cd construct |
| HT Elution Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 250 mM imidazole. Adjust pH to 7.4 |
| HT Equilibration Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea. Adjust pH to 7.4 |
| HT Regeneration Buffer | n/a | n/a | 20 mM MES, 0.1 M NaCl. Adjust pH to 5.0 |
| HT Wash Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 6 M urea, 25 mM imidazole. Adjust pH to 7.4 |
| Hydrochloric acid (HCl) | Thermo Fisher Scientific | A144C-212 | Used to pH buffers |
| Imidazole | Thermo Fisher Scientific | AAA1022122 | Mimics the histidine side group. Used to separate non-specifically binding proteins from the his-tagged target protein |
| Inclusion Body Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 5 mM DTT, 2% v/v Triton X 100, 0.5 M Urea. Adjust pH to 8.0 |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Thermo Fisher Scientific | FERR0392 | A reagent that induces target gene expression in pET3a. Make 0.5 mL 1 M aliquots, filter sterilize and store in -20 °C |
| LB Amp CamR media | n/a | n/a | To be poured into a sterible 1 L bottle or 1 L flask. For 1 L, add 25 g LB Broth. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Amp CamR plates | n/a | n/a | To be poured into sterile petri dishes. Pour until the petri dish lid is completely covered. 1 L of media yields 40-60 plates. For 1 L: 25 g LB Broth, 16 g Agar. Sterilize by autoclaving. Once cooled to below 50 °C, add ampicillin to 100 µg/mL and chloramphenicol to 34 µg/mL |
| LB Broth | Thermo Fisher Scientific | BP1426-2 | Pre-mixed with tryptone, yeast extract, and sodium chloride |
| Lysis Buffer | n/a | n/a | 50 mM Tris-HCl (pH 8.0), 1 mM EDTA, 100 mM NaCl, 0.133 g/mL lysozyme, 0.49% v/v Triton X-100. Adjust pH to 8.0 |
| Lysozyme | MP Biomedicals | 195303 | Used in protein extraction. Enzyme that lyses bacterial cell walls |
| Miniprep kit | Promega | A1330 | If successful, extracts the pET3a-pro-MMP-3cd construct from transformants |
| NdeI | NEB | R0111S | Restriction enzyme to be used with the pET3a vector |
| Ni-NTA resin | Thermo Fisher Scientific | PI88221 | Used to bind recombinant his-tagged proteins. This strong interaction can be displaced with higher concentrations of imidazole |
| PCR mix | NEB | M0492S | A PCR reagent for inserting an N-terminal his-tag into the pET3a-pro-MMP-3cd vector |
| pET plasmid | Addgene | n/a | The pET3a vector offers ampicillin resistance, inducible expression of a target gene, and sequencing with T7 primers |
| Petri dishes | VWR | 25384-342 | Used for plating transformants on LB agar media |
| R2DP cells | Novagen | 714033 | BL21 derivatives with enhanced expression of eukaryotic proteins. Contain tRNAs of codons found to be rare in e. coli |
| SOC growth media | NEB | B9020S | Non-selective growth media for rapid growth during transformation |
| Sodium chloride (NaCl) | Thermo Fisher Scientific | BP358-1 | Used in buffers and helps with protein stability |
| Sodium deoxycholate | Thermo Fisher Scientific | PI89905 | Detergent used in protein extraction. Lyses cell walls |
| Solubilization Buffer | n/a | n/a | 20 mM Tris-HCl (pH 8.0), 50 mM NaCl, 10 mM DTT, 6 M Urea. Adjust pH to 8.0 |
| Tris base | Thermo Fisher Scientific | BP152-1 | Common buffer used in the physiological pH range. Temperature-sensitive |
| Triton X-100 | Thermo Fisher Scientific | M1122980101 | Detergent used for cell lysis |
| Urea | Thermo Fisher Scientific | AAJ75826A7 | First chaotropic agent for disrupting protein secondary structure |
| Zinc chloride (ZnCl2) | Thermo Fisher Scientific | AAA162810E | Stabilizes MMP structure. The zinc ion is found in the catalytic site of MMP-3 |
References
- Portolano, N., et al. Recombinant protein expression for structural biology in HEK 293F suspension cells: A novel and accessible approach. Journal of Visualized Experiments: JoVE. (92), e51897 (2014).
- Subedi, G. P., Johnson, R. W., Moniz, H. A., Moremen, K. W., Barb, A. High yield expression of recombinant human proteins with the transient transfection of HEK293 cells in suspension. Journal of Visualized Experiments: JoVE. (106), e53568 (2015).
- Nilvebrant, J., Alm, T., Hober, S. Orthogonal protein purification facilitated by a small bispecific affinity tag. Journal of Visualized Experiments: JoVE. (59), e3370 (2012).
- Yang, Z., et al. Highly efficient production of soluble proteins from insoluble inclusion bodies by a two-step-denaturing and refolding method. PLoS One. 6 (7), 22981 (2011).
- Hu, X., Beeton, C. Detection of functional matrix metalloproteinases by zymography. Journal of Visualized Experiments: JoVE. (45), e2445 (2010).
- Radisky, E. S., Raeeszadeh-Sarmazdeh, M., Radisky, D. C. Therapeutic potential of matrix metalloproteinase inhibition in breast cancer. Journal of Cellular Biochemistry. 118 (11), 3531-3548 (2017).
- Raeeszadeh-Sarmazdeh, M., Do, L. D., Hritz, B. G. Metalloproteinases and their inhibitors: Potential for the development of new therapeutics. Cells. 9 (5), 1313 (2020).
- Nagase, H., Visse, R., Murphy, G. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular Research. 69 (3), 562-573 (2006).
- Raeeszadeh-Sarmazdeh, M., et al. Directed evolution of the metalloproteinase inhibitor TIMP-1 reveals that its N- and C-terminal domains cooperate in matrix metalloproteinase recognition. Journal of Biological Chemistry. 294 (24), 9476-9488 (2019).
- Batra, J., et al. Matrix metalloproteinase-10 (MMP-10) interaction with tissue inhibitors of metalloproteinases TIMP-1 and TIMP-2. Journal of Biological Chemistry. 287 (19), 15935-15946 (2012).
- Singh, K. K., Jain, R., Ramanan, H., Saini, D. K., Galea, C. A. Expression and purification of matrix metalloproteinases in Escherichia coli. Matrix Metalloproteases. , 3-16 (2017).
- Manka, S. W., et al. Structural insights into triple-helical collagen cleavage by matrix metalloproteinase 1. Proceedings of the National Academy of Sciences of the United States of America. 109 (31), 12461-12466 (2012).
- Gomis-Ruth, F. X., et al. Mechanism of inhibition of the human matrix metalloproteinase stromelysin-1 by TIMP-1. Nature. 389 (6646), 77-81 (1997).
- Shirian, J., et al. Converting a broad matrix metalloproteinase family inhibitor into a specific inhibitor of MMP-9 and MMP-14. FEBS Letters. 592 (7), 1122-1134 (2018).
- Li, C., et al. Purification of recombinant histidine-tagged catalytic domain of MMP-13 in one step using affinity column and renaturation of it with histidine tag. Journal of Liquid Chromatography & Related Technologies. 37 (15), 2118-2130 (2014).
- Aydin, H., Azimi, F. C., Cook, J. D., Lee, J. E. A convenient and general expression platform for the production of secreted proteins from human cells. Journal of Visualized Experiments: JoVE. (65), e4041 (2012).
- McNiff, M. L., Haynes, E. P., Dixit, N., Gao, F. P., Laurence, J. S. Thioredoxin fusion construct enables high-yield production of soluble, active matrix metalloproteinase-8 (MMP-8) in Escherichia coli. Protein Expression and Purification. 122, 64-71 (2016).
- Maity, R., et al. GST-His purification: A two-step affinity purification protocol yielding full-length purified proteins. Journal of Visualized Experiments: JoVE. (80), e50320 (2013).
- Stefan, A., Ceccarelli, A., Conte, E., Montón Silva, A., Hochkoeppler, A. The multifaceted benefits of protein co-expression in Escherichia coli. Journal of Visualized Experiments: JoVE. (96), e52431 (2015).
- Yadavalli, R., Sam-Yellowe, T. HeLa based cell free expression systems for expression of Plasmodium rhoptry proteins. Journal of Visualized Experiments: JoVE. (100), e52772 (2015).
- Zeytuni, N., Zarivach, R. Purification of the M. magneticum strain AMB-1 magnetosome associated protein MamAΔ41. Journal of Visualized Experiments: JoVE. (37), e1844 (2010).

