Tekniske antivirale midler via overflateplasmonresonans
Summary
Denne protokollen beskriver nye verktøy for SPR-bindingsanalyser for å undersøke CV-N-binding til HA, S-glykoprotein, relaterte hybrid-type glykaner og oligosakkarider med høy mannose. SPR brukes til å bestemme KD for binding av enten dimerisk eller monomer CV-N til disse glykanene.
Abstract
Overflateplasmonresonans (SPR) brukes til å måle hemagglutinin (HA) binding til domenebyttet Cyanovirin-N (CV-N) dimer og for å overvåke interaksjoner mellom mannosylerte peptider og CV-Ns bindingssted for høy affinitet. Viruskonvoluttpigger gp120, HA og Ebola glykoprotein (GP) 1,2 har blitt rapportert å binde både høy- og lavaffinitetsbindingssteder på dimerisk CVN2. Dimannosylert HA-peptid er også bundet på de to bindingsstedene med lav affinitet til et konstruert molekyl av CVN2, som bærer et høyaffinitetssted for den respektive liganden og mutert for å erstatte en stabiliserende disulfidbinding i karbohydratbindende lomme, og bekrefter dermed multivalent binding. HA-binding er vist til ett bindingssted med høy affinitet av pseudoantistoff CVN2 ved en dissosiasjonskonstant (KD) på 275 nM som ytterligere nøytraliserer humant immunsviktvirus type 1 (HIV-1) gjennom oligomerisering. Korrelering av antall disulfidbroer i domenebyttet CVN2, som reduseres fra 4 til 2 ved å erstatte cystiner i polare restpar av glutaminsyre og arginin, resulterer i redusert bindingsaffinitet til HA. Blant de sterkeste interaksjonene er Ebola GP1,2 bundet av CVN2 med to bindingssteder med høy affinitet i det nedre nanomolare området ved bruk av konvoluttglykanet uten transmembrandomene. I denne studien måles binding av det multispesifikke monomere CV-N til alvorlig akutt respiratorisk syndrom coronavirus 2 (SARS-CoV-2) spike (S) glykoprotein ved K D = 18,6 μM sammenlignet med nanomolar KD til de andre virustoppene, og via dets reseptorbindende domene i midten av μ-molare området.
Introduction
Tetherin-assosiert antiviral aktivitet induseres av interferon-α, og den består av proteinbaserte tethers, som fører til oppbevaring av fullt dannede virioner på infiserte celleoverflater1. Nødvendigheten av tetheringlykosylering ved hemming av virusfrigjøring er fortsatt usikker, noe som antyder betydningen av glykosyleringsmønstre på rekombinant uttrykte glykaner for in vitro-studier 1,2, som avhenger av konformasjonen av (i tilfelle influensavirus) overflateuttrykt influensa hemagglutinin HA 3,4 . Det har blitt bemerket at modifisering av oligosakkarid bundet til N-bundet glykosylering er nok for tetherinmediert begrensning av HIV type-1-frigjøring2, mens dimerisering spiller en viktig rolle i å forhindre virusfrigivelse, og derved involverer transmembrandomenet eller glykosylfosfatidyl-inositol (GPI) -anker for tethering av spirende virioner5 . Unike funksjoner er beskrevet for humant og murine tetherin for å blokkere flere innkapslede virus, retrovirus og filovirus. BST-2 / tetherin er et interferoninduserbart antiviralt protein av den medfødte immuniteten1,6, som virker med bredspektret antiviral aktivitet og motvirkes av konvoluttglykoproteiner5 for enten å translokere tetherin eller forstyrre strukturen av tetherin 6. For eksempel er overflate-uttrykt konvoluttglykoprotein HA og neuraminidase på influensa A-virus kjent for tetherinantagonisme på en stammespesifikk måte7, noe som letter anerkjennelsen av vertsreseptorbindingssteder8. Glykanmålrettede antistoffer studeres i støkiometrien av deres interaksjoner med de raskt tilpassede glykanskjoldene på HA, noe som resulterer i bindingsaffinitet til influensa A H3N2 og H1N1 subtyper4.
For å belyse bindingsmekanismene mellom antivirale midler og viruskonvoluttpigger, dvs. karbohydratligander, og komplementære immunologiske og spektroskopiske metoder, syntetiseres mono-, di- og tri-mannose-deler kjemisk. De mannosylerte peptidene dannes via azidoglykosylering av glykosyler {beta}-peracetater til 1,2-trans glykosylazider transformasjon9, som etterligner de typisk funnet N-acetylglukosamin og høymannose oligosakkarider på overflaten av livstruende virus. Triazolbioisostere brukes til å etterligne koblinger som danner mannosylert rest av HA-peptid10 og letter stedsspesifikke interaksjoner med antivirale CV-N-derivater rundt det andre N-koblede glykosyleringspunktet på HA-hodedomenet (HA-topp med 4 N-bundne glykaner N54, N97, N181, N301)8,11,12 . Interaksjoner mellom glutaminsyre (Glu) og arginin (Arg) og den resulterende helix-dipolen manifesterte god stabilitet av både modellpeptider og proteiner, men visualiseres ved hjelp av SPR. Hvis sammenlignet med å gjenkjenne et enkelt kjemisk syntetisert glykosyleringssted på HA10 ved direkte å hemme reseptorbinding på glykandelene, vises en høyere affinitet av en fire-site mutert Fc-struktur til reseptoren for å fremkalle effektorfunksjoner in vivo, og avslører den ikke-relaterte sammensetningen av N-bundne glykaner festet til Fc-mutanten for å være mekanistisk bestemt13.
CV-N viser antiviral aktivitet mot HIV 14,15, influensa16 og Ebola-virus, som er mediert av nanomolar binding til oligosakkaridmodifikasjoner med høy mannose på konvoluttpiggproteiner12,17,18,19. Influensa HA-binding til ett karbohydratbindende sted med høy affinitet (H) i CV-N eller to Hs i kovalent koblet dimerisk CVN2 er bestemt til å ha likevektsdissosiasjonskonstanter (K D) = henholdsvis 5,7 nM (figur 1A) og KD = 2,7 nM. Både CV-N og CVN2 har en eller to karbohydratbindende steder med lav affinitet (L) s 12,17,20,21. Ebola GP1,2 binder seg til 2H CVN2 med affiniteter i det nedre nanomolare området (KD = 26 nM). CV-N WT binding til Ebola GP1,2 og HA viser slektskap fra K D = 34 nM til KD = 5,7 nM (A/New York/55/04)12. Lektiner, som CV-N, som spesifikt retter seg mot høymannoseglykaner på virushylsene, hemmer ytterligere replikasjon av hepatitt C-virus, SARS-CoV, herpesvirus, Marburg-virus og meslingvirus22.
Det lille CV-N-molekylet har blitt studert grundig i mer enn 20 år, da det funksjonaliserer for å binde et bredt spekter av virus for å hemme viral oppføring16,18. Strukturelle analyser og bindingsaffinitetsanalyser indikerer kryssbinding av to L-er i en domenebyttet CVN2-dimer ved bivalent binding i mikromolarområdet for å øke aviditeten til virale konvoluttglykoproteiner10,19. Selektiv binding av Manα1-2Manα på Man(8) D1D3-armer og Man(9) består av to bindingssteder med forskjellig affinitet lokalisert på motsatte proteinprotomerer20, og når dermed nanomolære bindingsaffiniteter (figur 1B). CVN2 anses således som et pseudoantistoff angående dets anvendelse for å binde epitoper på HIV gp120, i likhet med virusnøytraliserende antistoffer17. Her er forfatteren interessert i å undersøke den potensielle bindingen av CVN2 til SARS-CoV-2-piggen via sitt reseptorbindende domene (RBD). Bindingskurver for immobilisert humant angiotensinkonverterende enzym (ACE)-2 med SARS-CoV-2 RBD resulterer i KD = 4,7 nM for denne biologisk relevante bindingsinteraksjonen23.
Derimot gjenkjenner utvalgte immunglobulinklasser spesifikke og konsistente strukturelle proteinmønstre, som gir et substrat for affinitetsmodning i de membranforankrede HA-regionene24. CV-N viser svært potent aktivitet i nesten alle influensa A- og B-virus16, og det er et bredt nøytraliserende antiviralt middel. Vår kunnskap er ufullstendig på plasseringen av målrettede epitoper på stammen av HA1 og HA2 som muligens involverer epitopiske strukturer for glykanmålretting av svært nøytraliserende antistoffer og sammenlignet med lektinbinding25.
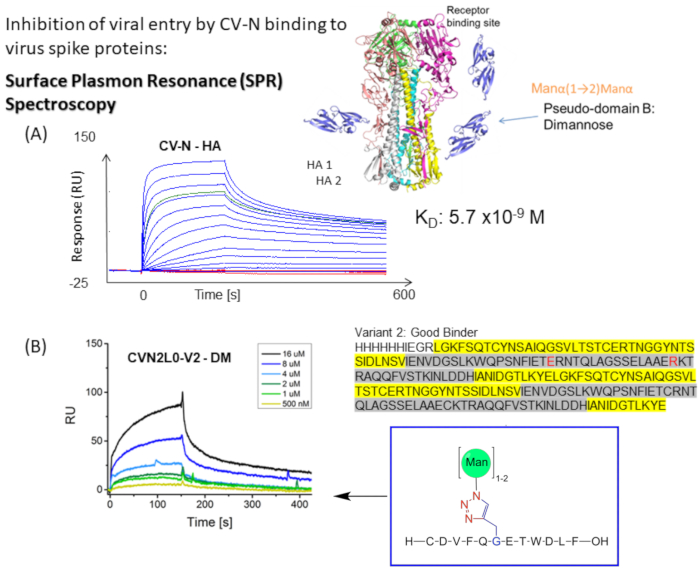
Figur 1: Skjematisk fremstilling av SPR-bindingsanalysen for CV-N til viruskonvoluttpigger. (A) SPR-analyse for CV-N-binding til ligand: HA protein i full lengde (90 kDa). Kinetisk datasett (5120, 2560, 1280, 640, 320, 160, 80, 40, 20, 10, 5, 2.5, 0 nM) som viser dobbeltreferert binding i sanntid til influensa HA A/New-York/55/04 (H3N2). (B) CVN2L0 variant V2 binding til immobilisert ligand DM innenfor et konsentrasjonsområde på 500 nM til 16 μM. Sekvens: L-rester er uthevet i gult. H-rester er uthevet i grått. E58 og R73 er en erstatning for cysteiner i wildtypeproteinet og gjør V2 til en stabil proteinfold med tre i stedet for fire disulfidbindinger Vennligst klikk her for å se en større versjon av denne figuren.
Mens glykanskjoldet på den membrandistale HA-toppdelen induserer høy affinitetsbinding til CV-N 12, har CVN2-binding til HA ved siden av en disulfidbro av HA-toppdelen videre blitt observert på lavaffinitetsstedene10,12. Ulike polare interaksjoner og interaksjonssteder identifiseres i karbohydratbinding ved CV-N. Disse interaksjonene verifiseres ved å generere knock-out-varianter i bindingsstedet for å korrelere bindingsaffiniteter til in silico predikert glykosylering12. Prosjektet tar derfor sikte på å sammenligne tidligere testede kjemisk mannosylerte HA-peptider i bindingsaffinitet og spesifisitet med korte peptidsekvenser fra SARS-relaterte 2019-nCoV-pigger og SARS-CoV-2, naturlig forekommende modifisert av et lite antall forskjellige N-bundne glykosyleringssteder og O-bundet glykosylering. Ved hjelp av kryo-elektronmikroskopi og bindingsanalyser rapporterer Pinto og kolleger et monoklonalt antistoff, S309, som potensielt gjenkjenner en epitop på SARS-CoV-2-piggprotein som inneholder et konservert glykan i Sarbecovirus-underslekten, uten å konkurrere med reseptorvedlegg26. Protokollen i denne studien beskriver hvordan design, uttrykk og karakterisering av CV-N-varianter er viktig for å studere hvordan CV-N og CVN2 binder seg til glykosylerte proteiner og syntetiske mannosylerte peptider ved hjelp av SPR-teknologien10,12.
Tandemkoblede dimer CVN2L027 og bindingsstedsvarianter (V2-V5) uttrykkes rekombinant og varianter er med disulfidbindingserstatninger (C58E og C73R) (figur 2A). Også en mutant med en enkeltpunktsmutasjon E41A er forberedt fordi denne posisjonen har blitt sett på som en intermolekylær krysskontaktrest. Denne mutanten er et annet interessant molekyl for SPR-bindingsmålinger mellom lektin- og høymannoseoligosakkarider som dechiffrerer bindingsdomener og tillater sammenligning med den dimeriske formen. Den domenebyttede krystallstrukturen til CVN2 viser en fleksibel kobling, som strekker seg mellom 49 og 54 rester. De to domenene kan fortsette å bevege seg rundt hengslet som stive legemer, og utvikle enten en monomer gjennom intramolekylære domeneinteraksjoner (domene A -rester 1-39;90-101- med domene B -rester 40-89) eller en dimer ved intermolekylær domenebytte [domene A (av den første monomeren) med domene B (av den andre), og domene B (av den første monomeren) med domene A (av den andre kopien)]. Det er ingen nære interaksjoner mellom de to protomerenes A- og B-domener, bortsett fra Glu4128. Genet for CV-N kan utvikles ved hjelp av en repeterende PCR-metode med 40-mer syntetiserte oligoer29 og blir deretter subklonert inn i NdeI- og BamHI-stedene til pET11a for transformasjon (elektroporering) til elektrokompetente celler som beskrevet av Keeffe, JR.27. Proteinet, som brukes til å oppnå den respektive krystallstrukturen (PDB ID 3S3Y), inkluderer en N-terminal 6-histidinrensingskode etterfulgt av et Faktor Xa proteasespaltningssted. Site-rettet mutagenese brukes til å lage punktmutasjoner, bytte kodoner og sette inn eller slette enkle eller flere baser eller kodoner for aminosyreutveksling. Disse transformasjonene gir uvurderlig innsikt i proteinfunksjon og struktur. Rekombinant uttrykt og renset CV-N, CVN2 og CVN3 har blitt biofysisk godt studert20,21,27, er billige å produsere, og brukes derfor til å karakterisere bindingsanalyser til glykaner immobilisert på SPR-sensorbrikker. Konvensjonell enzymbundet immunosorbentanalyse (ELISA) gir mindre reproduserbarhet angående immobiliseringsteknikken til glykanligander og forvandler sanntidsbinding av forskjellige bindingsstedsvarianter, som er vist for SPR, til endepunktanalyser.
Bindingsaffinitetsvarianten CVN2L0-V2 (en intakt fold av homodimer CV-N med en disulfidbrosubstitusjon10) uttrykkes med en His-tag i Escherichia coli (E. coli), renset over Ni-NTA-kolonnen ved bruk av affinitetskromatografi og testet for binding til HA (H3N2), monomannosylert HA-peptid og dimannosylert HA-peptid ved bruk av SPR. Kjemisk mannosylerte peptider, eller HA- og S-protein, er alle ligander og amin koblet til den hydrofile chipoverflaten via reaktive estere eller biotin-streptavidin protein engineering. Den samme prosedyren for sekvensielle løp brukes på disse ligandene, injisering av forskjellige fortynninger av CV-N og varianter av CV-N (og CVN2) for å oppnå kinetisk informasjon for molekylære interaksjonsanalyser som beskrevet nedenfor30. RBD-immobilisert SPR-sensorbrikke brukes til bindingsstudier på CV-N til S-peptider, og affiniteter sammenlignes med SARS-CoV-2-binding med human ACE2.
Protocol
Representative Results
Discussion
CV-Ns bindingsaffinitet er korrelert med antall funksjonelle bindingssteder [2H på domener B, og 2L på domene(r) A når de konstrueres som domenebyttede dimer]. En variant med endret bindingsaffinitet (CVN2L0-V2, en homodimer stabil fold av CV-N som består av en disulfidbro knock-out) uttrykkes i E. coli, renset og positivt testet for binding til HA-protein (H3N2) ved bruk av SPR10, og viser en konformasjonsendring ved binding av HA med enten H eller L karbohydratbindende steder og K<s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatteren anerkjenner Dr. Christian Derntl fra Institutt for bioteknologi og mikrobiologi ved TU Wien og Institutt for medisin III, Divisjon for nefrologi og dialyse ved Det medisinske universitetet i Wien, spesielt Dr. Markus Wahrmann for teknisk og vitenskapelig støtte. Proteinuttrykk i pattedyrceller ble støttet av Institutt for bioteknologi ved Universitetet for naturressurser og biovitenskap (BOKU) Wien. Forfatteren ønsker å uttrykke sin dype anerkjennelse til Dr. Nico Dankbar fra XanTec bioanalyse i Düsseldorf, Tyskland, for nyttige vitenskapelige diskusjoner om å utføre SPR-bindingsanalysene.
Materials
| Äkta primeplus | Cytiva | ||
| Amicon tubes | Merck | C7715 | |
| Ampillicin | Sigma-Aldrich | A5354 | |
| Beckmann Coulter Cooler Allegra X-30R centrifuge | Beckman Coulter | B06320 | |
| Cell spreader | Sigma-Aldrich | HS86655 | silver stainless steel, bar L 33 mm |
| Custom DNA Oligos | Sigma-Aldrich | OLIGO | |
| Custom Gensynthesis | GenScript | #1390661 | cloning vector: pET27b(+) |
| Cytiva HBS-EP+ Buffer 10, 4x50mL | Thermo Scientific | 50-105-5354 | |
| Dionex UlitMate 3000 | Thermo Scientific | IQLAAAGABHFAPBMBFB | |
| Dpn I restriction enzyme (10 U/μL) | Fisher Scientific | ER1701 | |
| DTT | Merck | DTT-RO | |
| EDC | Merck | 39391 | |
| EDTA | Merck | E9884 | |
| Eppendorf Safe-Lock Tubes | Eppendorf | 30120086 | |
| Eppendorf Safe-Lock Tubes | Eppendorf | 30120094 | |
| Eppendorf Minispin and MiniSpin Plus personal microcentrifuge | Sigma-Aldrich | Z606235 | |
| Ethanol | Merck | 51976 | |
| Ethanolamine HCl | Merck | E6133 | |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-22 | |
| Falcon 14 mL Round Bottom Polystyrene Test Tube, with Snap Cap, Sterile, 25/Pack | Corning | 352057 | |
| Glucose | Merck | G8270 | |
| Glycine HCl | Merck | 55097 | |
| HA H3 protein | Abcam | ab69751 | |
| HEPES | Merck | H3375 | |
| His-select Ni2+ | Merck | H0537 | |
| Imidazole | Merck | I2399 | |
| IPTG | Merck | I6758 | |
| Kanamycin A | Sigma-Aldrich | K1377 | |
| Kromasil 300-5-C4 | Nouryon | ||
| LB agar | Merck | 52062 | |
| LB agar | Merck | 19344 | |
| LB Lennox | Merck | L3022 | |
| Lysozyme | Merck | 10837059001 | |
| Magnesium chloride | Merck | M8266 | |
| Magnesium sulfate | Merck | M7506 | |
| NaH2P04 | Merck | S0751 | |
| NanoDrop UV-Vis2000c spectrophotometer | Thermo Scientific | ND2000CLAPTOP | |
| NaOH | Merck | S5881 | |
| NHS | Merck | 130672 | |
| NZ amine (casein hydrolysate) | Merck | C0626 | |
| PBS | Merck | 806552 | |
| PD MidiTrap G-10 | Sigma-Aldrich | GE28-9180-11 | |
| Peptone | Merck | 70171 | |
| pET11a | Merck Millipore (Novagen) | 69436 | |
| PMSF | Merck | PMSF-RO | |
| QIAprep Spin Miniprep Kit (1000) | Qiagen | 27106X4 | |
| Reichert Software Package Autolink1-1-9 | Reichert | ||
| Reichert SPR SR7500DC Dual Channel System | Reichert | ||
| Scrubber2-2012-09-04 for data analysis | Reichert | ||
| SDS | Merck | 11667289001 | |
| Site-directed mutagenesis kit incl pUC18 control plasmid | Stratagene | #200518 | |
| Sodim chloride | Merck | S9888 | |
| Sodium acetate.Trihydrate | Merck | 236500 | |
| SPR sensor chip C19RBDHC30M | XanTec bioanalytics | SCR C19RBDHC30M | |
| SPR sensor chip CMD500D | XanTec bioanalytics | SCR CMD500D | |
| Sterilin Standard 90mm Petri Dishes | Thermo Scientific | 101R20 | |
| TBS | Merck | T5912 | 10x, solution |
| Triton-X100 | Merck | T8787 | |
| Tryptone | Merck | 93657 | |
| Tween20 | Merck | P1379 | |
| Vortex-Genie 2 Mixer | Merck | Z258423 | |
| X-gal | Merck | XGAL-RO | |
| XL1-Blue Supercompetent Cells | Stratagene | #200236 | |
| Yeast extract | Merck | Y1625 |
References
- Perez-Caballero, D., et al. Tetherin inhibits HIV-1 release by directly tethering virions to cells. Cell. 139 (3), 499-511 (2009).
- Waheed, A. A., Gitzen, A., Swiderski, M., Freed, E. O. High-mannose but not complex-type glycosylation of tetherin is required for restriction of HIV-1 release. Viruses. 10 (1), 26 (2018).
- Wilson, I. A., et al. Structure of the haemagglutinin membrane glycoprotein of influenza virus at 3 A resolution. Nature. 289 (5796), 366-373 (1981).
- Otterstrom, J. J., et al. Relating influenza virus membrane fusion kinetics to stoichiometry of neutralizing antibodies at the single-particle level. Proceedings of the National Academy of Sciences of the United States of America. 111 (48), 5143-5148 (2014).
- Kaletsky, R. L., Francica, J. R., Agrawal-Gamse, C., Bates, P. Tetherin-mediated restriction of filovirus budding is antagonized by the Ebola glycoprotein. Proceedings of the National Academy of Sciences of the United States of America. 106 (8), 2886-2891 (2009).
- Tokarev, A., Skasko, M., Fitzpatrick, K., Guatelli, J. Antiviral activity of the interferon-induced cellular protein BST-2/tetherin. AIDS Research and Human Retroviruses. 25 (12), 1197-1210 (2009).
- Gnirss, K., et al. Tetherin sensitivity of influenza A viruses is strain specific: Role of hemagglutinin and neuraminidase. Journal of Virology. 89 (18), 9178-9188 (2015).
- Fleury, D., et al. A complex of influenza hemagglutinin with a neutralizing antibody that binds outside the virus receptor binding site. Nature Structural Biology. 6 (6), 530-534 (1999).
- Salunke, S. B., et al. Iron(III) chloride as an efficient catalyst for stereoselective synthesis of glycosyl azides and a cocatalyst with Cu(0) for the subsequent click chemistry. Chemical Communication. (Camb). 47 (37), 10440-10442 (2011).
- Schilling, P. E., et al. Mannosylated hemagglutinin peptides bind cyanovirin-N independent of disulfide-bonds in complementary binding sites. RSC Advances. 10 (19), 11079-11087 (2020).
- Fleury, D., Wharton, S. A., Skehel, J. J., Knossow, M., Bizebard, T. Antigen distortion allows influenza virus to escape neutralization. Nature Structural Biology. 5 (2), 119-123 (1998).
- Maier, I., Schiestl, R. H., Kontaxis, G. Cyanovirin-N binds viral envelope proteins at the low-affinity carbohydrate binding site without direct virus neutralization ability. Molecules. 26 (12), 3621 (2021).
- Ahmed, A. J., Keremane, S. R., Vielmetter, J., Bjorkman, P. J. Structural characterization of GASDALIE Fc bound to the activating Fc receptor FcγRIIIa. Journal of Structural Biology. 194 (1), 78-89 (2016).
- Boyd, R. Discovery of cyanovirin-N, a novel human immunodeficiency virus-inactivating protein that binds viral surface envelope glycoprotein gp120: potential applications to microbicide development. Antimicrobial Agents and Chemotherapy. 41 (7), 1521-1530 (1997).
- Bolmstedt, A. J., O’Keefe, B. R., Shenoy, S. R., McMahon, J. B., Boyd, M. R. Cyanovirin-N defines a new class of antiviral agent targeting N-linked, high-mannose glycans in an oligosaccharide-specific manner. Molecular Pharmacology. 59 (5), 949-954 (2001).
- O’Keefe, B. R., et al. Potent anti-influenza activity of cyanovirin-N and interactions with viral hemagglutinin. Antimicrobial Agents and Chemotherapy. 47 (8), 2518-2525 (2003).
- Shenoy, S. R., et al. Multisite and multivalent binding between cyanovirin-N and branched oligomannosides: calorimetric and NMR characterization. Chemical Biology. 9 (10), 1109-1118 (2002).
- Bewley, C. A., Kiyonaka, S., Hamachi, I. Site-specific discrimination by cyanovirin-N for alpha-linked trisaccharides comprising the three arms of Man(8) and Man(9). Journal of Molecular Biology. 322 (4), 881-889 (2002).
- Barrientos, L. G., Matei, E., Lasala, F., Delgado, R., Gronenborn, A. M. Dissecting carbohydrate-Cyanovirin-N binding by structure-guided mutagenesis: functional implications for viral entry inhibition. Protein Engineering Design & Selection. 19 (12), 525-535 (2006).
- Bewley, C. A., Otero-Quintero, S. The potent anti-HIV protein cyanovirin-N contains two novel carbohydrate binding sites that selectively bind to Man(8) D1D3 and Man(9) with nanomolar affinity: implications for binding to the HIV envelope protein gp120. Journal of the American Chemical Society. 123 (17), 3892-3902 (2001).
- Bewley, C. A. Solution structure of a cyanovirin-N:Man alpha 1-2Man alpha complex: structural basis for high-affinity carbohydrate-mediated binding to gp120. Structure. 9 (10), 931-940 (2001).
- Jensen, S. M. R., et al. Differential inhibitory effects of Cyanovirin-N, Griffithsin, and Scytovirin on entry mediated by envelopes of gammaretroviruses and deltaretroviruses. Journal of Virology. 88 (4), 2327-2332 (2014).
- Lan, J., et al. Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor. Nature. 581 (7807), 215-220 (2020).
- Lingwood, D., et al. Structural and genetic basis for development of broadly neutralizing influenza antibodies. Nature. 489 (7417), 566-570 (2012).
- Ekiert, D. C., et al. Antibody recognition of a highly conserved influenza virus epitope. Science. 324 (5924), 246-251 (2009).
- Pinto, D., et al. Cross-neutralization of SARS-CoV-2 by a human monoclonal SARS-CoV antibody. Nature. 583 (7815), 290-295 (2020).
- Keeffe, J. R., et al. Designed oligomers of cyanovirin-N show enhanced HIV neutralization. Proceedings of the National Academy of Sciences of the United States of America. 108 (34), 14079-14084 (2011).
- Yang, F., et al. Crystal structure of cyanovirin-N, a potent HIV-inactivating protein, shows unexpected domain swapping. Journal of Molecular Biology. 288 (3), 403-412 (1999).
- Stemmer, W. P., Crameri, A., Ha, K. D., Brennan, T. M., Heyneker, H. L. Single-step assembly of a gene and entire plasmid from large numbers of oligodeoxyribonucleotides. Gene. 164 (1), 49-53 (1995).
- Fischer, M. J. E., Mol, N., Fischer, M. Amine coupling through EDC/NHS: A practical approach. Surface Plasmon Resonance. Methods in Molecular Biology (Methods and Protocols). 627, (2010).
- Novoradovsky, A., et al. Computational principles of primer design for site directed mutagenesis. Technical Proceedings of 2005 NSTI Nanotechnology Conference and Trade Show. , 532-535 (2005).
- . QuikChange Site-Directed MutagenesisKit, User Manual Available from: https://users.drew.edu/jliu3/Docs/Stratagene%20Quikchange%20mutagenesis.pdf#:~:text=The%20QuikChange%20sitedirected%20mutagenesis%20kit%20is%20used%20to (2005)
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- . Expasy.org Available from: https://web.expasy.org/cgi-bin/protparam/protparam (2022)
- Karlsson, R. Real-time competitive kinetic analysis of interactions between low-molecular-weight ligands in solution and surface-immobilized receptors. Analytical Biochemistry. 221 (1), 142-151 (1994).
- Schuck, P., Zhao, H. The role of mass transport limitation and surface heterogeneity in the biophysical characterization of macromolecular binding processes by SPR biosensing. Methods Molecular Biology. 627, 15-54 (2020).
- Barnes, O., et al. SARS-CoV-2 neutralizing antibody structures inform therapeutic strategies. Nature. 588 (7839), 682-687 (2020).
- . Using reichert Surface Plasmon Resonance (SPR) for Antiviral Development, Application Note 28 Available from: https://www.reichertspr.com/clientuploads/directory/application_notes/Application_Note_28__Using_Reichert_Surface_Plasmon_Resonance_for_Antiviral_Testing.pdf (2022)
- Sundberg, E. J., Andersen, P. S., Gorshkova, I. I., Schuck, P., Schuck, P. Surface plasmon resonance biosensing in the study of ternary systems of interacting proteins. Protein Interactions: Biophysical Approaches for the Study of Complex Reversible Systems. 5, 97-141 (2007).
- . Method Development Notes Available from: https://www.reichertspr.com/applications/method-development-notes/ (2022)
- Angulo, J., Enríquez-Navas, P. M., Nieto, P. M. Ligand-receptor binding affinities from saturation transfer difference (STD)-NMR spectroscopy: the binding Isotherm of STD initial growth rates. Chemistry. 16 (26), 7803-7812 (2010).
- Goldflam, M., Tarragó, T., Gairí, M., Giralt, E. NMR studies of protein-ligand interactions. Methods in Molecular Biology. 831, 233-259 (2012).
- Kumar, S., Maurya, V. K., Prasad, A. K., Bhatt, M. L. B., Saxena, S. K. Structural, glycosylation and antigenic variation between 2019 novel coronavirus (2019-nCoV) and SARS coronavirus (SARS-CoV). Virusdisease. 31 (1), 13-21 (2020).

