Modelado computacional de neuronas retinianas para la investigación de prótesis visuales - Enfoques fundamentales
Summary
Resumimos un flujo de trabajo para modelar computacionalmente los comportamientos de una neurona retiniana en respuesta a la estimulación eléctrica. El modelo computacional es versátil e incluye pasos de automatización que son útiles para simular una variedad de escenarios fisiológicos y anticipar los resultados de futuros estudios in vivo / in vitro .
Abstract
El modelado computacional se ha convertido en un método cada vez más importante en la ingeniería neuronal debido a su capacidad para predecir comportamientos de sistemas in vivo e in vitro . Esto tiene la ventaja clave de minimizar el número de animales requeridos en un estudio dado al proporcionar una predicción a menudo muy precisa de los resultados fisiológicos. En el campo de la prótesis visual, el modelado computacional tiene una variedad de aplicaciones prácticas, que incluyen informar el diseño de una matriz de electrodos implantables y la predicción de percepciones visuales que pueden obtenerse a través de la entrega de impulsos eléctricos de dicha matriz. Algunos modelos descritos en la literatura combinan una morfología tridimensional (3D) para calcular el campo eléctrico y un modelo de cable de la neurona o red neuronal de interés. Para aumentar la accesibilidad de este método de dos pasos para los investigadores que pueden tener una experiencia previa limitada en el modelado computacional, proporcionamos un video de los enfoques fundamentales que se deben tomar para construir un modelo computacional y utilizarlo para predecir los resultados fisiológicos y psicofísicos de los protocolos de estimulación implementados a través de una prótesis visual. La guía comprende los pasos para construir un modelo 3D en un software de modelado de elementos finitos (FEM), la construcción de un modelo de células ganglionares de la retina en un software computacional de neuronas multicompartimentales, seguido de la fusión de los dos. Un software de modelado de elementos finitos para resolver numéricamente ecuaciones físicas se utilizaría para resolver la distribución del campo eléctrico en las estimulaciones eléctricas del tejido. Luego, se utilizó un software especializado para simular las actividades eléctricas de una célula o red neuronal. Para seguir este tutorial, se requeriría familiaridad con el principio de funcionamiento de una neuroprótesis, así como conceptos neurofisiológicos (por ejemplo, mecanismo de potencial de acción y una comprensión del modelo de Hodgkin-Huxley).
Introduction
Las neuroprótesis visuales son un grupo de dispositivos que administran estimulaciones (eléctricas, de luz, etc.) a las células neuronales en la vía visual para crear fosfenos o sensación de ver la luz. Es una estrategia de tratamiento que ha estado en uso clínico durante casi una década para personas con ceguera permanente causada por enfermedades degenerativas de la retina. Por lo general, un sistema completo incluiría una cámara externa que captura la información visual alrededor del usuario, una fuente de alimentación y una unidad de computación para procesar y traducir la imagen a una serie de pulsos eléctricos, y una matriz de electrodos implantada que interactúa con el tejido neural y entrega los pulsos eléctricos a las células neuronales. El principio de funcionamiento permite colocar una neuroprótesis visual en diferentes sitios a lo largo de la vía visual desde la retina hasta la corteza visual, siempre que esté aguas abajo del tejido dañado. La mayoría de las investigaciones actuales en neuroprótesis visuales se centran en aumentar la eficacia de la estimulación y mejorar la agudeza espacial para proporcionar una visión más natural.
En los esfuerzos por mejorar la eficacia de la estimulación, el modelado computacional ha sido un método rentable y efectivo para validar el diseño de una prótesis y simular su resultado visual. El modelado computacional en este campo ganó popularidad desde 1999 cuando Greenberg1 modeló la respuesta de una célula ganglionar de la retina a estímulos eléctricos extracelulares. Desde entonces, el modelado computacional se ha utilizado para optimizar los parámetros del pulso eléctrico 2,3 o el diseño geométrico del electrodo 4,5. A pesar de la variación en la complejidad y las preguntas de investigación, estos modelos funcionan determinando la distribución del voltaje eléctrico en el medio (por ejemplo, tejido neural) y estimando la respuesta eléctrica que las neuronas en la vecindad producirán debido al voltaje eléctrico.
La distribución de voltaje eléctrico en un conductor se puede encontrar resolviendo las ecuaciones de Poisson6 en todas las ubicaciones:
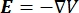
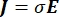
donde E es el campo eléctrico, V el potencial eléctrico, J la densidad de corriente y σ es la conductividad eléctrica. El 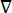 en la ecuación indica un operador de gradiente. En el caso de la corriente estacionaria, se imponen las siguientes condiciones de contorno en el modelo:
en la ecuación indica un operador de gradiente. En el caso de la corriente estacionaria, se imponen las siguientes condiciones de contorno en el modelo:
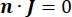
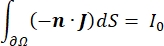
donde n es la normal a la superficie, Ω representa el límite e I0 representa la corriente específica. Juntos, crean aislamiento eléctrico en los límites externos y crean una fuente de corriente para un límite seleccionado. Si asumimos una fuente puntual monopolar en un medio homogéneo con una conductividad isotrópica, el potencial eléctrico extracelular en una ubicación arbitraria se puede calcular por7:
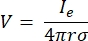
donde Ie es la corriente y es la distancia entre el electrodo y el punto de medición. Cuando el medio no es homogéneo o anisótropo, o la matriz de electrodos tiene múltiples electrodos, una suite computacional para resolver numéricamente las ecuaciones puede ser conveniente. Un software de modelado de elementos finitos6 divide el conductor de volumen en pequeñas secciones conocidas como “elementos”. Los elementos están interconectados entre sí de tal manera que los efectos del cambio en un elemento influyen en el cambio en otros, y resuelve las ecuaciones físicas que sirven para describir estos elementos. Con la creciente velocidad computacional de las computadoras modernas, este proceso se puede completar en segundos. Una vez que se calcula el potencial eléctrico, se puede estimar la respuesta eléctrica de la neurona.
Una neurona envía y recibe información en forma de señales eléctricas. Tales señales vienen en dos formas: potenciales graduados y potenciales de acción. Los potenciales graduales son cambios temporales en el potencial de membrana en los que el voltaje a través de la membrana se vuelve más positivo (despolarización) o negativo (hiperpolarización). Los potenciales graduales suelen tener efectos localizados. En las células que los producen, los potenciales de acción son respuestas de todo o nada que pueden viajar largas distancias a lo largo de un axón. Tanto los potenciales graduales como los de acción son sensibles al entorno eléctrico y químico. Un pico de potencial de acción puede ser producido por varios tipos de células neuronales, incluidas las células ganglionares de la retina, cuando se cruza un potencial transmembrana umbral. El potencial de acción y la propagación desencadenan la transmisión sináptica de señales a las neuronas aguas abajo. Una neurona puede ser modelada como un cable que se divide en segmentos cilíndricos, donde cada segmento tiene capacitancia y resistencia debido a la membrana de la bicapa lipídica8. Un programa computacional neuronal9 puede estimar la actividad eléctrica de una célula eléctricamente excitable discretizando la célula en múltiples compartimentos y resolviendo el modelo matemático10:
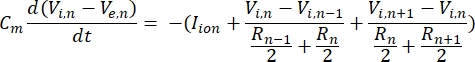
En esta ecuación, Cmes la capacitancia de membrana, V e,n es el potencial extracelular en el nodo n, Vi,n el potencial intracelular en el nodo n, R n la resistencia intracelular (longitudinal) en el nodo n, y el ion I es la corriente iónica que pasa a través de los canales iónicos en el nodo n. Los valores de V del modelo FEM se implementan como Ve,n para todos los nodos de la neurona cuando la estimulación está activa.
Las corrientes transmembrana de los canales iónicos se pueden modelar utilizando formulaciones de Hodgkin-Huxley11:
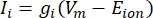
donde g i es la conductancia específica del canal, V m el potencial transmembrana (V i,n – Ve,n) y Eion el potencial de inversión del canal iónico. Para los canales dependientes de voltaje, como el canal Na, se introducen parámetros adimensionales, m y h, que describen la probabilidad de apertura o cierre de los canales:
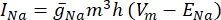
donde 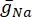 es la conductancia máxima de membrana para el canal iónico particular, y los valores de los parámetros m y h se definen mediante ecuaciones diferenciales:
es la conductancia máxima de membrana para el canal iónico particular, y los valores de los parámetros m y h se definen mediante ecuaciones diferenciales:
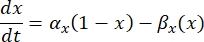
donde α x y βx son funciones dependientes del voltaje que definen las constantes de velocidad del canal iónico. Generalmente toman la forma:
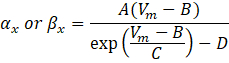
Los valores de los parámetros en estas ecuaciones, incluida la conductancia máxima, así como las constantes A, B, C y D, se encontraron típicamente a partir de mediciones empíricas.
Con estos bloques de construcción, se pueden construir modelos de diferentes complejidades siguiendo los pasos descritos. Un software FEM es útil cuando la ecuación de Poisson no se puede resolver analíticamente, como en el caso de conductancia no homogénea o anisotrópica en el conductor de volumen o cuando la geometría de la matriz de electrodos es compleja. Después de que se hayan resuelto los valores de potencial extracelular, el modelo de cable neuronal se puede resolver numéricamente en el software computacional neuronal. La combinación de los dos programas permite el cálculo de una célula neuronal compleja o red a un campo eléctrico no uniforme.
Se construirá un modelo simple de dos pasos de una célula ganglionar retiniana bajo una estimulación supracoroidea utilizando los programas antes mencionados. En este estudio, la célula ganglionar de la retina se someterá a un rango de magnitudes de pulsos de corriente eléctrica. La ubicación de la célula en relación con el estímulo también se varía para mostrar la relación distancia-umbral. Además, el estudio incluye una validación del resultado computacional contra un estudio in vivo del umbral de activación cortical utilizando diferentes tamaños de electrodo de estimulación12, así como un estudio in vitro que muestra la relación entre la distancia electrodo-neurona y el umbral de activación13.
Protocol
Representative Results
Discussion
En este documento, hemos demostrado un flujo de trabajo de modelado que combina elementos finitos y modelado de neuronas biofísicas. El modelo es altamente flexible, ya que puede modificarse en su complejidad para adaptarse a diferentes propósitos, y proporciona una forma de validar los resultados contra los hallazgos empíricos. También demostramos cómo parametrizamos el modelo para permitir la automatización.
El método de modelado de dos pasos combina las ventajas de usar FEM y la suit…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Esta investigación está financiada por The National Health and Medical Research Council Project Grant (Número de subvención 1109056).
Materials
| Computer workstation | N/A | N/A | Windows 64-bit operating system, at least 4GB of RAM, at least 3 GB of disk space |
| Anaconda Python | Anaconda Inc. | Version 3.9 | The open source Individual Edition containing Python 3.9 and preinstalled packages to perform data manipulation, as well as Spyder Integrated Development Environment. It could be used to control the simulation, as well as to display and analyse the simulation data. |
| COMSOL Multiphysics | COMSOL | Version 5.6 | The simulation suite to perform finite element modelling. The licence for the AC/DC module should be purchased. The Application Builder capability should be included in the licence to follow the automation tutorial. |
| NEURON | NEURON | Version 8.0 | A freely-distributed software to perform the computation of neuronal cells and/or neural networks. |
References
- Greenberg, R. J., Velte, T. J., Humayun, M. S., Scarlatis, G. N., de Juan, E. A computational model of electrical stimulation of the retinal ganglion cell. IEEE Transactions on Bio-medical Engineering. 46 (5), 505-514 (1999).
- Guo, T., et al. Mediating retinal ganglion cell spike rates using high-frequency electrical stimulation. Frontiers in Neuroscience. 13, 413 (2019).
- Loizos, K., et al. Increasing electrical stimulation efficacy in degenerated retina: Stimulus waveform design in a multiscale computational model. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 26 (6), 1111-1120 (2018).
- Cao, X., Sui, X., Lyu, Q., Li, L., Chai, X. Effects of different three-dimensional electrodes on epiretinal electrical stimulation by modeling analysis. Journal of Neuroengineering and Rehabilitation. 12 (1), 73 (2015).
- Wilke, R. G. H., Moghadam, G. K., Lovell, N. H., Suaning, G. J., Dokos, S. Electric crosstalk impairs spatial resolution of multi-electrode arrays in retinal implants. Journal of Neural Engineering. 8 (4), 046016 (2011).
- AC/DC module user’s guide. COMSOL AB Available from: https://doc.comsol.com/5.4/doc/com.comsol.help.acdc/ACDCModuleUsersGuide.pdf (2018)
- Malmivuo, P., Malmivuo, J., Plonsey, R. . Bioelectromagnetism: Principles and Applications of Bioelectric and Biomagnetic Fields. , (1995).
- Rall, W. Electrophysiology of a dendritic neuron model. Biophysical Journal. 2, 145-167 (1962).
- Carnevale, N. T., Hines, M. L. . The Neuron Book. , (2006).
- Rattay, F. The basic mechanism for the electrical stimulation of the nervous system. 신경과학. 89 (2), 335-346 (1999).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Liang, T., et al. Threshold suprachoroidal-transretinal stimulation current required by different-size electrodes in rabbit eyes. Ophthalmic Research. 45 (3), 113-121 (2011).
- Jensen, R. J., Rizzo, J. F., Ziv, O. R., Grumet, A., Wyatt, J. Thresholds for activation of rabbit retinal ganglion cells with an ultrafine, extracellular microelectrode. Investigative Ophthalmology and Visual Science. 44 (8), 3533-3543 (2003).
- Kim, W., Choi, M., Kim, S. -. W. The normative retinal and choroidal thicknesses of the rabbit as revealed by spectral domain optical coherence tomography. Journal of the Korean Ophthalmological Society. 62 (3), 354-361 (2021).
- Guo, T., et al. Influence of cell morphology in a computational model of ON and OFF retinal ganglion cells. 35th Annual International Conference of the IEEE Engineering in Medicine and Biology Society (EMBC). 2013, 4553-4556 (2013).
- Haberbosch, L., et al. Safety aspects, tolerability and modeling of retinofugal alternating current stimulation. Frontiers in Neuroscience. 13, 783 (2019).
- Sheasby, B. W., Fohlmeister, J. F. Impulse encoding across the dendritic morphologies of retinal ganglion cells. Journal of Neurophysiology. 81 (4), 1685-1698 (1999).
- Rockhill, R. L., Daly, F. J., MacNeil, M. A., Brown, S. P., Masland, R. H. The diversity of ganglion cells in a mammalian retina. Journal of Neuroscience. 22 (9), 3831-3843 (2002).
- Lukasiewicz, P., Werblin, F. A slowly inactivating potassium current truncates spike activity in ganglion cells of the tiger salamander retina. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 8 (12), 4470-4481 (1988).
- Van Rossum, G. . Python Reference Manual. , (1995).
- . Welcome to Spyder’s Documentation – Spyder 5 documentation Available from: https://docs.spyder-idle.org/current/index.html (2022)
- Rattay, F. Ways to approximate current-distance relations for electrically stimulated fibers. Journal of Theoretical Biology. 125 (3), 339-349 (1987).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Direct activation and temporal response properties of rabbit retinal ganglion cells following subretinal stimulation. Journal of Neurophysiology. 102 (5), 2982-2993 (2009).
- Tsai, D., Morley, J. W., Suaning, G. J., Lovell, N. H. Frequency-dependent reduction of voltage-gated sodium current modulates retinal ganglion cell response rate to electrical stimulation. Journal of Neural Engineering. 8 (6), 066007 (2011).
- Joucla, S., Glière, A., Yvert, B. Current approaches to model extracellular electrical neural microstimulation. Frontiers in Computational Neuroscience. 8, 13 (2014).
- . OpenFOAM Available from: https://www.openfoam.com/ (2022)
- Barba, L., Forsyth, G. CFD Python: The 12 steps to Navier-Stokes equations. Journal of Open Source Education. 1 (9), 21 (2018).

