Untersuchung der Gewöhnung bei Stentor coeruleus
Summary
Wir stellen eine Methode zur Quantifizierung der Stentor-Gewöhnung unter Verwendung einer Mikrocontroller-platinengekoppelten Vorrichtung vor, die mechanische Impulse mit einer bestimmten Kraft und Frequenz liefern kann. Wir schließen auch Methoden zum Zusammenbau der Apparatur und zum Aufbau des Experiments so ein, dass externe Störungen minimiert werden.
Abstract
Lernen ist normalerweise mit einem komplexen Nervensystem verbunden, aber es gibt zunehmend Hinweise darauf, dass das Leben auf allen Ebenen, bis hin zu einzelnen Zellen, intelligente Verhaltensweisen zeigen kann. Sowohl in natürlichen als auch in künstlichen Systemen ist Lernen die adaptive Aktualisierung von Systemparametern auf der Grundlage neuer Informationen, und Intelligenz ist ein Maß für den Rechenprozess, der das Lernen erleichtert. Stentor coeruleus ist ein einzelliger Teichorganismus, der eine Gewöhnung aufweist, eine Form des Lernens, bei der eine Verhaltensreaktion nach einem wiederholten Reiz abnimmt. Stentor kontrahiert sich als Reaktion auf mechanische Stimulation, die eine scheinbare Fluchtreaktion von aquatischen Raubtieren ist. Wiederholte Störungen geringer Kraft induzieren jedoch eine Gewöhnung, was sich in einer fortschreitenden Verringerung der Kontraktionswahrscheinlichkeit zeigt. Hier stellen wir eine Methode zur Quantifizierung der Stentor-Gewöhnung unter Verwendung einer Mikrocontroller-platinengebundenen Vorrichtung vor, die mechanische Impulse mit einer bestimmten Kraft und Frequenz liefern kann, einschließlich Methoden zum Bau der Apparatur und zum Aufbau des Experiments in einer Weise, die externe Störungen minimiert. Im Gegensatz zu den zuvor beschriebenen Ansätzen zur mechanischen Stimulation von Stentor ermöglicht dieses Gerät die Variation der Stimulationskraft unter Computersteuerung im Verlauf eines einzigen Experiments, wodurch die Vielfalt der anwendbaren Eingabesequenzen stark erhöht wird. Das Verständnis der Gewöhnung auf der Ebene einer einzelnen Zelle wird dazu beitragen, Lernparadigmen zu charakterisieren, die unabhängig von komplexen Schaltkreisen sind.
Introduction
Lernen ist normalerweise mit einem komplexen Nervensystem verbunden, aber es gibt zunehmend Hinweise darauf, dass das Leben auf allen Ebenen, bis hin zu einzelnen Zellen, intelligente Verhaltensweisen zeigen kann. Sowohl in natürlichen als auch in künstlichen Systemen ist Lernen die adaptive Aktualisierung von Systemparametern auf der Grundlage neuer Informationen1, und Intelligenz ist ein Maß für den Rechenprozess, der das Lernenerleichtert 2.
Stentor coeruleus ist ein einzelliger Teichorganismus, der eine Gewöhnung aufweist, eine Form des Lernens, bei der eine Verhaltensreaktion nach einem wiederholten Reiz abnimmt3. Stentor kontrahiert sich als Reaktion auf mechanische Stimulation3, die eine scheinbare Fluchtreaktion von aquatischen Raubtieren ist. Wiederholte Störungen geringer Kraft induzieren jedoch eine Gewöhnung, was sich in einer fortschreitenden Verringerung der Kontraktionswahrscheinlichkeit zeigt3. Der gewöhnte Stentor zieht sich nach Erhalt einer mechanischen Hochkraftstimulation4 oder einer photischen Stimulation5 noch zusammen. Diese Beobachtungen, die mit den klassischen Kriterien von Thompson und Spencer für die Gewöhnung bei Tieren6 übereinstimmen, deuten stark darauf hin, dass die ursprüngliche kontraktile Reaktionsabnahme eher auf Lernen als auf Müdigkeit oder ATP-Erschöpfung zurückzuführen ist. Als freilebende Zelle kann Stentor ohne große Störungen durch umgebende Zellen untersucht werden, wie es in einem mehrzelligen Gewebe der Fall wäre. Mehrere zusätzliche Merkmale machen Stentor zu einem handhabbaren System für Lernstudien: seine Größe (1 mm), seine quantifizierbare Gewöhnungsreaktion3, die Leichtigkeit der Injektion und Mikromanipulation7, das vollständig sequenzierte Genom8 und die Verfügbarkeit von RNA-Interferenzwerkzeugen (RNAi)9. Um diesen Modellorganismus zur Erforschung des Zelllernens ohne Gehirn oder Nervensystem zu nutzen, ist ein reproduzierbares Verfahren zur Stimulation von Stentorzellen und zur Messung der Reaktion erforderlich.
Hier stellen wir eine Methode zur Quantifizierung der Stentor-Gewöhnung unter Verwendung einer Mikrocontroller-platinengebundenen Vorrichtung vor, die mechanische Impulse mit einer bestimmten Kraft und Frequenz liefern kann, einschließlich Methoden zum Aufbau der Vorrichtung und zum Aufbau des Experiments in einer Weise, die externe Störungen minimiert (Abbildung 1). Das Verständnis der Gewöhnung auf der Ebene einer einzelnen Zelle wird dazu beitragen, Lernparadigmen zu charakterisieren, die unabhängig von komplexen Schaltkreisen sind.

Abbildung 1: Aufbau des Gewöhnungsexperiments. Die Petriplatte mit Stentor wird auf das flexible Metalllineal des Gewöhnungsgeräts gelegt. Der Anker der Gewöhnungsvorrichtung trifft dann mit einer bestimmten Kraft und Frequenz auf das Metalllineal und erzeugt eine Reizwelle über das Zellfeld. Die USB-Mikroskopkamera zeichnet die Reaktionen des Stentor auf die Stimulation auf. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
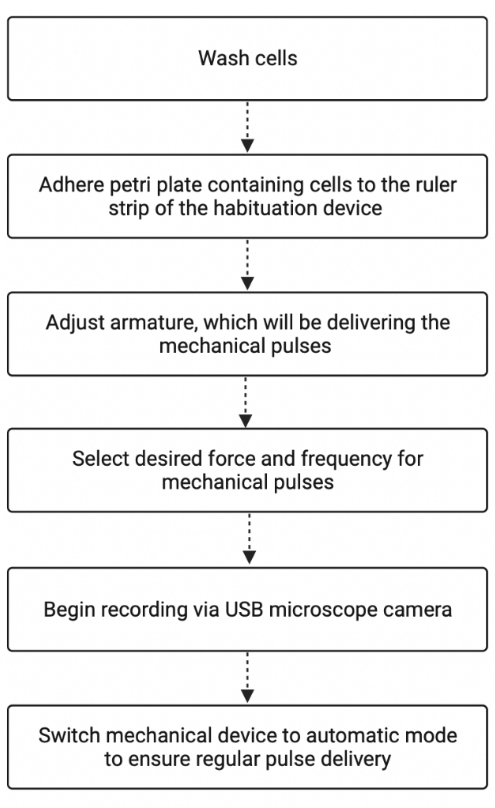
Abbildung 2: Zusammenfassung des Arbeitsablaufs des Gewöhnungsexperiments. Die Abbildung zeigt die grundlegenden Schritte bei der Untersuchung von Stentor mit dem Gewöhnungsgerät. Die Figur wurde mit BioRender.com erstellt. Adaptiert von “Process Flowchart”, von BioRender.com (2022). Abgerufen von https://app.biorender.com/biorender-templates. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Protocol
Representative Results
Discussion
Die kritischsten Schritte im Protokoll beziehen sich darauf, sicherzustellen, dass der Stentor unter optimalen Bedingungen für Kontraktionen bleibt. Die Kontraktionsreaktion im Gewöhnungstest erfordert, dass Stentors mit ihrem klebrigen Halt an einer Oberfläche verankert werden, da sie sich selten zusammenziehen, wenn sie frei schwimmen. Die Unterseite der 35-mm-Petriplatte, die für Gewöhnungsexperimente verwendet wird, ist jedoch normalerweise nicht förderlich für die Verankerung, es sei denn, sie ist mit Polyornithin beschichtet. Darüber hinaus kann der Stentor mindestens 2 h vor Beginn des Gewöhnungsexperiments keiner mechanischen Störung ausgesetzt werden, da die Stentor-Vergessenszeitskala 2-6 h3 beträgt. Wenn Stentor innerhalb von 2 Stunden nach Beginn des Gewöhnungsexperiments eine mechanische Stimulation erhält, besteht die Möglichkeit, dass diese vorherige Stimulation vor dem Experiment ein leichtes Maß an Gewöhnung induziert, wodurch die Kontraktionswahrscheinlichkeit verringert wird, nachdem die Gewöhnungsvorrichtung den ersten mechanischen Impuls abgegeben hat. Schließlich ist es während der Analysephase wichtig, nur die Anzahl der Stentor zu zählen, die sich nach einem Puls zusammenziehen – und nicht zufällige spontane Kontraktionen, die vor der Pulsabgabe auftreten -, um eine genaue Anzeige des Anteils der Zellen zu erhalten, die sich als Reaktion auf die mechanische Stimulation zusammengezogen haben.
Das Protokoll kann leicht modifiziert werden, um verschiedene Arten von Gewöhnungsdynamik zu untersuchen, indem die Kraft und Frequenz der mechanischen Impulse geändert werden, die von der Gewöhnungsvorrichtung abgegeben werden. Dies bietet auch die Möglichkeit, andere Arten des Lernens, wie z.B. Sensibilisierung, zu erforschen, die in Stentor auftreten könnten. Der Programmcode der Mikrocontroller-Platine selbst kann ebenfalls angepasst werden, um verschiedene Muster mechanischer Taps an den Stentor zu liefern.
Ein potenzielles Problem, das mit diesem Protokoll behoben werden muss, ist die geringe Frequenz der Stentor-Verankerung, die die Anzahl der Stentor, die im Gewöhnungsexperiment beobachtet werden kann, einschränken könnte. Die Verankerungsfrequenz ist manchmal in Stentor Kulturen reduziert, die nicht kürzlich gefüttert wurden oder kontaminiert sind. Um dieses Problem anzugehen, sollte man eine frische Charge Stentor waschen, um eine neue Kultur zu beginnen, und sie regelmäßig gemäß dem in Lin et al.10 beschriebenen Protokoll füttern.
Dieses Protokoll ist insofern eingeschränkt, als nur eine einzige Platte Stentor gleichzeitig getestet werden kann, was zu Messungen mit relativ niedrigem Durchsatz führt. Darüber hinaus erlaubt die aktuelle Software keine Automatisierung der Einzelzellbildanalyse. Die meisten erhobenen Daten beziehen sich daher auf Bevölkerungsebene. Zukünftige Modelle des Gewöhnungsgeräts und der Bildanalysewerkzeuge könnten Einzelzellexperimente mit hohem Durchsatz erleichtern.
Die Gewöhnung in Stentor wurde zuvor mit Methoden untersucht, die von Wood3 beschrieben wurden, aber dieses neue Protokoll ermöglicht die Automatisierung von Experimenten. Die Automatisierung ermöglicht es dem Forscher nicht nur, mechanische Impulse mit einer bestimmten Kraft und Frequenz reproduzierbar zu liefern, sondern erleichtert auch langfristige Gewöhnungsexperimente, da das Gerät tagelang unbeaufsichtigt laufen kann. Darüber hinaus verringert die Verwendung eines Schrittmotors anstelle des in Woods Experimenten3 verwendeten Magneten das Risiko einer Entmagnetisierung im Laufe der Zeit und ermöglicht es auch, die Stärke des Stimulus im Laufe eines einzelnen Experiments zu variieren.
Die Untersuchung der zellulären Gewöhnung kann klinische Erkenntnisse für Erkrankungen wie Aufmerksamkeitsdefizit- / Hyperaktivitätsstörung (ADHS) und Tourette-Syndrom liefern, bei denen die Gewöhnung beeinträchtigt ist11. Stentor Gewöhnungsmechanismen können auch neue nicht-synaptische Lernparadigmen unabhängig von komplexen zellulären Schaltkreisen enthüllen. Schließlich könnten Erkenntnisse über das Einzelzelllernen zu Methoden zur Reprogrammierung von Zellen in mehrzelligen Geweben inspirieren – ein weiterer potenzieller Weg zur Bekämpfung von Krankheiten.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wir danken Tatyana Makushok für unzählige Diskussionen über das Lernen von Stentor . Diese Arbeit wurde durch den NSF-Zuschuss MCB-2012647 und durch den NIH-Zuschuss R35 GM130327 sowie durch den I2CELL-Preis der Stiftung Fourmentin-Guilbert finanziert.
Materials
| 0.01% Poly-ornithine | Millipore Sigma | P4957 | Used to coat Petri plate |
| 35-mm Petri plate | Benz Microscope Optics Center Inc. | L331 | Contains Stentor during experiments |
| 6-well plate | StemCell Technologies | 38016 | Used to wash Stentor |
| Aluminum breadboard, 4" x 24" x 1/2" (x1) | Thorlabs | MB424 | Used to construct habituation device |
| Big easy driver stepper motor driver board (x1) | Sparkfun | ROB-12859 | Used to construct habituation device |
| Construction rail, 1" x 5'' (x2) | Newport | Newport CR-1 | Used to construct habituation device |
| Laptop | Apple Store | https://www.apple.com/macbook-air-m1/ | Connect laptop to USB microscope to visualize experiments |
| Large right-angle bracket (x1) | Thorlabs | AP90RL | Used to construct habituation device |
| Microcontroller board | Arduino | A000066 | Used to control habituation device |
| Nema 17 Stepper Motor Bipolar 59Ncm 2A 84oz.in 48mm 4-Lead | Stepperonline.com | 5-17HS19-2004S1 | Used to construct habituation device |
| Pasteurized spring water | Carolina | 132458 | Media for Stentor experiments |
| Right-angle bracket (x3) | Thorlabs | AP90 | Used to construct habituation device |
| Stemi 2000 stereo microscope | Zeiss | Used to visualize Stentor during wash steps | |
| Stentor coeruleus | Carolina | 131598 | These are the cells used for habituation experiments |
| USB microscope | Celestron | 44308 | Used to visualize and record experiments |
| Webcam recorder | Apple Store | https://apps.apple.com/us/app/webcam-recorder/id1508067444?mt=12 | Install this application to take videos of experiments |
References
- Dussutour, A. Learning in single cell organisms. Biochemical and Biophysical Research Communications. 564, 92-102 (2021).
- Sternberg, R. J. Intelligence. Dialogues in Clinical Neuroscience. 14 (1), 19-27 (2012).
- Wood, D. C. Parametric studies of the response decrement produced by mechanical stimuli in the protozoan, Stentor coeruleus. Journal of Neurobiology. 1 (3), 345-360 (1969).
- Tang, S. K. Y., Marshall, W. F. Cell learning. Current Biology. 28 (20), 1180-1184 (2018).
- Wood, D. C. Stimulus specific habituation in a protozoan. Physiology and Behavior. 11 (3), 349-354 (1973).
- Thompson, R. F., Spencer, W. A. Habituation: A model phenomenon for the study of neuronal substrates of behavior. Psychological Review. 73 (1), 16-43 (1966).
- Slabodnick, M. M., Marshall, W. M. Stentor coeruleus. Current Biology. 24 (17), 783-784 (2014).
- Slabodnick, M. M., et al. The macronuclear genome of Stentor coeruleus reveals tiny introns in a giant cell. Current Biology. 27 (4), 569-575 (2017).
- Slabodnick, M. M., et al. The kinase regulator Mob1 acts as a patterning protein for Stentor morphogenesis. PLoS Biology. 12 (5), 1001861 (2014).
- Lin, A., Makushok, T., Diaz, U., Marshall, W. F. Methods for the study of regeneration in Stentor. Journal of Visualized Experiments. (136), e57759 (2018).
- McDiarmid, T. A., Bernardos, A. C., Rankin, C. H. Habituation is altered in neuropsychiatric disorders-A comprehensive review with recommendations for experimental design and analysis. Neuroscience and Biobehavioral Reviews. 80, 286-305 (2017).

