تصميم وبناء مجهر مضان أحادي الهدف قابل للتخصيص لتصور شبكات الهيكل الخلوي
Summary
يصف هذا البروتوكول بالتفصيل كيفية بناء مجهر مضان أحادي الهدف وضوء ورقة واستخدامه لتصور شبكات الهيكل الخلوي.
Abstract
ظهرت مركبات الهيكل الخلوي المعاد تشكيلها كنظام نموذجي قيم لدراسة المادة الرخوة غير المتوازنة. إن الالتقاط المؤمن لديناميات هذه الشبكات الكثيفة 3D يستدعي التقسيم البصري ، والذي غالبا ما يرتبط بالمجاهر البؤرية الفلورية. ومع ذلك ، فإن التطورات الأخيرة في الفحص المجهري الفلوري للصفائح الضوئية (LSFM) قد أثبتت أنها بديل فعال من حيث التكلفة ، وفي بعض الأحيان ، متفوق. لجعل LSFM في متناول باحثي الهيكل الخلوي أقل دراية بالبصريات ، نقدم دليلا للمبتدئين خطوة بخطوة لبناء مجهر مضان متعدد الاستخدامات من مكونات جاهزة. لتمكين تركيب العينة باستخدام عينات الشرائح التقليدية ، يتبع LSFM تصميم ورقة الضوء أحادية الهدف (SOLS) ، والتي تستخدم هدفا واحدا لكل من مجموعة الإثارة والانبعاثات. نصف وظيفة كل مكون من مكونات SOLS بتفاصيل كافية للسماح للقراء بتعديل الأجهزة وتصميمها لتناسب احتياجاتهم الخاصة. أخيرا ، نوضح استخدام أداة SOLS المخصصة هذه من خلال تصور زهور النجمة في شبكات الأنابيب الدقيقة التي يحركها كينيسين.
Introduction
يمثل الفحص المجهري الفلوري للصفائح الضوئية (LSFM) عائلة من تقنيات التصوير الفلوري عالية الدقة التي يتشكل فيها ضوء الإثارة في ورقة 1,2 ، بما في ذلك مجهر الإضاءة المستوية الانتقائية (SPIM) ، والإثارة المستوية المحاذية للخلط (SCAPE) ، والمجهر المائل المستوى (OPM)3،4،5،6،7. على عكس طرق الفحص المجهري الأخرى مثل التألق الوبائي ، أو الفحص المجهري الفلوري الداخلي الكلي (TIRFM) ، أو الفحص المجهري متحد البؤر ، تكون السمية الضوئية ضئيلة في LSFM ويمكن تصوير العينات على مدى فترات زمنية أطول لأن مستوى العينة التي يتم تصويرها بنشاط فقط هو المضاء8،9،10. لذلك ، تعد تقنيات LSFM مفيدة للغاية لتصوير عينات 3D على مدى فترات زمنية طويلة ، ولا سيما تلك السميكة جدا لتقنيات الفحص المجهري متحد البؤر. بسبب هذه الأسباب ، منذ تطويره الأصلي في عام 2004 ، أصبح LSFM تقنية التصوير المفضلة للعديد من علماء الفسيولوجيا وعلماء الأحياء التنموية وعلماء الأعصاب لتصور الكائنات الحية بأكملها مثل الزرد الحي وأجنة ذبابة الفاكهة 3،4،6،11. في هذين العقدين الماضيين ، تم الاستفادة من مزايا LSFM لتصور البنية والديناميكيات على نطاقات أصغر تدريجيا ، بما في ذلك الأنسجة11،12 ، والمقاييس الخلوية ، والخلوية ، سواء في الجسم الحي أو في المختبر13،14،15،17.
على الرغم من تقارير حالات الاستخدام الناجحة في الأدبيات ، فإن التكلفة العالية لأنظمة LSFM التجارية (~ 0.25 مليون دولار أمريكي حتى وقت كتابة هذا التقرير)18,19 تمنع الاستخدام الواسع النطاق لهذه التقنية. لجعل تصميمات DIY بديلا مجديا للباحثين ، تم نشر أدلة بناء متعددة8،13،20،21 ، بما في ذلك جهد الوصول المفتوح OpenSPIM22. ومع ذلك ، حتى الآن ، يمكن للباحثين الذين لديهم الحد الأدنى من الخبرة البصرية استخدام تصميمات LSFM السابقة فقط ، والتي لا تتوافق مع العينات التقليدية المثبتة على الشرائح (الشكل 1 أ). يستخدم التنفيذ الأخير للورقة الخفيفة (SOLS) هدفا واحدا لكل من الإثارة والكشف (الشكل 1C) ، وبالتالي التغلب على القيود المتعلقة بالتوافق5،6،8،13،20. ومع ذلك ، فإن تكلفة تعدد استخدامات تصميم SOLS هي زيادة كبيرة في تعقيد البناء بسبب متطلبات هدفين إضافيين لترحيل مستوى الكائن وإزالة إمالته وإعادة تصويره على الكاميرا للتصوير (الشكل 1D). لتسهيل الوصول إلى الإعدادات المعقدة على غرار SOLS ، تقدم هذه الورقة دليلا تفصيليا حول تصميم وبناء وعملية محاذاة واستخدام نظام SOLS المتوافق مع الشرائح ، والذي سيكون مفيدا للباحثين الذين لديهم معرفة بدورة بصريات للمبتدئين فقط.
على الرغم من أن البروتوكول نفسه موجز ، يجب على القراء الرجوع إلى موارد أخرى أثناء خطوات الإعداد لمعرفة المزيد حول أجزاء معينة من اعتبارات التصميم أو الأجهزة. ومع ذلك ، إذا كان القارئ ينوي اتباع مواصفات هذا التصميم ، فقد لا يكون من الضروري فهم كيفية اختيار مكونات بصرية معينة.
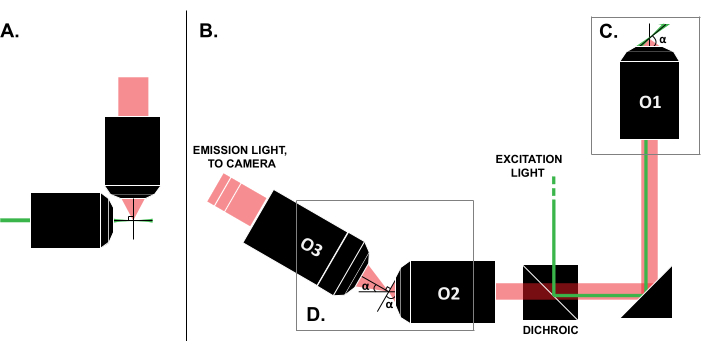
الشكل 1: خصائص تكوينات LSFM المختلفة. (أ) الإعداد بهدفين متعامدين شائعين في تصميمات LSFM المبكرة. في هذا التكوين ، يتم استخدام أنبوب شعري أو أسطوانة من الجل لاحتواء العينة ، وهو أمر غير متوافق مع تقنيات تركيب الشريحة التقليدية. (ب) رسم تخطيطي لتصميم ورقة ضوئية SOLS يوضح ما يلي: (ج) الهدف الوحيد المستخدم لكل من الإثارة وجمع الانبعاثات في مستوى العينة (O1) ؛ يسمح ذلك بتركيب شريحة تقليدية في الأعلى ، و (د) نظام هدف الترحيل في مسار انبعاث SOLS. يجمع O2 ضوء الانبعاث ويزيل تكبير الصورة. يقوم O3 بتصوير المستوى بزاوية الميل الصحيحة على مستشعر الكاميرا. الاختصارات: LSFM = المجهر الفلوري للصفائح الضوئية ؛ SOLS = ورقة ضوء أحادية الهدف ؛ O1-O3 = الأهداف. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
هناك تفصيلان مهمان فيما يتعلق بهذا البروتوكول هما التكلفة الإجمالية للنظام ووقت البناء والمحاذاة المتوقع. على الرغم من أن التكلفة الدقيقة متغيرة ، يمكننا أن نقدر بشكل مريح أن التكلفة الكاملة ل SOLS أو نظام DIY مشابه ستقع في حدود 85,000 دولار أمريكي. نلاحظ أن هذا التقدير يأخذ في الاعتبار سعر التجزئة لجميع المكونات ، لذلك قد يتم تخفيض هذا السعر الإجمالي بشكل كبير من خلال تحديد مصادر المكونات المستخدمة. من حيث وقت الإنشاء ، سيكون من المعقول توقع قيام مستخدم لديه خبرة قليلة في البصريات ببناء ومحاذاة نظام SOLS بأكمله في غضون 1-2 أشهر ، بشرط أن تكون جميع المكونات متوفرة وجاهزة. على الرغم من طول البروتوكول وتعقيده ، نعتقد أن مقدار التفاصيل في المخطوطة المكتوبة ، مقترنا ببروتوكول الفيديو ، يجب أن يجعل هذا البروتوكول مباشرا وسريعا في المتابعة.
هناك خطوتان حاسمتان في هذا البروتوكول. أولا ، يحدد موضع galvo موضع العديد من العدسات لأنه جزء من ثلاثة أزواج عدسات 4f منفصلة. من الأهمية بمكان أن يتم اقتران galvo مع المستويات البؤرية الخلفية ل O1 و O2 وتوسيطها بشكل صحيح لضمان المسح الضوئي الثابت للإمالة. ثانيا ، جودة الصورة حساسة للغاية لمحاذاة O2 و O3 فيما يتعلق ببعضهما البعض. هنا ، يجب توخي الحذر للتأكد من أن زاوية المحاذاة من O3 إلى O2 تتطابق أولا مع إمالة ورقة ضوء الإثارة ، وبالتالي توفير إضاءة مسطحة إلى أقصى حد عبر FoV المائل بالمثل. ثانيا ، يجب وضع O3 على المسافة المحورية الصحيحة للحفاظ على FoV مسطح بأكبر مساحة ممكنة. ثالثا ، يجب وضع O3 على المسافة الجانبية الصحيحة من O2 لتعظيم الإشارة التي تمر عبر واجهة O2-O3.
من حيث FoV القابل للاستخدام ، حقق هذا النظام مجالا مسطحا وموثوقا به مع إضاءة متسقة عبر مساحة 80 ميكرومتر × 80 ميكرومتر. هذه المنطقة أصغر من الحد الأقصى ل FoV الذي توفره الكاميرا ، لذلك يشار إلى FoV القابل للاستخدام بواسطة المربع الأصفر في الشكل 13. من حيث قوة الحل ، حقق هذا النظام مسافة قابلة للحل لا تقل عن 432 نانومتر على طول المحور السيني و 421 نانومتر على طول المحور ص ، والتي تم قياسها من خلال إيجاد متوسط سيغما x و y لتناسب غاوسيان لدوال انتشار النقطة (PSFs) في FoV الجيد والضرب في اثنين. نلاحظ أن هذا النظام لم يتم تحسينه من حيث إجمالي NA ، مما يعني أن هناك مجالا للتحسين الكبير إذا رغب المستخدمون في قوة حل أعلى مما حققه هذا النظام. هناك العديد من الخيارات الموضوعية المتوافقة لهذا النوع من بناء SOLS ، والتي سيساهم الكثير منها في دقة نظام أعلى ولكن مع عيوب التكلفة الأعلى أو FoV الأصغر أو تقنيات المحاذاة الأكثر تعقيدا في واجهة الترحيل8،11،13،20. بشكل منفصل ، إذا رغب المستخدمون في الحصول على FoV أكبر ، فإن دمج galvo ثان للسماح بمسح 2D سيحقق هذا الهدف ولكنه سيتطلب دمج بصريات وميكانيكا تحكم إضافية في التصميم32. لقد قدمنا مزيدا من التفاصيل حول التعديلات على النظام على صفحة موقعنا على الويب ، إلى جانب روابط لموارد مفيدة أخرى تتعلق بعملية التصميم23.
بالإضافة إلى تحسين المكونات المحددة لهذا التصميم المعين ، سيكون من الممكن جدا إضافة تقنيات أو طرائق مجهرية أخرى عالية الدقة إلى هذا البناء. أحد هذه التحسينات هو دمج الإضاءة متعددة الأطوال الموجية ، والتي ستتضمن محاذاة ليزر إثارة إضافي إلى مسار الإثارة الأصلي8. علاوة على ذلك ، نظرا لأن هذا النوع من تصميم SOLS يترك العينة متاحة ، فإن إضافة وظائف إضافية إلى المجهر ، بما في ذلك على سبيل المثال لا الحصر الملقط البصري ، وعلم الموائع الدقيقة ، وقياس الريومترية ، يكون واضحا نسبيا 2,33.
مقارنة بأدلة ورقة الضوء التي لا تعد ولا تحصى التي تم نشرها ، يوفر هذا البروتوكول تعليمات على مستوى من الفهم قد يجدها المستخدم الذي ليس لديه خبرة كبيرة في البصريات مفيدا. من خلال إنشاء SOLS سهل الاستخدام باستخدام إمكانات تركيب شرائح العينات التقليدية في متناول جمهور أكبر ، نأمل في تمكين المزيد من التوسع في تطبيقات البحث القائم على SOLS في جميع المجالات التي تستخدم فيها الأداة أو يمكن استخدامها. حتى مع النمو السريع لتطبيقات أدوات SOLS في العدد2،34،35 ، نعتقد أن العديد من الفوائد والاستخدامات للأدوات من نوع SOLS لا تزال غير مستكشفة ونعرب عن الإثارة في إمكانيات هذا النوع من الأدوات للمضي قدما.
Disclosures
The authors have nothing to disclose.
Acknowledgements
تم دعم هذا العمل من قبل جائزة RUI للمؤسسة الوطنية للعلوم (NSF) (DMR-2203791) إلى JS. نحن ممتنون للإرشادات التي قدمها الدكتور بن يانغ والدكتور مانيش كومار خلال عملية المواءمة. نشكر الدكتورة جيني روس و K. Alice Lindsay على تعليمات التحضير لمحركات kinesin.
Materials
| 1" Plano-Concave Lens f = -50 mm | Thorlabs | LC1715-A-ML | For alignment laser Estimated Cost: $49.5 |
| 1" Achromatic Doublet f = 100 mm (x3) | Thorlabs | AC254-100-A-ML | L2, L4 and alignment laser Estimated Cost: $342.42 |
| 1" Achromatic Doublet f = 125 mm | Thorlabs | AC254-125-A-ML | SL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | L3 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | TL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 45 mm | Thorlabs | AC254-045-A-ML | L1 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 75 mm | Thorlabs | AC254-075-A-ML | SL1 Estimated Cost: $114.14 |
| 1" Cylindrical Lens f = 100 mm | Thorlabs | LJ1567RM | CL3 Estimated Cost: $117.62 |
| 1" Cylindrical Lens f = 200 mm | Thorlabs | LJ1653RM | CL2 Estimated Cost: $111.22 |
| 1" Cylindrical Lens f = 50 mm | Thorlabs | LJ1695RM | CL1 Estimated Cost: $117.62 |
| 1" Mounted Pinhole, 30 µm Pinhole Diameter | Thorlabs | P30K | Estimated Cost: $77.08 |
| 1" Silver Mirror (x3) | Thorlabs | PF10-03-P01 | M1, M2, one for alignment Estimated Cost: $168.78 |
| 2" Elliptical Mirror | Thorlabs | PFE20-P01 | M3 Estimated Cost: $179.98 |
| 2" Post Holder (x11) | Thorlabs | PH2 | For custom laser mount, ND wheel, safety screens Estimated Cost: $98.45 |
| 2" Posts (x47) | Thorlabs | TR2 | For custom laser mount and optical components Estimated Cost: $277.3 |
| 3" Posts (x4) | Thorlabs | TR3 | For M3 supports and other mounts Estimated Cost: $24.6 |
| 3" Post Holder (x4) | Thorlabs | PH3 | Estimated Cost: $38.48 |
| 30 to 60 mm Cage Adapter | Thorlabs | LCP33 | To mount O1 Estimated Cost: $45.42 |
| 30mm Cage Filter Wheel | Thorlabs | CFW6 | To mount ND filters Estimated Cost: $172.36 |
| 30mm Cage Plate (x6) | Thorlabs | CP33 | To build alignment cage and alignment laser Estimated Cost: $114.54 |
| 30mm Right-Angle Kinematic Mirror Mount (x3) | Thorlabs | KCB1 | To mount M1 and M2 and for alignment laser Estimated Cost: $463.95 |
| 4" Post Holder (x30) | Thorlabs | PH4 | Estimated Cost: $320.1 |
| 561 nm Laser and Power Supply | Opto Engine LLC | MGL-FN-561-100mW | Excitation laser Estimated Cost: $6000 |
| 60mm Cage Plate (x2) | Thorlabs | LCP01 | To mount TL1 and M3 mount Estimated Cost: $88.52 |
| 60mm Right-Angle Kinematic Mirror Mount | Thorlabs | KCB2 | To mount M3 Estimated Cost: $187.26 |
| 90° Flip Mount | Thorlabs | TRF90 | For alignment laser Estimated Cost: $95.5 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | Thorlabs | SM1A9 | To connect lens tube to camera Estimated Cost: $20.96 |
| Adapter with External SM1 Threads and Internal C-Mount Threads | Thorlabs | SM1A10 | To connect tube lens to lens mount Estimated Cost: $21.82 |
| Adapter with External SM1 Threads and Internal M25 Threads (x2) | Thorlabs | SM1A12 | To mount O1 and O2 Estimated Cost: $47.06 |
| Adapter with External SM1 Threads and Internal M26 Threads | Thorlabs | SM1A27 | To mount O3 Estimated Cost: $22.38 |
| Alignment Disk | Thorlabs | SM1A7 | Estimated Cost: $20.45 |
| Alignment Laser | BISKEE | https://www.amazon.com/Tactical-Presentation-Teaching-Interactive-Adjustable/dp/B09B1VXPNM Estimated Cost: $16.98 |
|
| Autoluorescent Plastic Slide, Red | Chroma | 92001 | Estimated Cost: $20 |
| Beam Shutter | Thorlabs | SM1SH1 | To block laser light Estimated Cost: $65.8 |
| Cage Rotation Mount (x3) | Thorlabs | CRM1T | To mount CL1-3 Estimated Cost: $282.15 |
| Cage System Rods 1" (x8) | Thorlabs | ER1 | To mount M3 and O1 Estimated Cost: $44.8 |
| Cage System Rods 3" (x2) | Thorlabs | ER3 | To mount O3 Estimated Cost: $14.28 |
| Cage System Rods 4" (x4) | Thorlabs | ER4 | To mount slit Estimated Cost: $30.76 |
| Cage System Rods 8" (x2) | Thorlabs | ER8 | For tube lens alignment Estimated Cost: $25.3 |
| Cage System Rods 12" (x8) | Thorlabs | ER12 | For alignment cage Estimated Cost: $145.36 |
| Camera | Andor | Zyla 4.2 sCMOS | Estimated Cost: ~$14,000 |
| Clamping Fork (x35) | Thorlabs | CF125 | To clamp down post mounts Estimated Cost: $338.8 |
| Cover Glass, 22 x 22 mm | Corning | 2850-22 | For slide samples Estimated Cost: $265 |
| Dichroic | AVR | DI01-R405/488/561/635-25×36 | To split exciation/emission paths Estimated Cost: $965 |
| Dovetail Translation Stage | Thorlabs | DT12 | To translate pinhole Estimated Cost: $90.55 |
| Emission Filter | Thorlabs | FELHO600 | Estimated Cost: $140.99 |
| Frosted Glass Alignment Disk (x2) | Thorlabs | DG10-1500-H1 | For alignment cage and intermediate plane Estimated Cost: $75.14 |
| Function Generator | Hewlett-Packard | HP 33120A 15 MHz | To control galvo Estimated Cost: $900 |
| Galvanometer – 1D Large Beam Diameter System | Thorlabs | GVS011 | Estimated Cost: $1715.78 |
| Galvanometer Power Supply | Siglent | SPD3303C | Estimated Cost: $300 |
| Gelrite | Research Products International | G35020-100.0 | Gellan gum for 3D bead sample Estimated Cost: $68.25 |
| FIJI Software | Open-source | Download from https://imagej.net/software/fiji/downloads Estimated Cost: Free |
|
| Hot Plate/ Stirrer | Corning | 6795-220 | For preparing sample solutions Estimated Cost: $550 |
| K-Cube Brushed Motor Controller | Thorlabs | KDC101 | Drives Z825B Estimated Cost: $757.51 |
| Kinematic Mount | Thorlabs | KM100S | To mount dichroic Estimated Cost: $92.01 |
| Kinesis Software | Thorlabs | Download from https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=10285 Estimated Cost: Free |
|
| Laser Light Blocker | Thorlabs | LB1 | For ND filter reflections Estimated Cost: $57.65 |
| Laser Mount | custom made | 3D printed Estimated Cost: N/A |
|
| Laser Safety Screen (x2) | Thorlabs | TPS4 | For blocking stray laser light Estimated Cost: $92.02 |
| Laser Scanning Tube Lens | Thorlabs | TTL200MP | TL1 Estimated Cost: $1491 |
| Lens Mount (x10) | Thorlabs | LMR1 | To mount all lens and extra alignment mirror. Estimated Cost: $164.7 |
| Magnetic Ruler | Thorlabs | BHM4 | To check alignment Estimated Cost: $52.74 |
| Micro-Manager Software | Open-source | Download from https://micro-manager.org/Download_Micro-Manager_Latest_Release Estimated Cost: Free |
|
| Microscope Slides | Thermo Fisher Scientific | 12550400 | For slide samples Estimated Cost: $123.9 |
| Microscope Stage | ASI | FTP-2000 with custom parts | To fine-translate samples Estimated Cost: ~$16,000 |
| Mini Vortex Mixer | VWR | 10153-688 | For sample preparation Estimated Cost: $152.64 |
| Motorized Actuator | Thorlabs | Z825B | To fine-translate M1 Estimated Cost: $729.07 |
| Mounted Standard Iris (x2) | Thorlabs | ID20 | At least 2 for alignment Estimated Cost: $118.02 |
| ND Filter Set | Thorlabs | NDK01 | To reduce excitation intensity Estimated Cost: $726.73 |
| Objective Lens 1 | Nikon | Plan Apo 60X/ 1.20 WI | O1 Estimated Cost: ~$15,000 |
| Objective Lens 2 | Nikon | TU Plan Fluor 100X/0.90 | O2 Estimated Cost: ~$6,000 |
| Objective Lens 3 | Mitutoyo | Plan Apo HR 50X/0.75 | O3 Estimated Cost: ~$6,800 |
| OPM Deskewing Software | Open-source | For image processing. Download from https://github.com/QI2lab/OPM Estimated Cost: Free |
|
| Photodiode Power Sensor | Thorlabs | S121C | For measuring laser intensity Estimated Cost: $379.68 |
| Positive Grid Distortion Target | Thorlabs | R1L3S3P | Brightfield alignment Estimated Cost: $267.87 |
| Power Meter Digital Console | Thorlabs | PM100D | For measuring laser intensity Estimated Cost: $1245.48 |
| Rhodamine 6G | Thermo Scientific | J62315.14 | For fluorescent coated slide sample Estimated Cost: $27.7 |
| Right-Angle Clamp for Posts | Thorlabs | RA90 | For M3 support and flip down mirror Estimated Cost: $32.46 |
| RMS-Threaded Cage Plate (x2) | Thorlabs | CP42 | For alignment laser Estimated Cost: $70.56 |
| Shear Plate 2.5-5.0 mm | Thorlabs | SI050P | Estimated Cost: $182.85 |
| Shear Plate 5.0-10.0 mm | Thorlabs | SI100P | Estimated Cost: $201.47 |
| Shear Plate 10.0-25.4 mm | Thorlabs | SI254P | Estimated Cost: $236.42 |
| Shear Plate Viewing Screen | Thorlabs | SIVS | Estimated Cost: $337.74 |
| Shearing Interferometer with 1-3 mm Plate | Thorlabs | SI035 | For checking collimation Estimated Cost: $465.85 |
| Slip-On Post Collar (x35) | Thorlabs | R2 | To maintain post height Estimated Cost: $208.25 |
| Slit | Thorlabs | VA100 | Estimated Cost: $294.64 |
| Slotted Lens Tube, 3" | Thorlabs | SM1L30C | For alignment laser Estimated Cost: $77.45 |
| Square Mirror, 1 x 1" | https://www.amazon.com/Small-Square-Mirror-Pieces-Mosaic/dp/B07FBNMDC1/ref=asc_df_B07FBNMDC1/?tag=hyprod-20&linkCode=df0&hva did=642191768069&hvpos=&hvne tw=g&hvrand=1336734911900437 4691&hvpone=&hvptwo=&hvqmt= &hvdev=c&hvdvcmdl=&hvlocint=& hvlocphy=9031212&hvtargid=pla-1 943952718742&gclid=Cj0KCQiA6L yfBhC3ARIsAG4gkF_AYBpn5EdGL q3mc-RU-nanT5vM4ac9r3-obbzqJoWKPkIPIJU6e1caAjWmEA Lw_wcB&th=1 Estimated Cost: $14.76 |
||
| Stackable Lens Tube 1/2" (x3) | Thorlabs | SM1L05 | To mount CL1-3 Estimated Cost: $40.86 |
| Stackable Lens Tube 1" | Thorlabs | SM1L10 | To mount O3 Estimated Cost: $15.41 |
| Stackable Lens Tube 2" (x2) | Thorlabs | SM1L20 | For camera path Estimated Cost: $35.7 |
| Studded Pedestal Base Adapter (x37) | Thorlabs | BE1 | To attach post mounts to table Estimated Cost: $400.71 |
| Translating Lens Mount (x3) | Thorlabs | LM1XY | To fine-translate pinhole, O2 and O3 Estimated Cost: $441 |
| Translation Stage with Standard Micrometer (x2) | Thorlabs | PT1/M | TS1-2 Estimated Cost: $647.54 |
| Travel Manual Translation Stage | Thorlabs | CT1A | O3 cage translation mount Estimated Cost: $497.3 |
| Tube Lens | Nikon | MXA20696 | TL3 Estimated Cost: $359 |
| White Mounted LED | Thorlabs | MNWHL4 | Brightfield light source Estimated Cost: $171.28 |
| TOTAL ESTIMATED COST: $84,858.98 | |||
| The authors note that many parts were bought used. Here, we have attempted to reflect the retail price of all items, so the total cost can be greatly reduced by buying particular items used, especially the more expensive ones. | |||
| OPTIONAL COMPONENTS | |||
| Grasshopper3 USB3 | FLIR | GS3-U3-23S6C-C | For diagnostic checks during alignment. Acquisiton camera can be used instead, but requires realignment afterwards. Estimated Cost: $1089 |
References
- Girkin, J. M., Carvalho, M. T. The light-sheet microscopy revolution. Journal Optics. 20 (5), 053002 (2018).
- You, R., McGorty, R. Light sheet fluorescence microscopy illuminating soft matter. Frontiers in Physics. 9, 760834 (2021).
- Fuchs, E., Jaffe, J. S., Long, R. A., Azam, F. Thin laser light sheet microscope for microbial oceanography. Optics Express. 10 (2), 145-154 (2002).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Dunsby, C. Optically sectioned imaging by oblique plane microscopy. Optics Express. 16 (25), 20306-20316 (2008).
- Bouchard, M. B., et al. Swept confocally-aligned planar excitation (SCAPE) microscopy for high-speed volumetric imaging of behaving organisms. Nature Photonics. 9 (2), 113-119 (2015).
- Smith, C. W., Botcherby, E. J., Wilson, T. Resolution of oblique-plane images in sectioning microscopy. Optics Express. 19 (3), 2662-2669 (2011).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Wu, Y., et al. Simultaneous multiview capture and fusion improves spatial resolution in wide-field and light-sheet microscopy. Optica. 3 (8), 897-910 (2016).
- Sahasrabudhe, A., Vittal, V., Ghose, A. Peeping in on the cytoskeleton: Light microscopy approaches to actin and microtubule organization. Current Science. 105 (11), 1562-1570 (2013).
- Kumar, M., Kishore, S., Nasenbeny, J., McLean, D. L., Kozorovitskiy, Y. Integrated one- and two-photon scanned oblique plane illumination (SOPi) microscopy for rapid volumetric imaging. Optics Express. 26 (10), 13027-13041 (2018).
- Kim, J., et al. Oblique-plane single-molecule localization microscopy for tissues and small intact animals. Nature Methods. 16 (9), 853-857 (2019).
- Sapoznik, E., et al. A versatile oblique plane microscope for large-scale and high-resolution imaging of subcellular dynamics. eLife. 9, e57681 (2020).
- Bernardello, M., Marsal, M., Gualda, E. J., Loza-Alvarez, P. Light-sheet fluorescence microscopy for the in vivo study of microtubule dynamics in the zebrafish embryo. Biomedical Optics Express. 12 (10), 6237-6254 (2021).
- Shelden, E. A., Colburn, Z. T., Jones, J. C. R. Focusing super resolution on the cytoskeleton. F1000Res. 5, (2016).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), (2019).
- Sheung, J. Y., Garamella, J., Kahl, S. K., Lee, B. Y., McGorty, R. J., Robertson-Anderson, R. M. Motor-driven advection competes with crowding to drive spatiotemporally heterogeneous transport in cytoskeleton composites. Frontiers in Physics. 10, 1055441 (2022).
- Zeiss Lightsheet 7. Light-Sheet Multiview Imaging of Living and Cleared Specimens. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lightsheet-7.html (2023)
- Zeiss Lattice Lightsheet 7. Long-Term Volumetric Imaging of Living Cells. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lattice-lightsheet-7.html (2023)
- Kumar, M., Kishore, S., McLean, D. L., Kozorovitskiy, Y. Crossbill: An open access single objective light-sheet microscopy platform. bioRxiv. , (2021).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: A tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Pitrone, P. G., et al. OpenSPIM: An open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Single Objective Light Sheet Microscope (SOLS) Guide. Sheung Lab Available from: https://sites.google.com/view/sheunglab/microscopy/single-objective-light-microscope-sols (2023)
- Lamb, J. R., Ward, E. N., Kaminski, C. F. Open-source software package for on-the-fly deskewing and live viewing of volumetric lightsheet microscopy data. Biomedical Optics Express. 14 (2), 834-845 (2023).
- . Harvard University. Mitchison Lab Available from: https://mitchison.hms.harvard.edu/home (2023)
- Watkins, S. C., St. Croix, C. M. Light sheet imaging comes of age. Journal of Cell Biology. 217 (5), 1567-1569 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Berezney, J., Goode, B. L., Fraden, S., Dogic, Z. Extensile to contractile transition in active microtubule-actin composites generates layered asters with programmable lifetimes. Proceedings of the National Academy of Sciences of the United States of America. 119 (5), e2115895119 (2022).
- Kim, K., et al. Isomorphic coalescence of aster cores formed in vitro from microtubules and kinesin motors. Physical Biology. 13 (5), 056002 (2016).
- Millett-Sikking, A., et al. . High NA single-objective lightsheet. , (2019).
- Bourgenot, C., Saunter, C. D., Taylor, J. M., Girkin, J. M., Love, G. D. 3D adaptive optics in a light sheet microscope. Optics Express. 20 (12), 13252-13261 (2012).
- Bernardello, M., Gualda, E. J., Loza-Alvarez, P. Modular multimodal platform for classical and high throughput light sheet microscopy. Scientific Reports. 12 (1), 1969 (2022).
- Crombez, S., Leclerc, P., Ray, C., Ducros, N. Computational hyperspectral light-sheet microscopy. Optics Express. 30 (4), 4856-4866 (2022).

