תכנון ובנייה של מיקרוסקופ פלואורסצנטי הניתן להתאמה אישית, חד-אובייקטיבי, עבור הדמיה של רשתות שלד ציטו-שלד
Summary
פרוטוקול זה מתאר בפירוט כיצד לבנות מיקרוסקופ פלואורסצנטי בעל מטרה אחת ויריעות אור ואת השימוש בו להדמיית רשתות שלד.
Abstract
חומרים מרוכבים של שלד ציטו-שלד משוחזר התפתחו כמערכת מודל רבת ערך לחקר חומר רך שאינו שיווי משקל. הלכידה הנאמנה של הדינמיקה של רשתות תלת-ממדיות וצפופות אלה דורשת חתך אופטי, הקשור לעתים קרובות למיקרוסקופים קונפוקליים פלואורסצנטיים. עם זאת, התפתחויות אחרונות במיקרוסקופ פלואורסצנטי של יריעות אור (LSFM) ביססו אותו כחלופה חסכונית, ולעתים עדיפה. כדי להפוך את LSFM לנגיש לחוקרי שלד ציטו-שלד שפחות בקיאים באופטיקה, אנו מציגים מדריך שלב אחר שלב למתחילים לבניית מיקרוסקופ פלואורסצנטי רב-תכליתי מרכיבי מדף. כדי לאפשר הרכבה של דגימות עם דגימות שקופיות מסורתיות, LSFM זה עוקב אחר עיצוב גיליון האור (SOLS) בעל מטרה יחידה, המשתמש במטרה אחת הן עבור איסוף העירור והן עבור איסוף הפליטה. אנו מתארים את הפונקציה של כל רכיב ב- SOLS בפירוט מספיק כדי לאפשר לקוראים לשנות את המכשור ולעצב אותו כך שיתאים לצרכים הספציפיים שלהם. לבסוף, אנו מדגימים את השימוש במכשיר SOLS מותאם אישית זה על ידי הדמיה של אסטרים ברשתות מיקרוטובולים מונעות קינזין.
Introduction
מיקרוסקופ פלואורסצנטי של יריעות אור (LSFM) מייצג משפחה של טכניקות הדמיה פלואורסצנטית ברזולוציה גבוהה שבהן אור העירור מעוצב לגיליון 1,2, כולל מיקרוסקופ הארה מישורית סלקטיבית (SPIM), עירור מישורי קונפוקלי (SCAPE) ומיקרוסקופ מישורי אלכסוני (OPM)3,4,5,6,7. שלא כמו שיטות מיקרוסקופיה אחרות כגון epi-fluorescence, total internal reflection fluorescence microscopy (TIRFM), או מיקרוסקופ קונפוקלי, phototoxicity הוא מינימלי ב- LSFM וניתן לצלם דגימות על פני טווחי זמן ארוכים יותר מכיוון שרק מישור הדגימה המצולמת באופן פעיל מואר 8,9,10. לכן, טכניקות LSFM שימושיות ביותר להדמיית דגימות תלת-ממדיות על פני תקופות זמן ממושכות, במיוחד אלה עבות מדי עבור טכניקות מיקרוסקופיה קונפוקלית. מסיבות אלה, מאז פיתוחה המקורי בשנת 2004, LSFM הפכה לטכניקת הדמיה המועדפת על פיזיולוגים רבים, ביולוגים התפתחותיים ומדעני מוח להדמיה של אורגניזמים שלמים כגון דגי זברה חיים ועוברי דרוזופילה 3,4,6,11 . בשני העשורים האחרונים, היתרונות של LSFM מונפו כדי לדמיין מבנה ודינמיקה בסקאלות קטנות יותר ויותר, כולל קשקשים רקמתיים 11,12, תאיים ותת-תאיים, הן in vivo והן in vitro 13,14,15,17.
למרות הדיווחים על מקרי שימוש מוצלחים בספרות, העלות הגבוהה של מערכות LSFM מסחריות (~ 0.25 מיליון דולר נכון לזמן כתיבת שורות אלה)18,19 מונעת שימוש נרחב בטכניקה. כדי להפוך את בניית DIY לחלופה ישימה לחוקרים, פורסמו מספר מדריכי בנייה 8,13,20,21, כולל מאמץ הגישה הפתוחה OpenSPIM 22. אולם נכון להיום, חוקרים עם ניסיון מינימלי באופטיקה יכולים להשתמש רק בתכנוני LSFM מוקדמים יותר, שאינם תואמים לדגימות מסורתיות המותקנות על שקופיות (איור 1A). יישום גיליון אור (SOLS) שבוצע לאחרונה משתמש במטרה אחת הן לעירור והן לזיהוי (איור 1C), ובכך מתגבר על המגבלה הקשורה לתאימות 5,6,8,13,20. עם זאת, העלות עבור הרבגוניות של תכנון SOLS היא עלייה משמעותית במורכבות הבנייה עקב הדרישה של שתי מטרות נוספות להעביר, לבטל הטיה ותמונה מחדש של מישור האובייקט על המצלמה לצורך הדמיה (איור 1D). כדי להקל על הגישה להגדרות מורכבות בסגנון SOLS, מאמר זה מציג מדריך שלב אחר שלב על התכנון, הבנייה, תהליך היישור והשימוש במערכת SOLS תואמת שקופיות, אשר יהיה שימושי לחוקרים עם ידע של קורס אופטיקה ברמת הכניסה בלבד.
למרות שהפרוטוקול עצמו הוא תמציתי, על הקוראים להפנות למשאבים אחרים במהלך שלבי ההכנה כדי ללמוד עוד על חלקים מסוימים של שיקולי התכנון או החומרה. עם זאת, אם הקורא מתכוון לעקוב אחר המפרט של עיצוב זה, ייתכן שלא יהיה צורך להבין כיצד לבחור רכיבים אופטיים מסוימים.
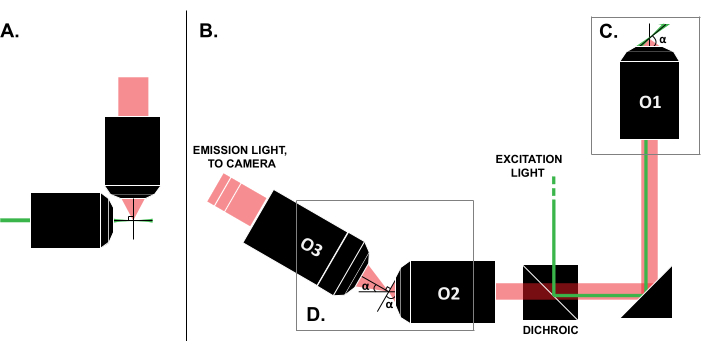
איור 1: מאפיינים של תצורות LSFM שונות. (A) התקנה עם שתי מטרות אורתוגונליות שהיו נפוצות בתכנוני LSFM מוקדמים. בתצורה זו, צינור נימי או גליל ג’ל משמש להכיל את המדגם, אשר אינו תואם טכניקות מסורתיות הרכבה שקופיות. (B) סכמה של עיצוב גיליון אור SOLS המראה את הדברים הבאים: (ג) המטרה היחידה המשמשת הן לעירור והן לאיסוף הפליטה במישור הדגימה (O1); הדבר מאפשר להרכיב שקופית מסורתית על גביו, ו-(D) את מערכת יעדי הממסר בנתיב הפליטה של SOLS. O2 אוסף את אור הפליטה ומקטין את התמונה. O3 מצלם את המישור בזווית ההטיה הנכונה אל חיישן המצלמה. קיצורים: LSFM = מיקרוסקופ פלואורסצנטי של גיליון אור; SOLS = יריעת אור חד-אובייקטיבית; O1-O3 = מטרות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
Representative Results
Discussion
שני פרטים חשובים לגבי פרוטוקול זה הם העלות הכוללת של המערכת וזמן הבנייה והיישור הצפוי. למרות שהעלות המדויקת משתנה, אנו יכולים להעריך בנוחות כי עלות הטוטו של SOLS זה או מערכת DIY דומה תיפול בטווח של 85,000 דולר. נציין כי אומדן זה לוקח בחשבון את המחיר הקמעונאי של כל הרכיבים, ולכן מחיר כולל זה עשוי להיות מופחת מאוד על ידי מיקור רכיבים משומשים. מבחינת זמן הבנייה, יהיה זה הגיוני לצפות ממשתמש עם ניסיון מועט באופטיקה לבנות וליישר את כל מערכת ה-SOLS הזו תוך 1-2 חודשים, בתנאי שכל הרכיבים זמינים ומוכנים. למרות אורכו ומורכבותו של הפרוטוקול, אנו מאמינים כי כמות הפרטים בכתב היד הכתוב, יחד עם פרוטוקול הווידאו, צריכה להפוך פרוטוקול זה לפשוט ומהיר לביצוע.
ישנם שני שלבים קריטיים בפרוטוקול זה. ראשית, מיקום הגלבו קובע את מיקומן של עדשות רבות מכיוון שהוא חלק משלושה זוגות נפרדים של עדשות 4f. חיוני שהגלבו יהיה מצומד עם מישורי המוקד האחוריים של O1 ו-O2 וממורכז כראוי כדי להבטיח סריקה אינווריאנטית נטויה. שנית, איכות התמונה רגישה ביותר ליישור של O2 ו-O3 זה ביחס לזה. כאן, יש להקפיד לוודא שראשית, זווית היישור של O3 ל-O2 תואמת את ההטיה של יריעת אור העירור, ובכך מספקת תאורה שטוחה מקסימלית על פני ה-FoV המוטה באופן דומה. שנית, O3 חייב להיות ממוקם במרחק הציר הנכון כדי לשמור על FoV שטוח עם שטח גדול ככל האפשר. שלישית, O3 חייב להיות ממוקם במרחק הרוחבי הנכון מ- O2 כדי למקסם את האות שעובר דרך ממשק O2-O3.
במונחים של FoV שמיש, מערכת זו השיגה שדה שטוח ואמין עם תאורה עקבית על פני שטח 80 מיקרומטר x 80 מיקרומטר. שטח זה קטן יותר מה-FoV המרבי שמספקת המצלמה, כך שה-FoV השמיש מצוין על-ידי הקופסה הצהובה באיור 13. במונחים של כוח הפתרון, מערכת זו השיגה מרחק מינימלי ניתן לפתרון של 432 ננומטר לאורך ציר x ו 421 ננומטר לאורך ציר y, אשר נמדד על ידי מציאת הממוצע סיגמא x ו- y של התאמות גאוס לפונקציות התפשטות נקודתית (PSFs) ב- FoV הטוב והכפלה בשניים. נציין כי מערכת זו לא עברה אופטימיזציה במונחים של ה-NA הכולל שלה, כלומר יש מקום לשיפור משמעותי אם המשתמשים רוצים כוח פתרון גבוה יותר ממה שמערכת זו השיגה. ישנן מספר רב של אפשרויות אובייקטיביות תואמות עבור סוג זה של בניית SOLS, שרבות מהן יתרמו לרזולוציית מערכת גבוהה יותר אך עם חסרונות של עלות גבוהה יותר, FoV קטן יותר, או טכניקות יישור מסובכות יותר בממשק הממסר 8,11,13,20. בנפרד, אם המשתמשים ירצו ב-FoV גדול יותר, שילוב גלבו שני שיאפשר סריקה דו-ממדית ישיג מטרה זו, אך ידרוש אופטיקה נוספת ומכניקת בקרה כדי להשתלב בעיצוב32. סיפקנו פרטים נוספים לגבי שינויים במערכת בדף האתר שלנו, לצד קישורים למשאבים מועילים אחרים הנוגעים לתהליך העיצוב23.
מעבר לשיפור הרכיבים הספציפיים עבור עיצוב ספציפי זה, יהיה זה ריאלי מאוד להוסיף טכניקות מיקרוסקופיה אחרות ברזולוציה גבוהה או שיטות לבנות זו. שיפור אחד כזה יהיה לשלב תאורה רב-אורכית, שתכלול יישור לייזרים עירור נוספים לנתיב העירור המקורי8. יתר על כן, מכיוון שסוג זה של תכנון SOLS משאיר את הדגימה נגישה, הוספת פונקציות נוספות למיקרוסקופ, כולל אך מוגבל לציוצים אופטיים, מיקרופלואידיקה וריומטריה, היא פשוטה יחסית 2,33.
בהשוואה לאינספור מדריכי גיליון האור שפורסמו, פרוטוקול זה מספק הוראות ברמת הבנה שמשתמש ללא ניסיון אופטי משמעותי עשוי להועיל. על ידי הנגשת בניית SOLS ידידותית למשתמש עם יכולות מסורתיות של הרכבה על שקופיות לדוגמה לקהל גדול יותר, אנו מקווים לאפשר הרחבה נוספת של היישומים של מחקר מבוסס SOLS בכל התחומים שבהם המכשיר שימש או יכול להיות בשימוש. למרות שהיישומים של מכשירי SOLS גדלים במהירות במספר 2,34,35, אנו מאמינים כי יתרונות ושימושים רבים של מכשירים מסוג SOLS עדיין לא נחקרו ומביעים התרגשות מהאפשרויות לסוג זה של מכשירים להתקדם.
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי פרס RUI של הקרן הלאומית למדע (NSF) (DMR-2203791) ל- J.S. אנו אסירי תודה על ההדרכה שניתנה על ידי ד”ר בין יאנג וד”ר מאניש קומאר במהלך תהליך היישור. אנו מודים לד”ר ג’ני רוס ולק. אליס לינדזי על הוראות ההכנה למנועי קינזין.
Materials
| 1" Plano-Concave Lens f = -50 mm | Thorlabs | LC1715-A-ML | For alignment laser Estimated Cost: $49.5 |
| 1" Achromatic Doublet f = 100 mm (x3) | Thorlabs | AC254-100-A-ML | L2, L4 and alignment laser Estimated Cost: $342.42 |
| 1" Achromatic Doublet f = 125 mm | Thorlabs | AC254-125-A-ML | SL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | L3 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | TL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 45 mm | Thorlabs | AC254-045-A-ML | L1 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 75 mm | Thorlabs | AC254-075-A-ML | SL1 Estimated Cost: $114.14 |
| 1" Cylindrical Lens f = 100 mm | Thorlabs | LJ1567RM | CL3 Estimated Cost: $117.62 |
| 1" Cylindrical Lens f = 200 mm | Thorlabs | LJ1653RM | CL2 Estimated Cost: $111.22 |
| 1" Cylindrical Lens f = 50 mm | Thorlabs | LJ1695RM | CL1 Estimated Cost: $117.62 |
| 1" Mounted Pinhole, 30 µm Pinhole Diameter | Thorlabs | P30K | Estimated Cost: $77.08 |
| 1" Silver Mirror (x3) | Thorlabs | PF10-03-P01 | M1, M2, one for alignment Estimated Cost: $168.78 |
| 2" Elliptical Mirror | Thorlabs | PFE20-P01 | M3 Estimated Cost: $179.98 |
| 2" Post Holder (x11) | Thorlabs | PH2 | For custom laser mount, ND wheel, safety screens Estimated Cost: $98.45 |
| 2" Posts (x47) | Thorlabs | TR2 | For custom laser mount and optical components Estimated Cost: $277.3 |
| 3" Posts (x4) | Thorlabs | TR3 | For M3 supports and other mounts Estimated Cost: $24.6 |
| 3" Post Holder (x4) | Thorlabs | PH3 | Estimated Cost: $38.48 |
| 30 to 60 mm Cage Adapter | Thorlabs | LCP33 | To mount O1 Estimated Cost: $45.42 |
| 30mm Cage Filter Wheel | Thorlabs | CFW6 | To mount ND filters Estimated Cost: $172.36 |
| 30mm Cage Plate (x6) | Thorlabs | CP33 | To build alignment cage and alignment laser Estimated Cost: $114.54 |
| 30mm Right-Angle Kinematic Mirror Mount (x3) | Thorlabs | KCB1 | To mount M1 and M2 and for alignment laser Estimated Cost: $463.95 |
| 4" Post Holder (x30) | Thorlabs | PH4 | Estimated Cost: $320.1 |
| 561 nm Laser and Power Supply | Opto Engine LLC | MGL-FN-561-100mW | Excitation laser Estimated Cost: $6000 |
| 60mm Cage Plate (x2) | Thorlabs | LCP01 | To mount TL1 and M3 mount Estimated Cost: $88.52 |
| 60mm Right-Angle Kinematic Mirror Mount | Thorlabs | KCB2 | To mount M3 Estimated Cost: $187.26 |
| 90° Flip Mount | Thorlabs | TRF90 | For alignment laser Estimated Cost: $95.5 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | Thorlabs | SM1A9 | To connect lens tube to camera Estimated Cost: $20.96 |
| Adapter with External SM1 Threads and Internal C-Mount Threads | Thorlabs | SM1A10 | To connect tube lens to lens mount Estimated Cost: $21.82 |
| Adapter with External SM1 Threads and Internal M25 Threads (x2) | Thorlabs | SM1A12 | To mount O1 and O2 Estimated Cost: $47.06 |
| Adapter with External SM1 Threads and Internal M26 Threads | Thorlabs | SM1A27 | To mount O3 Estimated Cost: $22.38 |
| Alignment Disk | Thorlabs | SM1A7 | Estimated Cost: $20.45 |
| Alignment Laser | BISKEE | https://www.amazon.com/Tactical-Presentation-Teaching-Interactive-Adjustable/dp/B09B1VXPNM Estimated Cost: $16.98 |
|
| Autoluorescent Plastic Slide, Red | Chroma | 92001 | Estimated Cost: $20 |
| Beam Shutter | Thorlabs | SM1SH1 | To block laser light Estimated Cost: $65.8 |
| Cage Rotation Mount (x3) | Thorlabs | CRM1T | To mount CL1-3 Estimated Cost: $282.15 |
| Cage System Rods 1" (x8) | Thorlabs | ER1 | To mount M3 and O1 Estimated Cost: $44.8 |
| Cage System Rods 3" (x2) | Thorlabs | ER3 | To mount O3 Estimated Cost: $14.28 |
| Cage System Rods 4" (x4) | Thorlabs | ER4 | To mount slit Estimated Cost: $30.76 |
| Cage System Rods 8" (x2) | Thorlabs | ER8 | For tube lens alignment Estimated Cost: $25.3 |
| Cage System Rods 12" (x8) | Thorlabs | ER12 | For alignment cage Estimated Cost: $145.36 |
| Camera | Andor | Zyla 4.2 sCMOS | Estimated Cost: ~$14,000 |
| Clamping Fork (x35) | Thorlabs | CF125 | To clamp down post mounts Estimated Cost: $338.8 |
| Cover Glass, 22 x 22 mm | Corning | 2850-22 | For slide samples Estimated Cost: $265 |
| Dichroic | AVR | DI01-R405/488/561/635-25×36 | To split exciation/emission paths Estimated Cost: $965 |
| Dovetail Translation Stage | Thorlabs | DT12 | To translate pinhole Estimated Cost: $90.55 |
| Emission Filter | Thorlabs | FELHO600 | Estimated Cost: $140.99 |
| Frosted Glass Alignment Disk (x2) | Thorlabs | DG10-1500-H1 | For alignment cage and intermediate plane Estimated Cost: $75.14 |
| Function Generator | Hewlett-Packard | HP 33120A 15 MHz | To control galvo Estimated Cost: $900 |
| Galvanometer – 1D Large Beam Diameter System | Thorlabs | GVS011 | Estimated Cost: $1715.78 |
| Galvanometer Power Supply | Siglent | SPD3303C | Estimated Cost: $300 |
| Gelrite | Research Products International | G35020-100.0 | Gellan gum for 3D bead sample Estimated Cost: $68.25 |
| FIJI Software | Open-source | Download from https://imagej.net/software/fiji/downloads Estimated Cost: Free |
|
| Hot Plate/ Stirrer | Corning | 6795-220 | For preparing sample solutions Estimated Cost: $550 |
| K-Cube Brushed Motor Controller | Thorlabs | KDC101 | Drives Z825B Estimated Cost: $757.51 |
| Kinematic Mount | Thorlabs | KM100S | To mount dichroic Estimated Cost: $92.01 |
| Kinesis Software | Thorlabs | Download from https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=10285 Estimated Cost: Free |
|
| Laser Light Blocker | Thorlabs | LB1 | For ND filter reflections Estimated Cost: $57.65 |
| Laser Mount | custom made | 3D printed Estimated Cost: N/A |
|
| Laser Safety Screen (x2) | Thorlabs | TPS4 | For blocking stray laser light Estimated Cost: $92.02 |
| Laser Scanning Tube Lens | Thorlabs | TTL200MP | TL1 Estimated Cost: $1491 |
| Lens Mount (x10) | Thorlabs | LMR1 | To mount all lens and extra alignment mirror. Estimated Cost: $164.7 |
| Magnetic Ruler | Thorlabs | BHM4 | To check alignment Estimated Cost: $52.74 |
| Micro-Manager Software | Open-source | Download from https://micro-manager.org/Download_Micro-Manager_Latest_Release Estimated Cost: Free |
|
| Microscope Slides | Thermo Fisher Scientific | 12550400 | For slide samples Estimated Cost: $123.9 |
| Microscope Stage | ASI | FTP-2000 with custom parts | To fine-translate samples Estimated Cost: ~$16,000 |
| Mini Vortex Mixer | VWR | 10153-688 | For sample preparation Estimated Cost: $152.64 |
| Motorized Actuator | Thorlabs | Z825B | To fine-translate M1 Estimated Cost: $729.07 |
| Mounted Standard Iris (x2) | Thorlabs | ID20 | At least 2 for alignment Estimated Cost: $118.02 |
| ND Filter Set | Thorlabs | NDK01 | To reduce excitation intensity Estimated Cost: $726.73 |
| Objective Lens 1 | Nikon | Plan Apo 60X/ 1.20 WI | O1 Estimated Cost: ~$15,000 |
| Objective Lens 2 | Nikon | TU Plan Fluor 100X/0.90 | O2 Estimated Cost: ~$6,000 |
| Objective Lens 3 | Mitutoyo | Plan Apo HR 50X/0.75 | O3 Estimated Cost: ~$6,800 |
| OPM Deskewing Software | Open-source | For image processing. Download from https://github.com/QI2lab/OPM Estimated Cost: Free |
|
| Photodiode Power Sensor | Thorlabs | S121C | For measuring laser intensity Estimated Cost: $379.68 |
| Positive Grid Distortion Target | Thorlabs | R1L3S3P | Brightfield alignment Estimated Cost: $267.87 |
| Power Meter Digital Console | Thorlabs | PM100D | For measuring laser intensity Estimated Cost: $1245.48 |
| Rhodamine 6G | Thermo Scientific | J62315.14 | For fluorescent coated slide sample Estimated Cost: $27.7 |
| Right-Angle Clamp for Posts | Thorlabs | RA90 | For M3 support and flip down mirror Estimated Cost: $32.46 |
| RMS-Threaded Cage Plate (x2) | Thorlabs | CP42 | For alignment laser Estimated Cost: $70.56 |
| Shear Plate 2.5-5.0 mm | Thorlabs | SI050P | Estimated Cost: $182.85 |
| Shear Plate 5.0-10.0 mm | Thorlabs | SI100P | Estimated Cost: $201.47 |
| Shear Plate 10.0-25.4 mm | Thorlabs | SI254P | Estimated Cost: $236.42 |
| Shear Plate Viewing Screen | Thorlabs | SIVS | Estimated Cost: $337.74 |
| Shearing Interferometer with 1-3 mm Plate | Thorlabs | SI035 | For checking collimation Estimated Cost: $465.85 |
| Slip-On Post Collar (x35) | Thorlabs | R2 | To maintain post height Estimated Cost: $208.25 |
| Slit | Thorlabs | VA100 | Estimated Cost: $294.64 |
| Slotted Lens Tube, 3" | Thorlabs | SM1L30C | For alignment laser Estimated Cost: $77.45 |
| Square Mirror, 1 x 1" | https://www.amazon.com/Small-Square-Mirror-Pieces-Mosaic/dp/B07FBNMDC1/ref=asc_df_B07FBNMDC1/?tag=hyprod-20&linkCode=df0&hva did=642191768069&hvpos=&hvne tw=g&hvrand=1336734911900437 4691&hvpone=&hvptwo=&hvqmt= &hvdev=c&hvdvcmdl=&hvlocint=& hvlocphy=9031212&hvtargid=pla-1 943952718742&gclid=Cj0KCQiA6L yfBhC3ARIsAG4gkF_AYBpn5EdGL q3mc-RU-nanT5vM4ac9r3-obbzqJoWKPkIPIJU6e1caAjWmEA Lw_wcB&th=1 Estimated Cost: $14.76 |
||
| Stackable Lens Tube 1/2" (x3) | Thorlabs | SM1L05 | To mount CL1-3 Estimated Cost: $40.86 |
| Stackable Lens Tube 1" | Thorlabs | SM1L10 | To mount O3 Estimated Cost: $15.41 |
| Stackable Lens Tube 2" (x2) | Thorlabs | SM1L20 | For camera path Estimated Cost: $35.7 |
| Studded Pedestal Base Adapter (x37) | Thorlabs | BE1 | To attach post mounts to table Estimated Cost: $400.71 |
| Translating Lens Mount (x3) | Thorlabs | LM1XY | To fine-translate pinhole, O2 and O3 Estimated Cost: $441 |
| Translation Stage with Standard Micrometer (x2) | Thorlabs | PT1/M | TS1-2 Estimated Cost: $647.54 |
| Travel Manual Translation Stage | Thorlabs | CT1A | O3 cage translation mount Estimated Cost: $497.3 |
| Tube Lens | Nikon | MXA20696 | TL3 Estimated Cost: $359 |
| White Mounted LED | Thorlabs | MNWHL4 | Brightfield light source Estimated Cost: $171.28 |
| TOTAL ESTIMATED COST: $84,858.98 | |||
| The authors note that many parts were bought used. Here, we have attempted to reflect the retail price of all items, so the total cost can be greatly reduced by buying particular items used, especially the more expensive ones. | |||
| OPTIONAL COMPONENTS | |||
| Grasshopper3 USB3 | FLIR | GS3-U3-23S6C-C | For diagnostic checks during alignment. Acquisiton camera can be used instead, but requires realignment afterwards. Estimated Cost: $1089 |
References
- Girkin, J. M., Carvalho, M. T. The light-sheet microscopy revolution. Journal Optics. 20 (5), 053002 (2018).
- You, R., McGorty, R. Light sheet fluorescence microscopy illuminating soft matter. Frontiers in Physics. 9, 760834 (2021).
- Fuchs, E., Jaffe, J. S., Long, R. A., Azam, F. Thin laser light sheet microscope for microbial oceanography. Optics Express. 10 (2), 145-154 (2002).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Dunsby, C. Optically sectioned imaging by oblique plane microscopy. Optics Express. 16 (25), 20306-20316 (2008).
- Bouchard, M. B., et al. Swept confocally-aligned planar excitation (SCAPE) microscopy for high-speed volumetric imaging of behaving organisms. Nature Photonics. 9 (2), 113-119 (2015).
- Smith, C. W., Botcherby, E. J., Wilson, T. Resolution of oblique-plane images in sectioning microscopy. Optics Express. 19 (3), 2662-2669 (2011).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Wu, Y., et al. Simultaneous multiview capture and fusion improves spatial resolution in wide-field and light-sheet microscopy. Optica. 3 (8), 897-910 (2016).
- Sahasrabudhe, A., Vittal, V., Ghose, A. Peeping in on the cytoskeleton: Light microscopy approaches to actin and microtubule organization. Current Science. 105 (11), 1562-1570 (2013).
- Kumar, M., Kishore, S., Nasenbeny, J., McLean, D. L., Kozorovitskiy, Y. Integrated one- and two-photon scanned oblique plane illumination (SOPi) microscopy for rapid volumetric imaging. Optics Express. 26 (10), 13027-13041 (2018).
- Kim, J., et al. Oblique-plane single-molecule localization microscopy for tissues and small intact animals. Nature Methods. 16 (9), 853-857 (2019).
- Sapoznik, E., et al. A versatile oblique plane microscope for large-scale and high-resolution imaging of subcellular dynamics. eLife. 9, e57681 (2020).
- Bernardello, M., Marsal, M., Gualda, E. J., Loza-Alvarez, P. Light-sheet fluorescence microscopy for the in vivo study of microtubule dynamics in the zebrafish embryo. Biomedical Optics Express. 12 (10), 6237-6254 (2021).
- Shelden, E. A., Colburn, Z. T., Jones, J. C. R. Focusing super resolution on the cytoskeleton. F1000Res. 5, (2016).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), (2019).
- Sheung, J. Y., Garamella, J., Kahl, S. K., Lee, B. Y., McGorty, R. J., Robertson-Anderson, R. M. Motor-driven advection competes with crowding to drive spatiotemporally heterogeneous transport in cytoskeleton composites. Frontiers in Physics. 10, 1055441 (2022).
- Zeiss Lightsheet 7. Light-Sheet Multiview Imaging of Living and Cleared Specimens. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lightsheet-7.html (2023)
- Zeiss Lattice Lightsheet 7. Long-Term Volumetric Imaging of Living Cells. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lattice-lightsheet-7.html (2023)
- Kumar, M., Kishore, S., McLean, D. L., Kozorovitskiy, Y. Crossbill: An open access single objective light-sheet microscopy platform. bioRxiv. , (2021).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: A tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Pitrone, P. G., et al. OpenSPIM: An open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Single Objective Light Sheet Microscope (SOLS) Guide. Sheung Lab Available from: https://sites.google.com/view/sheunglab/microscopy/single-objective-light-microscope-sols (2023)
- Lamb, J. R., Ward, E. N., Kaminski, C. F. Open-source software package for on-the-fly deskewing and live viewing of volumetric lightsheet microscopy data. Biomedical Optics Express. 14 (2), 834-845 (2023).
- . Harvard University. Mitchison Lab Available from: https://mitchison.hms.harvard.edu/home (2023)
- Watkins, S. C., St. Croix, C. M. Light sheet imaging comes of age. Journal of Cell Biology. 217 (5), 1567-1569 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Berezney, J., Goode, B. L., Fraden, S., Dogic, Z. Extensile to contractile transition in active microtubule-actin composites generates layered asters with programmable lifetimes. Proceedings of the National Academy of Sciences of the United States of America. 119 (5), e2115895119 (2022).
- Kim, K., et al. Isomorphic coalescence of aster cores formed in vitro from microtubules and kinesin motors. Physical Biology. 13 (5), 056002 (2016).
- Millett-Sikking, A., et al. . High NA single-objective lightsheet. , (2019).
- Bourgenot, C., Saunter, C. D., Taylor, J. M., Girkin, J. M., Love, G. D. 3D adaptive optics in a light sheet microscope. Optics Express. 20 (12), 13252-13261 (2012).
- Bernardello, M., Gualda, E. J., Loza-Alvarez, P. Modular multimodal platform for classical and high throughput light sheet microscopy. Scientific Reports. 12 (1), 1969 (2022).
- Crombez, S., Leclerc, P., Ray, C., Ducros, N. Computational hyperspectral light-sheet microscopy. Optics Express. 30 (4), 4856-4866 (2022).

