Design og opbygning af et tilpasseligt, enkeltobjektivt, lysarkfluorescensmikroskop til visualisering af cytoskeletnetværk
Summary
Denne protokol beskriver detaljeret, hvordan man opbygger et enkeltobjektivt, lysarkfluorescensmikroskop og dets anvendelse til visualisering af cytoskeletnetværk.
Abstract
Rekonstituerede cytoskeletkompositter er opstået som et værdifuldt modelsystem til undersøgelse af blødt stof uden ligevægt. Den trofaste indfangning af dynamikken i disse 3D, tætte netværk kræver optisk sektionering, som ofte er forbundet med fluorescenskonfokale mikroskoper. Den seneste udvikling inden for lysarkfluorescensmikroskopi (LSFM) har imidlertid etableret det som et omkostningseffektivt og til tider overlegent alternativ. For at gøre LSFM tilgængelig for cytoskeletforskere, der er mindre fortrolige med optik, præsenterer vi en trinvis begyndervejledning til opbygning af et alsidigt lysarkfluorescensmikroskop fra hyldekomponenter. For at muliggøre prøvemontering med traditionelle diasprøver følger denne LSFM SOLS-designet (single-objective light-sheet), som bruger et enkelt mål til både excitations- og emissionsindsamling. Vi beskriver funktionen af hver komponent i SOLS tilstrækkeligt detaljeret til, at læserne kan ændre instrumenteringen og designe den, så den passer til deres specifikke behov. Endelig demonstrerer vi brugen af dette brugerdefinerede SOLS-instrument ved at visualisere asters i kinesindrevne mikrotubulusnetværk.
Introduction
Light-sheet fluorescens mikroskopi (LSFM) repræsenterer en familie af højopløselige fluorescensbilleddannelsesteknikker, hvor excitationslyset formes til et ark 1,2, herunder selektiv planbelysningsmikroskopi (SPIM), fejet konfokalt justeret plan excitation (SCAPE) og skråplanmikroskopi (OPM) 3,4,5,6,7. I modsætning til andre mikroskopimetoder såsom epifluorescens, total intern refleksionsfluorescensmikroskopi (TIRFM) eller konfokal mikroskopi er fototoksicitet minimal i LSFM, og prøver kan afbildes over længere tidsskalaer, fordi kun prøveplanet, der aktivt afbildes, belyses 8,9,10. Derfor er LSFM-teknikker yderst nyttige til billeddannelse af 3D-prøver over længere tidsperioder, især selv dem, der er for tykke til konfokale mikroskopiteknikker. På grund af disse grunde er LSFM siden sin oprindelige udvikling i 2004 blevet den foretrukne billeddannelsesteknik for mange fysiologer, udviklingsbiologer og neurovidenskabsmænd til visualisering af hele organismer som levende zebrafisk og Drosophila-embryoner 3,4,6,11 . I de sidste to årtier er fordelene ved LSFM blevet udnyttet til at visualisere struktur og dynamik i gradvist mindre skalaer, herunder væv11,12, cellulære og subcellulære skalaer, både in vivo og in vitro 13,14,15,17.
På trods af rapporterne om vellykkede brugssager i litteraturen forhindrer de høje omkostninger ved kommercielle LSFM-systemer (~ 0.25 millioner USD i skrivende stund)18,19 den udbredte anvendelse af teknikken. For at gøre DIY-builds til et gennemførligt alternativ for forskere er der udgivet flere build-vejledninger 8,13,20,21, inklusive open-access-indsatsen OpenSPIM 22. Indtil videre kan forskere med minimal optikerfaring dog kun bruge tidligere LSFM-design, som er uforenelige med traditionelle diasmonterede prøver (figur 1A). Nylig implementering af enkeltobjektiv, lysark (SOLS) bruger et enkelt mål for både excitation og detektion (figur 1C) og overvinder derved begrænsningen relateret til kompatibilitet 5,6,8,13,20. Omkostningerne til alsidigheden af SOLS-designet er imidlertid en betydelig stigning i bygningens kompleksitet på grund af kravet om to yderligere mål om at videresende, de-vippe og genafbilde objektplanet på kameraet til billeddannelse (figur 1D). For at lette adgangen til de komplekse SOLS-stil opsætninger præsenterer dette papir trin-for-trin vejledning om design, opbygning, justeringsproces og brug af et diaskompatibelt SOLS-system, hvilket ville være nyttigt for forskere med viden om kun et entry-level optikkursus.
Selvom selve protokollen er kortfattet, skal læserne henvise til andre ressourcer under forberedelsestrinnene for at lære mere om bestemte dele af design- eller hardwareovervejelserne. Men hvis en læser har til hensigt at følge specifikationerne for dette design, er det muligvis ikke nødvendigt at forstå, hvordan man vælger bestemte optiske komponenter.
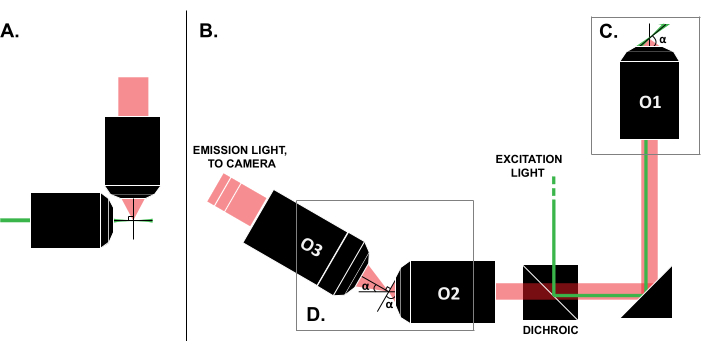
Figur 1: Karakteristika for forskellige LSFM-konfigurationer. (A) Opsætningen med to ortogonale mål, der var almindelige i tidlige LSFM-design. I denne konfiguration anvendes et kapillarrør eller en cylinder gel til at indeholde prøven, som ikke er kompatibel med traditionelle glidemonteringsteknikker. B) Et skema over et Sols-lysarkdesign, der viser følgende: C) det enkelte mål, der er anvendt til både excitations- og emissionsindsamling på prøveplanet (O1) dette gør det muligt at montere et traditionelt dias ovenpå og (D) relæobjektivsystemet i Sols-emissionsvejen. O2 indsamler emissionslyset og forstørrer billedet. O3 afbilder planet i den korrekte hældningsvinkel på kamerasensoren. Forkortelser: LSFM = lysarkfluorescensmikroskopi; SOLS = lysark med et enkelt objektiv O1-O3 = mål. Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
To vigtige detaljer vedrørende denne protokol er de samlede omkostninger ved systemet og den forventede bygge- og justeringstid. Selvom de nøjagtige omkostninger er variable, kan vi komfortabelt estimere, at in toto-omkostningerne ved denne SOLS eller et lignende DIY-system ville falde i intervallet $ 85,000 USD. Vi bemærker, at dette skøn tager højde for detailprisen på alle komponenterne, så denne samlede pris kan reduceres betydeligt ved at købe brugte komponenter. Med hensyn til byggetiden ville det være rimeligt at forvente, at en bruger med ringe optikerfaring bygger og justerer hele dette SOLS-system inden for 1-2 måneder, forudsat at alle komponenterne er tilgængelige og klar. På trods af protokollens længde og kompleksitet mener vi, at mængden af detaljer i det skriftlige manuskript, parret med videoprotokollen, bør gøre denne protokol ligetil og hurtig at følge.
Der er to kritiske trin i denne protokol. For det første bestemmer placeringen af galvo placeringen af mange linser, da den er en del af tre separate 4f-objektivpar. Det er afgørende, at galvoen både er konjugeret med de bagerste brændplaner i O1 og O2 og centreret korrekt for at sikre tilt-invariant scanning. For det andet er billedkvaliteten ekstremt følsom over for justeringen af O2 og O3 i forhold til hinanden. Her skal man sørge for, at justeringsvinklen på O3 til O2 først matcher hældningen på excitationslysarket, hvilket giver maksimal flad belysning over den tilsvarende vippede FoV. For det andet skal O3 placeres i den korrekte aksiale afstand for at opretholde en flad FoV med så stort et areal som muligt. For det tredje skal O3 placeres i den korrekte laterale afstand fra O2 for at maksimere signalet, der passerer gennem O2-O3-grænsefladen.
Med hensyn til den anvendelige FoV opnåede dette system et fladt, pålideligt felt med ensartet belysning over et område på 80 μm x 80 μm. Dette område er mindre end den maksimale FoV, der leveres af kameraet, så den anvendelige FoV er angivet med den gule boks i figur 13. Med hensyn til opløsningskraften opnåede dette system en mindste opløselig afstand på 432 nm langs x-aksen og 421 nm langs y-aksen, som blev målt ved at finde den gennemsnitlige sigma x og y af Gaussiske passer til punktspredningsfunktioner (PSF’er) i den gode FoV og gange med to. Vi bemærker, at dette system ikke blev optimeret med hensyn til dets samlede NA, hvilket betyder, at der er plads til betydelige forbedringer, hvis brugerne ønsker en opløsningskraft, der er højere end hvad dette system opnåede. Der er et væld af kompatible objektive muligheder for denne type SOLS-build, hvoraf mange ville bidrage til en højere systemopløsning, men med ulemperne ved en højere pris, en mindre FoV eller mere komplicerede justeringsteknikker ved relægrænsefladen 8,11,13,20. Separat, hvis brugerne ønsker en større FoV, ville inkorporering af en anden galvo for at muliggøre 2D-scanning nå dette mål, men ville kræve, at yderligere optik og kontrolmekanik integreres i designet32. Vi har givet flere detaljer om ændringer af systemet på vores webside sammen med links til andre nyttige ressourcer vedrørende designprocessen23.
Ud over at forbedre de specifikke komponenter til dette særlige design, ville det være meget muligt at tilføje andre mikroskopiteknikker eller modaliteter med høj opløsning til denne bygning. En sådan forbedring ville være at inkorporere multibølgelængdebelysning, hvilket ville indebære justering af yderligere excitationslasere til den oprindelige excitationsvej8. Desuden, fordi denne type SOLS-design efterlader prøven tilgængelig, er tilføjelse af yderligere funktioner til mikroskopet, herunder men begrænset til optisk pincet, mikrofluidik og reometri, relativt ligetil 2,33.
Sammenlignet med de utallige lysarkguider, der er blevet offentliggjort, giver denne protokol instruktioner på et forståelsesniveau, som en bruger uden væsentlig optikerfaring kan finde nyttige. Ved at lave en brugervenlig SOLS-konstruktion med traditionelle prøvediasmonteringsfunktioner, der er tilgængelige for et større publikum, håber vi at muliggøre en endnu større udvidelse af anvendelserne af SOLS-baseret forskning på alle områder, hvor instrumentet har eller kan bruges. Selv med anvendelserne af SOLS-instrumenter, der hurtigt vokser i antal 2,34,35, mener vi, at mange fordele og anvendelser af SOLS-type instrumenter stadig forbliver uudforskede og udtrykker begejstring over mulighederne for denne type instrument fremadrettet.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af National Science Foundation (NSF) RUI Award (DMR-2203791) til JS. Vi er taknemmelige for vejledningen fra Dr. Bin Yang og Dr. Manish Kumar under tilpasningsprocessen. Vi takker Dr. Jenny Ross og K. Alice Lindsay for forberedelsesinstruktionerne til kinesinmotorerne.
Materials
| 1" Plano-Concave Lens f = -50 mm | Thorlabs | LC1715-A-ML | For alignment laser Estimated Cost: $49.5 |
| 1" Achromatic Doublet f = 100 mm (x3) | Thorlabs | AC254-100-A-ML | L2, L4 and alignment laser Estimated Cost: $342.42 |
| 1" Achromatic Doublet f = 125 mm | Thorlabs | AC254-125-A-ML | SL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | L3 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | TL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 45 mm | Thorlabs | AC254-045-A-ML | L1 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 75 mm | Thorlabs | AC254-075-A-ML | SL1 Estimated Cost: $114.14 |
| 1" Cylindrical Lens f = 100 mm | Thorlabs | LJ1567RM | CL3 Estimated Cost: $117.62 |
| 1" Cylindrical Lens f = 200 mm | Thorlabs | LJ1653RM | CL2 Estimated Cost: $111.22 |
| 1" Cylindrical Lens f = 50 mm | Thorlabs | LJ1695RM | CL1 Estimated Cost: $117.62 |
| 1" Mounted Pinhole, 30 µm Pinhole Diameter | Thorlabs | P30K | Estimated Cost: $77.08 |
| 1" Silver Mirror (x3) | Thorlabs | PF10-03-P01 | M1, M2, one for alignment Estimated Cost: $168.78 |
| 2" Elliptical Mirror | Thorlabs | PFE20-P01 | M3 Estimated Cost: $179.98 |
| 2" Post Holder (x11) | Thorlabs | PH2 | For custom laser mount, ND wheel, safety screens Estimated Cost: $98.45 |
| 2" Posts (x47) | Thorlabs | TR2 | For custom laser mount and optical components Estimated Cost: $277.3 |
| 3" Posts (x4) | Thorlabs | TR3 | For M3 supports and other mounts Estimated Cost: $24.6 |
| 3" Post Holder (x4) | Thorlabs | PH3 | Estimated Cost: $38.48 |
| 30 to 60 mm Cage Adapter | Thorlabs | LCP33 | To mount O1 Estimated Cost: $45.42 |
| 30mm Cage Filter Wheel | Thorlabs | CFW6 | To mount ND filters Estimated Cost: $172.36 |
| 30mm Cage Plate (x6) | Thorlabs | CP33 | To build alignment cage and alignment laser Estimated Cost: $114.54 |
| 30mm Right-Angle Kinematic Mirror Mount (x3) | Thorlabs | KCB1 | To mount M1 and M2 and for alignment laser Estimated Cost: $463.95 |
| 4" Post Holder (x30) | Thorlabs | PH4 | Estimated Cost: $320.1 |
| 561 nm Laser and Power Supply | Opto Engine LLC | MGL-FN-561-100mW | Excitation laser Estimated Cost: $6000 |
| 60mm Cage Plate (x2) | Thorlabs | LCP01 | To mount TL1 and M3 mount Estimated Cost: $88.52 |
| 60mm Right-Angle Kinematic Mirror Mount | Thorlabs | KCB2 | To mount M3 Estimated Cost: $187.26 |
| 90° Flip Mount | Thorlabs | TRF90 | For alignment laser Estimated Cost: $95.5 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | Thorlabs | SM1A9 | To connect lens tube to camera Estimated Cost: $20.96 |
| Adapter with External SM1 Threads and Internal C-Mount Threads | Thorlabs | SM1A10 | To connect tube lens to lens mount Estimated Cost: $21.82 |
| Adapter with External SM1 Threads and Internal M25 Threads (x2) | Thorlabs | SM1A12 | To mount O1 and O2 Estimated Cost: $47.06 |
| Adapter with External SM1 Threads and Internal M26 Threads | Thorlabs | SM1A27 | To mount O3 Estimated Cost: $22.38 |
| Alignment Disk | Thorlabs | SM1A7 | Estimated Cost: $20.45 |
| Alignment Laser | BISKEE | https://www.amazon.com/Tactical-Presentation-Teaching-Interactive-Adjustable/dp/B09B1VXPNM Estimated Cost: $16.98 |
|
| Autoluorescent Plastic Slide, Red | Chroma | 92001 | Estimated Cost: $20 |
| Beam Shutter | Thorlabs | SM1SH1 | To block laser light Estimated Cost: $65.8 |
| Cage Rotation Mount (x3) | Thorlabs | CRM1T | To mount CL1-3 Estimated Cost: $282.15 |
| Cage System Rods 1" (x8) | Thorlabs | ER1 | To mount M3 and O1 Estimated Cost: $44.8 |
| Cage System Rods 3" (x2) | Thorlabs | ER3 | To mount O3 Estimated Cost: $14.28 |
| Cage System Rods 4" (x4) | Thorlabs | ER4 | To mount slit Estimated Cost: $30.76 |
| Cage System Rods 8" (x2) | Thorlabs | ER8 | For tube lens alignment Estimated Cost: $25.3 |
| Cage System Rods 12" (x8) | Thorlabs | ER12 | For alignment cage Estimated Cost: $145.36 |
| Camera | Andor | Zyla 4.2 sCMOS | Estimated Cost: ~$14,000 |
| Clamping Fork (x35) | Thorlabs | CF125 | To clamp down post mounts Estimated Cost: $338.8 |
| Cover Glass, 22 x 22 mm | Corning | 2850-22 | For slide samples Estimated Cost: $265 |
| Dichroic | AVR | DI01-R405/488/561/635-25×36 | To split exciation/emission paths Estimated Cost: $965 |
| Dovetail Translation Stage | Thorlabs | DT12 | To translate pinhole Estimated Cost: $90.55 |
| Emission Filter | Thorlabs | FELHO600 | Estimated Cost: $140.99 |
| Frosted Glass Alignment Disk (x2) | Thorlabs | DG10-1500-H1 | For alignment cage and intermediate plane Estimated Cost: $75.14 |
| Function Generator | Hewlett-Packard | HP 33120A 15 MHz | To control galvo Estimated Cost: $900 |
| Galvanometer – 1D Large Beam Diameter System | Thorlabs | GVS011 | Estimated Cost: $1715.78 |
| Galvanometer Power Supply | Siglent | SPD3303C | Estimated Cost: $300 |
| Gelrite | Research Products International | G35020-100.0 | Gellan gum for 3D bead sample Estimated Cost: $68.25 |
| FIJI Software | Open-source | Download from https://imagej.net/software/fiji/downloads Estimated Cost: Free |
|
| Hot Plate/ Stirrer | Corning | 6795-220 | For preparing sample solutions Estimated Cost: $550 |
| K-Cube Brushed Motor Controller | Thorlabs | KDC101 | Drives Z825B Estimated Cost: $757.51 |
| Kinematic Mount | Thorlabs | KM100S | To mount dichroic Estimated Cost: $92.01 |
| Kinesis Software | Thorlabs | Download from https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=10285 Estimated Cost: Free |
|
| Laser Light Blocker | Thorlabs | LB1 | For ND filter reflections Estimated Cost: $57.65 |
| Laser Mount | custom made | 3D printed Estimated Cost: N/A |
|
| Laser Safety Screen (x2) | Thorlabs | TPS4 | For blocking stray laser light Estimated Cost: $92.02 |
| Laser Scanning Tube Lens | Thorlabs | TTL200MP | TL1 Estimated Cost: $1491 |
| Lens Mount (x10) | Thorlabs | LMR1 | To mount all lens and extra alignment mirror. Estimated Cost: $164.7 |
| Magnetic Ruler | Thorlabs | BHM4 | To check alignment Estimated Cost: $52.74 |
| Micro-Manager Software | Open-source | Download from https://micro-manager.org/Download_Micro-Manager_Latest_Release Estimated Cost: Free |
|
| Microscope Slides | Thermo Fisher Scientific | 12550400 | For slide samples Estimated Cost: $123.9 |
| Microscope Stage | ASI | FTP-2000 with custom parts | To fine-translate samples Estimated Cost: ~$16,000 |
| Mini Vortex Mixer | VWR | 10153-688 | For sample preparation Estimated Cost: $152.64 |
| Motorized Actuator | Thorlabs | Z825B | To fine-translate M1 Estimated Cost: $729.07 |
| Mounted Standard Iris (x2) | Thorlabs | ID20 | At least 2 for alignment Estimated Cost: $118.02 |
| ND Filter Set | Thorlabs | NDK01 | To reduce excitation intensity Estimated Cost: $726.73 |
| Objective Lens 1 | Nikon | Plan Apo 60X/ 1.20 WI | O1 Estimated Cost: ~$15,000 |
| Objective Lens 2 | Nikon | TU Plan Fluor 100X/0.90 | O2 Estimated Cost: ~$6,000 |
| Objective Lens 3 | Mitutoyo | Plan Apo HR 50X/0.75 | O3 Estimated Cost: ~$6,800 |
| OPM Deskewing Software | Open-source | For image processing. Download from https://github.com/QI2lab/OPM Estimated Cost: Free |
|
| Photodiode Power Sensor | Thorlabs | S121C | For measuring laser intensity Estimated Cost: $379.68 |
| Positive Grid Distortion Target | Thorlabs | R1L3S3P | Brightfield alignment Estimated Cost: $267.87 |
| Power Meter Digital Console | Thorlabs | PM100D | For measuring laser intensity Estimated Cost: $1245.48 |
| Rhodamine 6G | Thermo Scientific | J62315.14 | For fluorescent coated slide sample Estimated Cost: $27.7 |
| Right-Angle Clamp for Posts | Thorlabs | RA90 | For M3 support and flip down mirror Estimated Cost: $32.46 |
| RMS-Threaded Cage Plate (x2) | Thorlabs | CP42 | For alignment laser Estimated Cost: $70.56 |
| Shear Plate 2.5-5.0 mm | Thorlabs | SI050P | Estimated Cost: $182.85 |
| Shear Plate 5.0-10.0 mm | Thorlabs | SI100P | Estimated Cost: $201.47 |
| Shear Plate 10.0-25.4 mm | Thorlabs | SI254P | Estimated Cost: $236.42 |
| Shear Plate Viewing Screen | Thorlabs | SIVS | Estimated Cost: $337.74 |
| Shearing Interferometer with 1-3 mm Plate | Thorlabs | SI035 | For checking collimation Estimated Cost: $465.85 |
| Slip-On Post Collar (x35) | Thorlabs | R2 | To maintain post height Estimated Cost: $208.25 |
| Slit | Thorlabs | VA100 | Estimated Cost: $294.64 |
| Slotted Lens Tube, 3" | Thorlabs | SM1L30C | For alignment laser Estimated Cost: $77.45 |
| Square Mirror, 1 x 1" | https://www.amazon.com/Small-Square-Mirror-Pieces-Mosaic/dp/B07FBNMDC1/ref=asc_df_B07FBNMDC1/?tag=hyprod-20&linkCode=df0&hva did=642191768069&hvpos=&hvne tw=g&hvrand=1336734911900437 4691&hvpone=&hvptwo=&hvqmt= &hvdev=c&hvdvcmdl=&hvlocint=& hvlocphy=9031212&hvtargid=pla-1 943952718742&gclid=Cj0KCQiA6L yfBhC3ARIsAG4gkF_AYBpn5EdGL q3mc-RU-nanT5vM4ac9r3-obbzqJoWKPkIPIJU6e1caAjWmEA Lw_wcB&th=1 Estimated Cost: $14.76 |
||
| Stackable Lens Tube 1/2" (x3) | Thorlabs | SM1L05 | To mount CL1-3 Estimated Cost: $40.86 |
| Stackable Lens Tube 1" | Thorlabs | SM1L10 | To mount O3 Estimated Cost: $15.41 |
| Stackable Lens Tube 2" (x2) | Thorlabs | SM1L20 | For camera path Estimated Cost: $35.7 |
| Studded Pedestal Base Adapter (x37) | Thorlabs | BE1 | To attach post mounts to table Estimated Cost: $400.71 |
| Translating Lens Mount (x3) | Thorlabs | LM1XY | To fine-translate pinhole, O2 and O3 Estimated Cost: $441 |
| Translation Stage with Standard Micrometer (x2) | Thorlabs | PT1/M | TS1-2 Estimated Cost: $647.54 |
| Travel Manual Translation Stage | Thorlabs | CT1A | O3 cage translation mount Estimated Cost: $497.3 |
| Tube Lens | Nikon | MXA20696 | TL3 Estimated Cost: $359 |
| White Mounted LED | Thorlabs | MNWHL4 | Brightfield light source Estimated Cost: $171.28 |
| TOTAL ESTIMATED COST: $84,858.98 | |||
| The authors note that many parts were bought used. Here, we have attempted to reflect the retail price of all items, so the total cost can be greatly reduced by buying particular items used, especially the more expensive ones. | |||
| OPTIONAL COMPONENTS | |||
| Grasshopper3 USB3 | FLIR | GS3-U3-23S6C-C | For diagnostic checks during alignment. Acquisiton camera can be used instead, but requires realignment afterwards. Estimated Cost: $1089 |
References
- Girkin, J. M., Carvalho, M. T. The light-sheet microscopy revolution. Journal Optics. 20 (5), 053002 (2018).
- You, R., McGorty, R. Light sheet fluorescence microscopy illuminating soft matter. Frontiers in Physics. 9, 760834 (2021).
- Fuchs, E., Jaffe, J. S., Long, R. A., Azam, F. Thin laser light sheet microscope for microbial oceanography. Optics Express. 10 (2), 145-154 (2002).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Dunsby, C. Optically sectioned imaging by oblique plane microscopy. Optics Express. 16 (25), 20306-20316 (2008).
- Bouchard, M. B., et al. Swept confocally-aligned planar excitation (SCAPE) microscopy for high-speed volumetric imaging of behaving organisms. Nature Photonics. 9 (2), 113-119 (2015).
- Smith, C. W., Botcherby, E. J., Wilson, T. Resolution of oblique-plane images in sectioning microscopy. Optics Express. 19 (3), 2662-2669 (2011).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Wu, Y., et al. Simultaneous multiview capture and fusion improves spatial resolution in wide-field and light-sheet microscopy. Optica. 3 (8), 897-910 (2016).
- Sahasrabudhe, A., Vittal, V., Ghose, A. Peeping in on the cytoskeleton: Light microscopy approaches to actin and microtubule organization. Current Science. 105 (11), 1562-1570 (2013).
- Kumar, M., Kishore, S., Nasenbeny, J., McLean, D. L., Kozorovitskiy, Y. Integrated one- and two-photon scanned oblique plane illumination (SOPi) microscopy for rapid volumetric imaging. Optics Express. 26 (10), 13027-13041 (2018).
- Kim, J., et al. Oblique-plane single-molecule localization microscopy for tissues and small intact animals. Nature Methods. 16 (9), 853-857 (2019).
- Sapoznik, E., et al. A versatile oblique plane microscope for large-scale and high-resolution imaging of subcellular dynamics. eLife. 9, e57681 (2020).
- Bernardello, M., Marsal, M., Gualda, E. J., Loza-Alvarez, P. Light-sheet fluorescence microscopy for the in vivo study of microtubule dynamics in the zebrafish embryo. Biomedical Optics Express. 12 (10), 6237-6254 (2021).
- Shelden, E. A., Colburn, Z. T., Jones, J. C. R. Focusing super resolution on the cytoskeleton. F1000Res. 5, (2016).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), (2019).
- Sheung, J. Y., Garamella, J., Kahl, S. K., Lee, B. Y., McGorty, R. J., Robertson-Anderson, R. M. Motor-driven advection competes with crowding to drive spatiotemporally heterogeneous transport in cytoskeleton composites. Frontiers in Physics. 10, 1055441 (2022).
- Zeiss Lightsheet 7. Light-Sheet Multiview Imaging of Living and Cleared Specimens. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lightsheet-7.html (2023)
- Zeiss Lattice Lightsheet 7. Long-Term Volumetric Imaging of Living Cells. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lattice-lightsheet-7.html (2023)
- Kumar, M., Kishore, S., McLean, D. L., Kozorovitskiy, Y. Crossbill: An open access single objective light-sheet microscopy platform. bioRxiv. , (2021).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: A tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Pitrone, P. G., et al. OpenSPIM: An open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Single Objective Light Sheet Microscope (SOLS) Guide. Sheung Lab Available from: https://sites.google.com/view/sheunglab/microscopy/single-objective-light-microscope-sols (2023)
- Lamb, J. R., Ward, E. N., Kaminski, C. F. Open-source software package for on-the-fly deskewing and live viewing of volumetric lightsheet microscopy data. Biomedical Optics Express. 14 (2), 834-845 (2023).
- . Harvard University. Mitchison Lab Available from: https://mitchison.hms.harvard.edu/home (2023)
- Watkins, S. C., St. Croix, C. M. Light sheet imaging comes of age. Journal of Cell Biology. 217 (5), 1567-1569 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Berezney, J., Goode, B. L., Fraden, S., Dogic, Z. Extensile to contractile transition in active microtubule-actin composites generates layered asters with programmable lifetimes. Proceedings of the National Academy of Sciences of the United States of America. 119 (5), e2115895119 (2022).
- Kim, K., et al. Isomorphic coalescence of aster cores formed in vitro from microtubules and kinesin motors. Physical Biology. 13 (5), 056002 (2016).
- Millett-Sikking, A., et al. . High NA single-objective lightsheet. , (2019).
- Bourgenot, C., Saunter, C. D., Taylor, J. M., Girkin, J. M., Love, G. D. 3D adaptive optics in a light sheet microscope. Optics Express. 20 (12), 13252-13261 (2012).
- Bernardello, M., Gualda, E. J., Loza-Alvarez, P. Modular multimodal platform for classical and high throughput light sheet microscopy. Scientific Reports. 12 (1), 1969 (2022).
- Crombez, S., Leclerc, P., Ray, C., Ducros, N. Computational hyperspectral light-sheet microscopy. Optics Express. 30 (4), 4856-4866 (2022).

