Conception et construction d’un microscope à fluorescence à feuillet de lumière personnalisable à objectif unique pour la visualisation des réseaux de cytosquelettes
Summary
Ce protocole décrit en détail comment construire un microscope à fluorescence à feuillet de lumière à objectif unique et son utilisation pour visualiser les réseaux de cytosquelettes.
Abstract
Les composites de cytosquelettes reconstitués sont apparus comme un système modèle précieux pour l’étude de la matière molle hors équilibre. La capture fidèle de la dynamique de ces réseaux denses en 3D nécessite un sectionnement optique, souvent associé aux microscopes confocaux à fluorescence. Cependant, les développements récents de la microscopie à fluorescence à feuillet de lumière (LSFM) l’ont établie comme une alternative rentable et, parfois, supérieure. Pour rendre le LSFM accessible aux chercheurs en cytosquelette moins familiers avec l’optique, nous présentons un guide du débutant étape par étape pour construire un microscope à fluorescence à feuillet de lumière polyvalent à partir de composants prêts à l’emploi. Pour permettre le montage d’échantillons avec des échantillons de lames traditionnels, ce LSFM suit la conception à feuille de lumière à objectif unique (SOLS), qui utilise un seul objectif pour l’excitation et la collecte d’émission. Nous décrivons la fonction de chaque composant du SOLS avec suffisamment de détails pour permettre aux lecteurs de modifier l’instrumentation et de la concevoir en fonction de leurs besoins spécifiques. Enfin, nous démontrons l’utilisation de cet instrument SOLS personnalisé en visualisant les asters dans des réseaux de microtubules pilotés par la kinésine.
Introduction
La microscopie à fluorescence à feuillet de lumière (LSFM) représente une famille de techniques d’imagerie par fluorescence à haute résolution dans lesquelles la lumière d’excitation est façonnée en une feuille 1,2, y compris la microscopie à éclairage plan sélectif (SPIM), l’excitation planaire alignée confocalement balayée (SCAPE) et la microscopie à plan oblique (OPM)3,4,5,6,7. Contrairement à d’autres modalités de microscopie telles que l’épifluorescence, la microscopie à fluorescence à réflexion interne totale (TIRFM) ou la microscopie confocale, la phototoxicité est minime dans la LSFM et les échantillons peuvent être imagés sur des échelles de temps plus longues car seul le plan de l’échantillon activement imagé est éclairé 8,9,10. Par conséquent, les techniques LSFM sont extrêmement utiles pour l’imagerie d’échantillons 3D sur de longues périodes, notamment celles trop épaisses pour les techniques de microscopie confocale. Pour ces raisons, depuis son développement initial en 2004, le LSFM est devenu la technique d’imagerie de choix pour de nombreux physiologistes, biologistes du développement et neuroscientifiques pour la visualisation d’organismes entiers tels que les embryons vivants de poisson-zèbre et de drosophile 3,4,6,11 . Au cours de ces deux dernières décennies, les avantages de la LSFM ont été exploités pour visualiser la structure et la dynamique à des échelles de plus en plus petites, y compris les tissus11,12, les échelles cellulaires et subcellulaires, à la fois in vivo et in vitro 13,14,15,17.
Malgré les rapports de cas d’utilisation réussis dans la littérature, le coût élevé des systèmes LSFM commerciaux (~0,25 million USD au moment de la rédaction de cet article)18,19 empêche l’utilisation généralisée de la technique. Pour faire des constructions DIY une alternative réalisable pour les chercheurs, plusieurs guides de construction ont été publiés 8,13,20,21, y compris l’effort en libre accès OpenSPIM 22. Cependant, à ce jour, les chercheurs ayant une expérience minimale de l’optique ne peuvent utiliser que des modèles LSFM antérieurs, qui sont incompatibles avec les échantillons traditionnels montés sur lame (Figure 1A). La récente mise en œuvre d’un seul objectif et d’une feuille de lumière (SOLS) utilise un seul objectif pour l’excitation et la détection (Figure 1C), surmontant ainsi la limitation liée à la compatibilité 5,6,8,13,20. Cependant, le coût de la polyvalence de la conception SOLS est une augmentation substantielle de la complexité de la construction en raison de la nécessité de deux objectifs supplémentaires pour relayer, désincliner et réimager le plan de l’objet sur la caméra pour l’imagerie (Figure 1D). Pour faciliter l’accès aux configurations complexes de style SOLS, cet article présente un guide étape par étape sur la conception, la construction, le processus d’alignement et l’utilisation d’un système SOLS compatible avec les diapositives, qui serait utile aux chercheurs ne connaissant qu’un cours d’optique de niveau débutant.
Bien que le protocole lui-même soit succinct, les lecteurs doivent se référer à d’autres ressources pendant les étapes de préparation pour en savoir plus sur des parties particulières de la conception ou des considérations matérielles. Cependant, si un lecteur a l’intention de suivre les spécifications de cette conception, il peut ne pas être nécessaire de comprendre comment sélectionner des composants optiques particuliers.
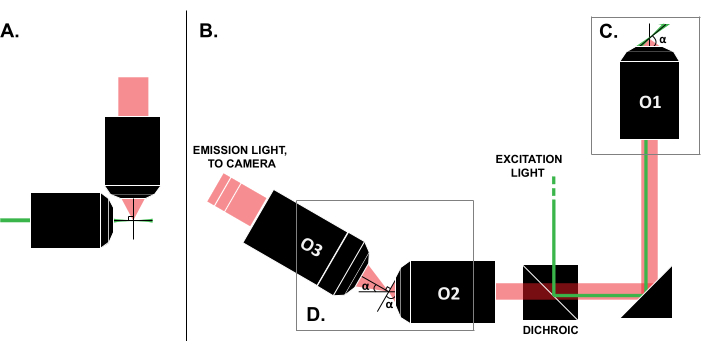
Figure 1 : Caractéristiques des différentes configurations LSFM. (A) La configuration avec deux objectifs orthogonaux communs dans les premières conceptions LSFM. Dans cette configuration, un tube capillaire ou un cylindre de gel est utilisé pour contenir l’échantillon, ce qui n’est pas compatible avec les techniques traditionnelles de montage sur lame. (B) un schéma d’une feuille de lumière SOLS montrant les éléments suivants : (C) l’objectif unique utilisé pour l’excitation et la collecte d’émission au niveau du plan d’échantillonnage (O1) ; cela permet de monter une glissière traditionnelle sur le dessus, et (D) le système d’objectif de relais dans le trajet d’émission SOLS. O2 recueille la lumière d’émission et dégrossit l’image. O3 prend des images de l’avion avec le bon angle d’inclinaison sur le capteur de la caméra. Abréviations : LSFM = microscopie à fluorescence à feuillet de lumière ; SOLS = feuille de lumière à objectif unique ; O1-O3 = objectifs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Deux détails importants concernant ce protocole sont le coût global du système et le temps de construction et d’alignement prévu. Bien que le coût exact soit variable, nous pouvons facilement estimer que le coût total de ce SOLS ou d’un système de bricolage similaire serait de l’ordre de 85 000 USD. Nous notons que cette estimation tient compte du prix de détail de tous les composants, de sorte que ce prix global peut être considérablement réduit en s’approvisionnant en composants usagés. En termes de temps de construction, il serait raisonnable de s’attendre à ce qu’un utilisateur ayant peu d’expérience en optique construise et aligne l’ensemble de ce système SOLS dans un délai de 1 à 2 mois, à condition que tous les composants soient disponibles et prêts. Malgré la longueur et la complexité du protocole, nous pensons que la quantité de détails dans le manuscrit écrit, associée au protocole vidéo, devrait rendre ce protocole simple et rapide à suivre.
Il y a deux étapes critiques dans ce protocole. Tout d’abord, l’emplacement du galvo détermine l’emplacement de nombreuses lentilles car il fait partie de trois paires de lentilles 4f distinctes. Il est crucial que le galvo soit à la fois conjugué avec les plans focaux arrière de O1 et O2 et centré correctement pour assurer un balayage invariant en inclinaison. Deuxièmement, la qualité de l’image est extrêmement sensible à l’alignement de O2 et O3 l’un par rapport à l’autre. Ici, il faut veiller à ce que, d’abord, l’angle d’alignement de O3 à O2 corresponde à l’inclinaison de la feuille de lumière d’excitation, fournissant ainsi un éclairage maximum plat sur le champ de vision incliné de la même manière. Deuxièmement, O3 doit être placé à la bonne distance axiale pour maintenir un champ de vision plat avec une surface aussi grande que possible. Troisièmement, O3 doit être placé à la bonne distance latérale de O2 pour maximiser le signal qui passe par l’interface O2-O3.
En termes de champ de vision utilisable, ce système a permis d’obtenir un champ plat et fiable avec un éclairage constant sur une zone de 80 μm x 80 μm. Cette zone est plus petite que le champ de vision maximal fourni par la caméra, de sorte que le champ de vision utilisable est indiqué par la case jaune de la figure 13. En termes de pouvoir de résolution, ce système a atteint une distance minimale résolvable de 432 nm le long de l’axe des x et de 421 nm le long de l’axe des y, qui a été mesurée en trouvant les sigma x et y moyens des ajustements gaussiens aux fonctions d’étalement ponctuel (PSF) dans le bon FoV et en multipliant par deux. Nous notons que ce système n’a pas été optimisé en termes de NA total, ce qui signifie qu’il y a place à une amélioration significative si les utilisateurs souhaitent un pouvoir de résolution supérieur à ce que ce système a atteint. Il existe une multitude d’options d’objectifs compatibles pour ce type de construction SOLS, dont beaucoup contribueraient à une résolution système plus élevée, mais avec les inconvénients d’un coût plus élevé, d’un champ de vision plus petit ou de techniques d’alignement plus compliquées à l’interface de relais 8,11,13,20. Par ailleurs, si les utilisateurs souhaitent un champ de vision plus grand, l’incorporation d’un deuxième galvo pour permettre la numérisation 2D permettrait d’atteindre cet objectif, mais nécessiterait l’intégration d’optiques et de mécanismes de contrôle supplémentaires dans la conception32. Nous avons fourni plus de détails concernant les modifications apportées au système sur la page de notre site Web, ainsi que des liens vers d’autres ressources utiles concernant le processus de conception23.
Au-delà de l’amélioration des composants spécifiques pour cette conception particulière, il serait tout à fait possible d’ajouter d’autres techniques ou modalités de microscopie à haute résolution à cette construction. L’une de ces améliorations consisterait à incorporer un éclairage multi-longueurs d’onde, ce qui impliquerait d’aligner des lasers d’excitation supplémentaires sur le chemin d’excitation d’origine8. De plus, comme ce type de conception SOLS laisse l’échantillon accessible, l’ajout de fonctions supplémentaires au microscope, y compris, mais sans s’y limiter, la pince optique, la microfluidique et la rhéométrie, est relativement simple 2,33.
Comparé à la myriade de guides de feuilles de lumière qui ont été publiés, ce protocole fournit des instructions à un niveau de compréhension qu’un utilisateur sans expérience significative de l’optique peut trouver utile. En rendant accessible à un public plus large une construction SOLS conviviale avec des capacités traditionnelles de montage de lames d’échantillons, nous espérons permettre une expansion encore plus importante des applications de la recherche basée sur SOLS dans tous les domaines dans lesquels l’instrument a été ou pourrait être utilisé. Même si les applications des instruments SOLS augmentent rapidement dans les numéros2, 34 et 35, nous pensons que de nombreux avantages et utilisations des instruments de type SOL restent encore inexplorés et exprimons notre enthousiasme quant aux possibilités de ce type d’instrument à l’avenir.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ce travail a été soutenu par le prix RUI de la National Science Foundation (NSF) (DMR-2203791) à J.S. Nous sommes reconnaissants des conseils fournis par le Dr Bin Yang et le Dr Manish Kumar pendant le processus d’alignement. Nous remercions le Dr Jenny Ross et K. Alice Lindsay pour les instructions de préparation des moteurs à kinésine.
Materials
| 1" Plano-Concave Lens f = -50 mm | Thorlabs | LC1715-A-ML | For alignment laser Estimated Cost: $49.5 |
| 1" Achromatic Doublet f = 100 mm (x3) | Thorlabs | AC254-100-A-ML | L2, L4 and alignment laser Estimated Cost: $342.42 |
| 1" Achromatic Doublet f = 125 mm | Thorlabs | AC254-125-A-ML | SL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | L3 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | TL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 45 mm | Thorlabs | AC254-045-A-ML | L1 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 75 mm | Thorlabs | AC254-075-A-ML | SL1 Estimated Cost: $114.14 |
| 1" Cylindrical Lens f = 100 mm | Thorlabs | LJ1567RM | CL3 Estimated Cost: $117.62 |
| 1" Cylindrical Lens f = 200 mm | Thorlabs | LJ1653RM | CL2 Estimated Cost: $111.22 |
| 1" Cylindrical Lens f = 50 mm | Thorlabs | LJ1695RM | CL1 Estimated Cost: $117.62 |
| 1" Mounted Pinhole, 30 µm Pinhole Diameter | Thorlabs | P30K | Estimated Cost: $77.08 |
| 1" Silver Mirror (x3) | Thorlabs | PF10-03-P01 | M1, M2, one for alignment Estimated Cost: $168.78 |
| 2" Elliptical Mirror | Thorlabs | PFE20-P01 | M3 Estimated Cost: $179.98 |
| 2" Post Holder (x11) | Thorlabs | PH2 | For custom laser mount, ND wheel, safety screens Estimated Cost: $98.45 |
| 2" Posts (x47) | Thorlabs | TR2 | For custom laser mount and optical components Estimated Cost: $277.3 |
| 3" Posts (x4) | Thorlabs | TR3 | For M3 supports and other mounts Estimated Cost: $24.6 |
| 3" Post Holder (x4) | Thorlabs | PH3 | Estimated Cost: $38.48 |
| 30 to 60 mm Cage Adapter | Thorlabs | LCP33 | To mount O1 Estimated Cost: $45.42 |
| 30mm Cage Filter Wheel | Thorlabs | CFW6 | To mount ND filters Estimated Cost: $172.36 |
| 30mm Cage Plate (x6) | Thorlabs | CP33 | To build alignment cage and alignment laser Estimated Cost: $114.54 |
| 30mm Right-Angle Kinematic Mirror Mount (x3) | Thorlabs | KCB1 | To mount M1 and M2 and for alignment laser Estimated Cost: $463.95 |
| 4" Post Holder (x30) | Thorlabs | PH4 | Estimated Cost: $320.1 |
| 561 nm Laser and Power Supply | Opto Engine LLC | MGL-FN-561-100mW | Excitation laser Estimated Cost: $6000 |
| 60mm Cage Plate (x2) | Thorlabs | LCP01 | To mount TL1 and M3 mount Estimated Cost: $88.52 |
| 60mm Right-Angle Kinematic Mirror Mount | Thorlabs | KCB2 | To mount M3 Estimated Cost: $187.26 |
| 90° Flip Mount | Thorlabs | TRF90 | For alignment laser Estimated Cost: $95.5 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | Thorlabs | SM1A9 | To connect lens tube to camera Estimated Cost: $20.96 |
| Adapter with External SM1 Threads and Internal C-Mount Threads | Thorlabs | SM1A10 | To connect tube lens to lens mount Estimated Cost: $21.82 |
| Adapter with External SM1 Threads and Internal M25 Threads (x2) | Thorlabs | SM1A12 | To mount O1 and O2 Estimated Cost: $47.06 |
| Adapter with External SM1 Threads and Internal M26 Threads | Thorlabs | SM1A27 | To mount O3 Estimated Cost: $22.38 |
| Alignment Disk | Thorlabs | SM1A7 | Estimated Cost: $20.45 |
| Alignment Laser | BISKEE | https://www.amazon.com/Tactical-Presentation-Teaching-Interactive-Adjustable/dp/B09B1VXPNM Estimated Cost: $16.98 |
|
| Autoluorescent Plastic Slide, Red | Chroma | 92001 | Estimated Cost: $20 |
| Beam Shutter | Thorlabs | SM1SH1 | To block laser light Estimated Cost: $65.8 |
| Cage Rotation Mount (x3) | Thorlabs | CRM1T | To mount CL1-3 Estimated Cost: $282.15 |
| Cage System Rods 1" (x8) | Thorlabs | ER1 | To mount M3 and O1 Estimated Cost: $44.8 |
| Cage System Rods 3" (x2) | Thorlabs | ER3 | To mount O3 Estimated Cost: $14.28 |
| Cage System Rods 4" (x4) | Thorlabs | ER4 | To mount slit Estimated Cost: $30.76 |
| Cage System Rods 8" (x2) | Thorlabs | ER8 | For tube lens alignment Estimated Cost: $25.3 |
| Cage System Rods 12" (x8) | Thorlabs | ER12 | For alignment cage Estimated Cost: $145.36 |
| Camera | Andor | Zyla 4.2 sCMOS | Estimated Cost: ~$14,000 |
| Clamping Fork (x35) | Thorlabs | CF125 | To clamp down post mounts Estimated Cost: $338.8 |
| Cover Glass, 22 x 22 mm | Corning | 2850-22 | For slide samples Estimated Cost: $265 |
| Dichroic | AVR | DI01-R405/488/561/635-25×36 | To split exciation/emission paths Estimated Cost: $965 |
| Dovetail Translation Stage | Thorlabs | DT12 | To translate pinhole Estimated Cost: $90.55 |
| Emission Filter | Thorlabs | FELHO600 | Estimated Cost: $140.99 |
| Frosted Glass Alignment Disk (x2) | Thorlabs | DG10-1500-H1 | For alignment cage and intermediate plane Estimated Cost: $75.14 |
| Function Generator | Hewlett-Packard | HP 33120A 15 MHz | To control galvo Estimated Cost: $900 |
| Galvanometer – 1D Large Beam Diameter System | Thorlabs | GVS011 | Estimated Cost: $1715.78 |
| Galvanometer Power Supply | Siglent | SPD3303C | Estimated Cost: $300 |
| Gelrite | Research Products International | G35020-100.0 | Gellan gum for 3D bead sample Estimated Cost: $68.25 |
| FIJI Software | Open-source | Download from https://imagej.net/software/fiji/downloads Estimated Cost: Free |
|
| Hot Plate/ Stirrer | Corning | 6795-220 | For preparing sample solutions Estimated Cost: $550 |
| K-Cube Brushed Motor Controller | Thorlabs | KDC101 | Drives Z825B Estimated Cost: $757.51 |
| Kinematic Mount | Thorlabs | KM100S | To mount dichroic Estimated Cost: $92.01 |
| Kinesis Software | Thorlabs | Download from https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=10285 Estimated Cost: Free |
|
| Laser Light Blocker | Thorlabs | LB1 | For ND filter reflections Estimated Cost: $57.65 |
| Laser Mount | custom made | 3D printed Estimated Cost: N/A |
|
| Laser Safety Screen (x2) | Thorlabs | TPS4 | For blocking stray laser light Estimated Cost: $92.02 |
| Laser Scanning Tube Lens | Thorlabs | TTL200MP | TL1 Estimated Cost: $1491 |
| Lens Mount (x10) | Thorlabs | LMR1 | To mount all lens and extra alignment mirror. Estimated Cost: $164.7 |
| Magnetic Ruler | Thorlabs | BHM4 | To check alignment Estimated Cost: $52.74 |
| Micro-Manager Software | Open-source | Download from https://micro-manager.org/Download_Micro-Manager_Latest_Release Estimated Cost: Free |
|
| Microscope Slides | Thermo Fisher Scientific | 12550400 | For slide samples Estimated Cost: $123.9 |
| Microscope Stage | ASI | FTP-2000 with custom parts | To fine-translate samples Estimated Cost: ~$16,000 |
| Mini Vortex Mixer | VWR | 10153-688 | For sample preparation Estimated Cost: $152.64 |
| Motorized Actuator | Thorlabs | Z825B | To fine-translate M1 Estimated Cost: $729.07 |
| Mounted Standard Iris (x2) | Thorlabs | ID20 | At least 2 for alignment Estimated Cost: $118.02 |
| ND Filter Set | Thorlabs | NDK01 | To reduce excitation intensity Estimated Cost: $726.73 |
| Objective Lens 1 | Nikon | Plan Apo 60X/ 1.20 WI | O1 Estimated Cost: ~$15,000 |
| Objective Lens 2 | Nikon | TU Plan Fluor 100X/0.90 | O2 Estimated Cost: ~$6,000 |
| Objective Lens 3 | Mitutoyo | Plan Apo HR 50X/0.75 | O3 Estimated Cost: ~$6,800 |
| OPM Deskewing Software | Open-source | For image processing. Download from https://github.com/QI2lab/OPM Estimated Cost: Free |
|
| Photodiode Power Sensor | Thorlabs | S121C | For measuring laser intensity Estimated Cost: $379.68 |
| Positive Grid Distortion Target | Thorlabs | R1L3S3P | Brightfield alignment Estimated Cost: $267.87 |
| Power Meter Digital Console | Thorlabs | PM100D | For measuring laser intensity Estimated Cost: $1245.48 |
| Rhodamine 6G | Thermo Scientific | J62315.14 | For fluorescent coated slide sample Estimated Cost: $27.7 |
| Right-Angle Clamp for Posts | Thorlabs | RA90 | For M3 support and flip down mirror Estimated Cost: $32.46 |
| RMS-Threaded Cage Plate (x2) | Thorlabs | CP42 | For alignment laser Estimated Cost: $70.56 |
| Shear Plate 2.5-5.0 mm | Thorlabs | SI050P | Estimated Cost: $182.85 |
| Shear Plate 5.0-10.0 mm | Thorlabs | SI100P | Estimated Cost: $201.47 |
| Shear Plate 10.0-25.4 mm | Thorlabs | SI254P | Estimated Cost: $236.42 |
| Shear Plate Viewing Screen | Thorlabs | SIVS | Estimated Cost: $337.74 |
| Shearing Interferometer with 1-3 mm Plate | Thorlabs | SI035 | For checking collimation Estimated Cost: $465.85 |
| Slip-On Post Collar (x35) | Thorlabs | R2 | To maintain post height Estimated Cost: $208.25 |
| Slit | Thorlabs | VA100 | Estimated Cost: $294.64 |
| Slotted Lens Tube, 3" | Thorlabs | SM1L30C | For alignment laser Estimated Cost: $77.45 |
| Square Mirror, 1 x 1" | https://www.amazon.com/Small-Square-Mirror-Pieces-Mosaic/dp/B07FBNMDC1/ref=asc_df_B07FBNMDC1/?tag=hyprod-20&linkCode=df0&hva did=642191768069&hvpos=&hvne tw=g&hvrand=1336734911900437 4691&hvpone=&hvptwo=&hvqmt= &hvdev=c&hvdvcmdl=&hvlocint=& hvlocphy=9031212&hvtargid=pla-1 943952718742&gclid=Cj0KCQiA6L yfBhC3ARIsAG4gkF_AYBpn5EdGL q3mc-RU-nanT5vM4ac9r3-obbzqJoWKPkIPIJU6e1caAjWmEA Lw_wcB&th=1 Estimated Cost: $14.76 |
||
| Stackable Lens Tube 1/2" (x3) | Thorlabs | SM1L05 | To mount CL1-3 Estimated Cost: $40.86 |
| Stackable Lens Tube 1" | Thorlabs | SM1L10 | To mount O3 Estimated Cost: $15.41 |
| Stackable Lens Tube 2" (x2) | Thorlabs | SM1L20 | For camera path Estimated Cost: $35.7 |
| Studded Pedestal Base Adapter (x37) | Thorlabs | BE1 | To attach post mounts to table Estimated Cost: $400.71 |
| Translating Lens Mount (x3) | Thorlabs | LM1XY | To fine-translate pinhole, O2 and O3 Estimated Cost: $441 |
| Translation Stage with Standard Micrometer (x2) | Thorlabs | PT1/M | TS1-2 Estimated Cost: $647.54 |
| Travel Manual Translation Stage | Thorlabs | CT1A | O3 cage translation mount Estimated Cost: $497.3 |
| Tube Lens | Nikon | MXA20696 | TL3 Estimated Cost: $359 |
| White Mounted LED | Thorlabs | MNWHL4 | Brightfield light source Estimated Cost: $171.28 |
| TOTAL ESTIMATED COST: $84,858.98 | |||
| The authors note that many parts were bought used. Here, we have attempted to reflect the retail price of all items, so the total cost can be greatly reduced by buying particular items used, especially the more expensive ones. | |||
| OPTIONAL COMPONENTS | |||
| Grasshopper3 USB3 | FLIR | GS3-U3-23S6C-C | For diagnostic checks during alignment. Acquisiton camera can be used instead, but requires realignment afterwards. Estimated Cost: $1089 |
References
- Girkin, J. M., Carvalho, M. T. The light-sheet microscopy revolution. Journal Optics. 20 (5), 053002 (2018).
- You, R., McGorty, R. Light sheet fluorescence microscopy illuminating soft matter. Frontiers in Physics. 9, 760834 (2021).
- Fuchs, E., Jaffe, J. S., Long, R. A., Azam, F. Thin laser light sheet microscope for microbial oceanography. Optics Express. 10 (2), 145-154 (2002).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Dunsby, C. Optically sectioned imaging by oblique plane microscopy. Optics Express. 16 (25), 20306-20316 (2008).
- Bouchard, M. B., et al. Swept confocally-aligned planar excitation (SCAPE) microscopy for high-speed volumetric imaging of behaving organisms. Nature Photonics. 9 (2), 113-119 (2015).
- Smith, C. W., Botcherby, E. J., Wilson, T. Resolution of oblique-plane images in sectioning microscopy. Optics Express. 19 (3), 2662-2669 (2011).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Wu, Y., et al. Simultaneous multiview capture and fusion improves spatial resolution in wide-field and light-sheet microscopy. Optica. 3 (8), 897-910 (2016).
- Sahasrabudhe, A., Vittal, V., Ghose, A. Peeping in on the cytoskeleton: Light microscopy approaches to actin and microtubule organization. Current Science. 105 (11), 1562-1570 (2013).
- Kumar, M., Kishore, S., Nasenbeny, J., McLean, D. L., Kozorovitskiy, Y. Integrated one- and two-photon scanned oblique plane illumination (SOPi) microscopy for rapid volumetric imaging. Optics Express. 26 (10), 13027-13041 (2018).
- Kim, J., et al. Oblique-plane single-molecule localization microscopy for tissues and small intact animals. Nature Methods. 16 (9), 853-857 (2019).
- Sapoznik, E., et al. A versatile oblique plane microscope for large-scale and high-resolution imaging of subcellular dynamics. eLife. 9, e57681 (2020).
- Bernardello, M., Marsal, M., Gualda, E. J., Loza-Alvarez, P. Light-sheet fluorescence microscopy for the in vivo study of microtubule dynamics in the zebrafish embryo. Biomedical Optics Express. 12 (10), 6237-6254 (2021).
- Shelden, E. A., Colburn, Z. T., Jones, J. C. R. Focusing super resolution on the cytoskeleton. F1000Res. 5, (2016).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), (2019).
- Sheung, J. Y., Garamella, J., Kahl, S. K., Lee, B. Y., McGorty, R. J., Robertson-Anderson, R. M. Motor-driven advection competes with crowding to drive spatiotemporally heterogeneous transport in cytoskeleton composites. Frontiers in Physics. 10, 1055441 (2022).
- Zeiss Lightsheet 7. Light-Sheet Multiview Imaging of Living and Cleared Specimens. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lightsheet-7.html (2023)
- Zeiss Lattice Lightsheet 7. Long-Term Volumetric Imaging of Living Cells. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lattice-lightsheet-7.html (2023)
- Kumar, M., Kishore, S., McLean, D. L., Kozorovitskiy, Y. Crossbill: An open access single objective light-sheet microscopy platform. bioRxiv. , (2021).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: A tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Pitrone, P. G., et al. OpenSPIM: An open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Single Objective Light Sheet Microscope (SOLS) Guide. Sheung Lab Available from: https://sites.google.com/view/sheunglab/microscopy/single-objective-light-microscope-sols (2023)
- Lamb, J. R., Ward, E. N., Kaminski, C. F. Open-source software package for on-the-fly deskewing and live viewing of volumetric lightsheet microscopy data. Biomedical Optics Express. 14 (2), 834-845 (2023).
- . Harvard University. Mitchison Lab Available from: https://mitchison.hms.harvard.edu/home (2023)
- Watkins, S. C., St. Croix, C. M. Light sheet imaging comes of age. Journal of Cell Biology. 217 (5), 1567-1569 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Berezney, J., Goode, B. L., Fraden, S., Dogic, Z. Extensile to contractile transition in active microtubule-actin composites generates layered asters with programmable lifetimes. Proceedings of the National Academy of Sciences of the United States of America. 119 (5), e2115895119 (2022).
- Kim, K., et al. Isomorphic coalescence of aster cores formed in vitro from microtubules and kinesin motors. Physical Biology. 13 (5), 056002 (2016).
- Millett-Sikking, A., et al. . High NA single-objective lightsheet. , (2019).
- Bourgenot, C., Saunter, C. D., Taylor, J. M., Girkin, J. M., Love, G. D. 3D adaptive optics in a light sheet microscope. Optics Express. 20 (12), 13252-13261 (2012).
- Bernardello, M., Gualda, E. J., Loza-Alvarez, P. Modular multimodal platform for classical and high throughput light sheet microscopy. Scientific Reports. 12 (1), 1969 (2022).
- Crombez, S., Leclerc, P., Ray, C., Ducros, N. Computational hyperspectral light-sheet microscopy. Optics Express. 30 (4), 4856-4866 (2022).

