세포골격 네트워크의 시각화를 위한 맞춤형 단일 대물렌즈 광시트 형광 현미경의 설계 및 구축
Summary
이 프로토콜은 단일 대물렌즈 광시트 형광 현미경을 구축하는 방법과 세포골격 네트워크 시각화를 위한 사용법에 대해 자세히 설명합니다.
Abstract
재구성된 세포골격 복합체는 비평형 연성 물질을 연구하기 위한 귀중한 모델 시스템으로 부상했습니다. 이러한 3D 조밀한 네트워크의 역학을 충실하게 포착하려면 종종 형광 컨포칼 현미경과 관련된 광학 절편이 필요합니다. 그러나 최근 광시트 형광 현미경(LSFM)의 발전으로 비용 효율적이고 때로는 우수한 대안으로 자리 잡았습니다. 광학에 익숙하지 않은 세포골격 연구자들이 LSFM을 이용할 수 있도록 기성 부품으로 다용도 광시트 형광 현미경을 제작하는 단계별 초보자 가이드를 제공합니다. 기존 슬라이드 시료로 시료를 장착할 수 있도록 이 LSFM은 여기 및 방출 수집 모두에 단일 대물렌즈를 활용하는 단일 대물렌즈 광시트(SOLS) 설계를 따릅니다. 독자가 기기를 수정하고 특정 요구 사항에 맞게 설계할 수 있도록 SOLS의 각 구성 요소의 기능을 충분히 자세히 설명합니다. 마지막으로, 키네신 구동 미세소관 네트워크에서 과꽃을 시각화하여 이 맞춤형 SOLS 기기의 사용을 시연합니다.
Introduction
광시트 형광 현미경(LSFM)은 여기광이 시트 1,2로 형성되는 고해상도 형광 이미징 기술 제품군을 나타내며, 여기에는 SPIM(Selective Plane Illumination Microscopy), SCAPE(Swept Confocally-Aligned Planar Excitation) 및 OPM(Oblique-Plane Microscopy)3,4,5,6,7이 포함됩니다. epi-fluorescence, total internal reflection fluorescence microscopy (TIRFM) 또는 confocal microscopy와 같은 다른 현미경 방식과 달리 LSFM에서는 광독성이 최소화되며 활발하게 이미징되는 샘플의 평면만 조명되기 때문에 더 긴 시간 척도에 걸쳐 샘플을 이미징할 수 있습니다 8,9,10. 따라서 LSFM 기법은 장기간에 걸쳐 3D 샘플을 이미징하는 데 매우 유용하며, 특히 컨포칼 현미경 기법을 사용하기에는 너무 두꺼운 샘플도 유용합니다. 이러한 이유로 LSFM은 2004년 최초 개발 이후 많은 생리학자, 발달 생물학자 및 신경과학자가 살아있는 제브라피시 및 초파리 배아와 같은 전체 유기체의 시각화를 위해 선택하는 이미징 기술이 되었습니다 3,4,6,11 . 지난 20년 동안 LSFM의 장점은 생체 내 및 시험관내 13,14,15,17 모두에서 조직11,12, 세포 및 세포 내 규모를 포함하여 점진적으로 더 작은 규모에서 구조와 역학을 시각화하는 데 활용되었습니다.
문헌에서 성공적인 사용 사례에 대한 보고에도 불구하고 상용 LSFM 시스템의 높은 비용(작성 당시 ~25만 달러)18,19은 이 기술의 광범위한 사용을 방해합니다. DIY 빌드를 연구자에게 실현 가능한 대안으로 만들기 위해 오픈 액세스 노력인 OpenSPIM22를 포함하여 여러 빌드 가이드 8,13,20,21이 게시되었습니다. 그러나 현재까지 광학 경험이 거의 없는 연구자들은 기존의 슬라이드 장착 샘플과 호환되지 않는 초기 LSFM 설계만 사용할 수 있습니다(그림 1A). 최근의 단일 대물렌즈, 광시트(SOLS) 구현은 여기와 검출 모두에 단일 대물렌즈를 사용하므로(그림 1C) 호환성 5,6,8,13,20과 관련된 한계를 극복했습니다. 그러나 SOLS 설계의 다양성에 대한 비용은 이미징을 위해 물체 평면을 카메라에 릴레이, 틸트 해제 및 이미지로 다시 이미지화하기 위한 두 가지 추가 대물렌즈가 필요하기 때문에 빌드의 복잡성이 크게 증가한다는 것입니다(그림 1D). 복잡한 SOLS 스타일 설정에 쉽게 액세스할 수 있도록 이 백서는 슬라이드 호환 SOLS 시스템의 설계, 구축, 정렬 프로세스 및 사용에 대한 단계별 가이드를 제공하며, 이는 초급 광학 교육 과정만 알고 있는 연구자에게 유용합니다.
프로토콜 자체는 간결하지만 독자는 준비 단계에서 다른 리소스를 참조하여 디자인 또는 하드웨어 고려 사항의 특정 부분에 대해 자세히 알아보아야 합니다. 그러나 독자가 이 설계의 사양을 따르려는 경우 특정 광학 부품을 선택하는 방법을 이해할 필요가 없을 수 있습니다.
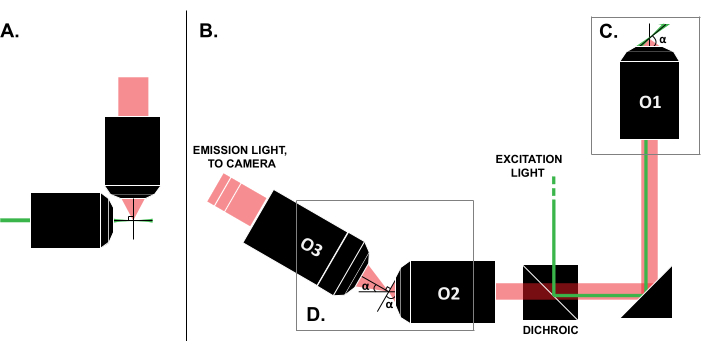
그림 1: 다양한 LSFM 구성의 특성. (A) 초기 LSFM 설계에서 공통적으로 사용되는 두 개의 직교 대물렌즈를 사용한 설정. 이 구성에서는 모세관 또는 겔 실린더를 사용하여 시료를 담는데, 이는 기존의 슬라이드 장착 기술과 호환되지 않습니다. (B) 다음을 보여주는 SOLS 광시트 설계의 개략도: (C) 샘플 평면(O1)에서 여기 및 방출 수집 모두에 사용되는 단일 대물렌즈; 이를 통해 기존 슬라이드를 상단에 장착할 수 있으며 (D) SOLS 방출 경로에 릴레이 대물렌즈 시스템을 장착할 수 있습니다. O2는 방출광을 수집하고 이미지를 확대합니다. O3는 카메라 센서에 올바른 기울기 각도로 평면을 이미지화합니다. 약어: LSFM = light-sheet fluorescence microscopy; SOLS = 단일 대물렌즈 광시트; O1-O3 = 목적. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
이 프로토콜과 관련된 두 가지 중요한 세부 사항은 시스템의 전체 비용과 예상 빌드 및 정렬 시간입니다. 정확한 비용은 가변적이지만 이 SOLS 또는 유사한 DIY 시스템의 토토 비용은 $85,000 USD 범위에 속할 것이라고 편안하게 추정할 수 있습니다. 이 견적은 모든 구성 요소의 소매 가격을 고려하므로 중고 구성 요소를 소싱하면 이 전체 가격이 크게 낮아질 수 있습니다. 구축 시간 측면에서 광학 경험이 거의 없는 사용자가 모든 구성 요소를 사용할 수 있고 준비된 경우 1-2개월 이내에 이 전체 SOLS 시스템을 구축하고 정렬할 것으로 예상하는 것이 합리적입니다. 프로토콜의 길이와 복잡성에도 불구하고, 우리는 비디오 프로토콜과 짝을 이루는 서면 원고의 세부 사항의 양이 이 프로토콜을 간단하고 빠르게 따라갈 수 있도록 해야 한다고 믿습니다.
이 프로토콜에는 두 가지 중요한 단계가 있습니다. 첫째, 갈보의 배치는 3개의 개별 4f 렌즈 쌍의 일부이므로 많은 렌즈의 배치를 결정합니다. 갈보가 O1 및 O2의 후면 초점면과 결합되고 기울기 불변 스캔을 보장하기 위해 올바르게 중앙에 위치하는 것이 중요합니다. 둘째, 이미지 품질은 서로에 대한 O2와 O3의 정렬에 매우 민감합니다. 여기서 먼저 O3 대 O2의 정렬 각도가 여기 광시트의 기울기와 일치하여 유사하게 기울어진 FoV에서 최대한 평평한 조명을 제공하도록 주의를 기울여야 합니다. 둘째, O3는 가능한 한 큰 면적의 평평한 FoV를 유지하기 위해 올바른 축 거리에 배치되어야 합니다. 셋째, O3는 O2-O2 인터페이스를 통과하는 신호를 최대화하기 위해 O3에서 올바른 측면 거리에 배치되어야 합니다.
사용 가능한 FoV 측면에서 이 시스템은 80μm x 80μm 영역에서 일관된 조명으로 평평하고 안정적인 필드를 달성했습니다. 이 영역은 카메라에서 제공하는 최대 FoV보다 작기 때문에 사용 가능한 FoV는 그림 13의 노란색 상자로 표시됩니다. 분해능 측면에서 이 시스템은 x축을 따라 432nm, y축을 따라 421nm의 최소 분해능 거리를 달성했으며, 이는 양호한 FoV에서 가우스 피팅 대 점 확산 함수(PSF)의 평균 시그마 x 및 y를 찾고 2를 곱하여 측정되었습니다. 이 시스템은 총 NA 측면에서 최적화되지 않았으며, 이는 사용자가 이 시스템이 달성한 것보다 더 높은 분해능을 원할 경우 상당한 개선의 여지가 있음을 의미합니다. 이러한 유형의 SOLS 빌드에는 호환 가능한 대물렌즈 옵션이 많이 있으며, 그 중 다수는 더 높은 시스템 해상도에 기여하지만 릴레이 인터페이스 8,11,13,20에서 더 높은 비용, 더 작은 FoV 또는 더 복잡한 정렬 기술의 단점이 있습니다. 이와는 별도로, 사용자가 더 큰 FoV를 원하는 경우, 2D 스캐닝을 허용하기 위해 두 번째 갈보를 통합하면 이러한 목표를 달성할 수 있지만, 추가적인 광학 및 제어 메카니즘이 설계(32)에 통합될 것을 요구할 것이다. 우리는 디자인 프로세스23에 관한 다른 유용한 리소스에 대한 링크와 함께 웹 사이트 페이지에서 시스템 수정에 대한 자세한 내용을 제공했습니다.
이 특정 설계에 대한 특정 구성 요소를 개선하는 것 외에도 이 빌드에 다른 고해상도 현미경 기술이나 양식을 추가하는 것이 매우 실현 가능할 것입니다. 이러한 개선 사항 중 하나는 다중 파장 조명을 통합하는 것인데, 이는 추가 여기 레이저를 원래의 여기 경로8에 정렬하는 것을 포함합니다. 또한 이러한 유형의 SOLS 설계는 샘플에 접근할 수 있기 때문에 광학 핀셋, 미세유체역학 및 유변 물성 측정을 포함하되 이에 국한되지 않는 추가 기능을 현미경에 추가하는 것은 비교적 간단합니다 2,33.
지금까지 공개된 수많은 라이트 시트 가이드와 비교했을 때, 이 프로토콜은 광학 경험이 많지 않은 사용자도 도움이 될 수 있는 수준의 지침을 제공합니다. 기존의 시료 슬라이드 장착 기능을 갖춘 사용자 친화적인 SOLS 빌드를 더 많은 청중이 이용할 수 있도록 함으로써 장비가 활용되었거나 활용될 수 있는 모든 분야에서 SOLS 기반 연구의 응용 분야를 더욱 확장할 수 있기를 바랍니다. SOLS 기기의 응용 분야가 2,34,35 번으로 빠르게 성장하고 있음에도 불구하고 SOLS 유형 기기의 많은 이점과 활용이 아직 탐구되지 않은 상태로 남아 있다고 생각하며 이러한 유형의 기기가 앞으로 나아갈 가능성에 대한 흥분을 표현합니다.
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 연구는 미국 국립과학재단(NSF)의 RUI Award(DMR-2203791)의 지원을 받아 J.S. 정렬 과정에서 Bin Yang 박사와 Manish Kumar 박사가 제공한 지도에 감사드립니다. Kinesin 모터의 준비 지침을 제공해 주신 Jenny Ross 박사와 K. Alice Lindsay 박사님께 감사드립니다.
Materials
| 1" Plano-Concave Lens f = -50 mm | Thorlabs | LC1715-A-ML | For alignment laser Estimated Cost: $49.5 |
| 1" Achromatic Doublet f = 100 mm (x3) | Thorlabs | AC254-100-A-ML | L2, L4 and alignment laser Estimated Cost: $342.42 |
| 1" Achromatic Doublet f = 125 mm | Thorlabs | AC254-125-A-ML | SL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | L3 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | TL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 45 mm | Thorlabs | AC254-045-A-ML | L1 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 75 mm | Thorlabs | AC254-075-A-ML | SL1 Estimated Cost: $114.14 |
| 1" Cylindrical Lens f = 100 mm | Thorlabs | LJ1567RM | CL3 Estimated Cost: $117.62 |
| 1" Cylindrical Lens f = 200 mm | Thorlabs | LJ1653RM | CL2 Estimated Cost: $111.22 |
| 1" Cylindrical Lens f = 50 mm | Thorlabs | LJ1695RM | CL1 Estimated Cost: $117.62 |
| 1" Mounted Pinhole, 30 µm Pinhole Diameter | Thorlabs | P30K | Estimated Cost: $77.08 |
| 1" Silver Mirror (x3) | Thorlabs | PF10-03-P01 | M1, M2, one for alignment Estimated Cost: $168.78 |
| 2" Elliptical Mirror | Thorlabs | PFE20-P01 | M3 Estimated Cost: $179.98 |
| 2" Post Holder (x11) | Thorlabs | PH2 | For custom laser mount, ND wheel, safety screens Estimated Cost: $98.45 |
| 2" Posts (x47) | Thorlabs | TR2 | For custom laser mount and optical components Estimated Cost: $277.3 |
| 3" Posts (x4) | Thorlabs | TR3 | For M3 supports and other mounts Estimated Cost: $24.6 |
| 3" Post Holder (x4) | Thorlabs | PH3 | Estimated Cost: $38.48 |
| 30 to 60 mm Cage Adapter | Thorlabs | LCP33 | To mount O1 Estimated Cost: $45.42 |
| 30mm Cage Filter Wheel | Thorlabs | CFW6 | To mount ND filters Estimated Cost: $172.36 |
| 30mm Cage Plate (x6) | Thorlabs | CP33 | To build alignment cage and alignment laser Estimated Cost: $114.54 |
| 30mm Right-Angle Kinematic Mirror Mount (x3) | Thorlabs | KCB1 | To mount M1 and M2 and for alignment laser Estimated Cost: $463.95 |
| 4" Post Holder (x30) | Thorlabs | PH4 | Estimated Cost: $320.1 |
| 561 nm Laser and Power Supply | Opto Engine LLC | MGL-FN-561-100mW | Excitation laser Estimated Cost: $6000 |
| 60mm Cage Plate (x2) | Thorlabs | LCP01 | To mount TL1 and M3 mount Estimated Cost: $88.52 |
| 60mm Right-Angle Kinematic Mirror Mount | Thorlabs | KCB2 | To mount M3 Estimated Cost: $187.26 |
| 90° Flip Mount | Thorlabs | TRF90 | For alignment laser Estimated Cost: $95.5 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | Thorlabs | SM1A9 | To connect lens tube to camera Estimated Cost: $20.96 |
| Adapter with External SM1 Threads and Internal C-Mount Threads | Thorlabs | SM1A10 | To connect tube lens to lens mount Estimated Cost: $21.82 |
| Adapter with External SM1 Threads and Internal M25 Threads (x2) | Thorlabs | SM1A12 | To mount O1 and O2 Estimated Cost: $47.06 |
| Adapter with External SM1 Threads and Internal M26 Threads | Thorlabs | SM1A27 | To mount O3 Estimated Cost: $22.38 |
| Alignment Disk | Thorlabs | SM1A7 | Estimated Cost: $20.45 |
| Alignment Laser | BISKEE | https://www.amazon.com/Tactical-Presentation-Teaching-Interactive-Adjustable/dp/B09B1VXPNM Estimated Cost: $16.98 |
|
| Autoluorescent Plastic Slide, Red | Chroma | 92001 | Estimated Cost: $20 |
| Beam Shutter | Thorlabs | SM1SH1 | To block laser light Estimated Cost: $65.8 |
| Cage Rotation Mount (x3) | Thorlabs | CRM1T | To mount CL1-3 Estimated Cost: $282.15 |
| Cage System Rods 1" (x8) | Thorlabs | ER1 | To mount M3 and O1 Estimated Cost: $44.8 |
| Cage System Rods 3" (x2) | Thorlabs | ER3 | To mount O3 Estimated Cost: $14.28 |
| Cage System Rods 4" (x4) | Thorlabs | ER4 | To mount slit Estimated Cost: $30.76 |
| Cage System Rods 8" (x2) | Thorlabs | ER8 | For tube lens alignment Estimated Cost: $25.3 |
| Cage System Rods 12" (x8) | Thorlabs | ER12 | For alignment cage Estimated Cost: $145.36 |
| Camera | Andor | Zyla 4.2 sCMOS | Estimated Cost: ~$14,000 |
| Clamping Fork (x35) | Thorlabs | CF125 | To clamp down post mounts Estimated Cost: $338.8 |
| Cover Glass, 22 x 22 mm | Corning | 2850-22 | For slide samples Estimated Cost: $265 |
| Dichroic | AVR | DI01-R405/488/561/635-25×36 | To split exciation/emission paths Estimated Cost: $965 |
| Dovetail Translation Stage | Thorlabs | DT12 | To translate pinhole Estimated Cost: $90.55 |
| Emission Filter | Thorlabs | FELHO600 | Estimated Cost: $140.99 |
| Frosted Glass Alignment Disk (x2) | Thorlabs | DG10-1500-H1 | For alignment cage and intermediate plane Estimated Cost: $75.14 |
| Function Generator | Hewlett-Packard | HP 33120A 15 MHz | To control galvo Estimated Cost: $900 |
| Galvanometer – 1D Large Beam Diameter System | Thorlabs | GVS011 | Estimated Cost: $1715.78 |
| Galvanometer Power Supply | Siglent | SPD3303C | Estimated Cost: $300 |
| Gelrite | Research Products International | G35020-100.0 | Gellan gum for 3D bead sample Estimated Cost: $68.25 |
| FIJI Software | Open-source | Download from https://imagej.net/software/fiji/downloads Estimated Cost: Free |
|
| Hot Plate/ Stirrer | Corning | 6795-220 | For preparing sample solutions Estimated Cost: $550 |
| K-Cube Brushed Motor Controller | Thorlabs | KDC101 | Drives Z825B Estimated Cost: $757.51 |
| Kinematic Mount | Thorlabs | KM100S | To mount dichroic Estimated Cost: $92.01 |
| Kinesis Software | Thorlabs | Download from https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=10285 Estimated Cost: Free |
|
| Laser Light Blocker | Thorlabs | LB1 | For ND filter reflections Estimated Cost: $57.65 |
| Laser Mount | custom made | 3D printed Estimated Cost: N/A |
|
| Laser Safety Screen (x2) | Thorlabs | TPS4 | For blocking stray laser light Estimated Cost: $92.02 |
| Laser Scanning Tube Lens | Thorlabs | TTL200MP | TL1 Estimated Cost: $1491 |
| Lens Mount (x10) | Thorlabs | LMR1 | To mount all lens and extra alignment mirror. Estimated Cost: $164.7 |
| Magnetic Ruler | Thorlabs | BHM4 | To check alignment Estimated Cost: $52.74 |
| Micro-Manager Software | Open-source | Download from https://micro-manager.org/Download_Micro-Manager_Latest_Release Estimated Cost: Free |
|
| Microscope Slides | Thermo Fisher Scientific | 12550400 | For slide samples Estimated Cost: $123.9 |
| Microscope Stage | ASI | FTP-2000 with custom parts | To fine-translate samples Estimated Cost: ~$16,000 |
| Mini Vortex Mixer | VWR | 10153-688 | For sample preparation Estimated Cost: $152.64 |
| Motorized Actuator | Thorlabs | Z825B | To fine-translate M1 Estimated Cost: $729.07 |
| Mounted Standard Iris (x2) | Thorlabs | ID20 | At least 2 for alignment Estimated Cost: $118.02 |
| ND Filter Set | Thorlabs | NDK01 | To reduce excitation intensity Estimated Cost: $726.73 |
| Objective Lens 1 | Nikon | Plan Apo 60X/ 1.20 WI | O1 Estimated Cost: ~$15,000 |
| Objective Lens 2 | Nikon | TU Plan Fluor 100X/0.90 | O2 Estimated Cost: ~$6,000 |
| Objective Lens 3 | Mitutoyo | Plan Apo HR 50X/0.75 | O3 Estimated Cost: ~$6,800 |
| OPM Deskewing Software | Open-source | For image processing. Download from https://github.com/QI2lab/OPM Estimated Cost: Free |
|
| Photodiode Power Sensor | Thorlabs | S121C | For measuring laser intensity Estimated Cost: $379.68 |
| Positive Grid Distortion Target | Thorlabs | R1L3S3P | Brightfield alignment Estimated Cost: $267.87 |
| Power Meter Digital Console | Thorlabs | PM100D | For measuring laser intensity Estimated Cost: $1245.48 |
| Rhodamine 6G | Thermo Scientific | J62315.14 | For fluorescent coated slide sample Estimated Cost: $27.7 |
| Right-Angle Clamp for Posts | Thorlabs | RA90 | For M3 support and flip down mirror Estimated Cost: $32.46 |
| RMS-Threaded Cage Plate (x2) | Thorlabs | CP42 | For alignment laser Estimated Cost: $70.56 |
| Shear Plate 2.5-5.0 mm | Thorlabs | SI050P | Estimated Cost: $182.85 |
| Shear Plate 5.0-10.0 mm | Thorlabs | SI100P | Estimated Cost: $201.47 |
| Shear Plate 10.0-25.4 mm | Thorlabs | SI254P | Estimated Cost: $236.42 |
| Shear Plate Viewing Screen | Thorlabs | SIVS | Estimated Cost: $337.74 |
| Shearing Interferometer with 1-3 mm Plate | Thorlabs | SI035 | For checking collimation Estimated Cost: $465.85 |
| Slip-On Post Collar (x35) | Thorlabs | R2 | To maintain post height Estimated Cost: $208.25 |
| Slit | Thorlabs | VA100 | Estimated Cost: $294.64 |
| Slotted Lens Tube, 3" | Thorlabs | SM1L30C | For alignment laser Estimated Cost: $77.45 |
| Square Mirror, 1 x 1" | https://www.amazon.com/Small-Square-Mirror-Pieces-Mosaic/dp/B07FBNMDC1/ref=asc_df_B07FBNMDC1/?tag=hyprod-20&linkCode=df0&hva did=642191768069&hvpos=&hvne tw=g&hvrand=1336734911900437 4691&hvpone=&hvptwo=&hvqmt= &hvdev=c&hvdvcmdl=&hvlocint=& hvlocphy=9031212&hvtargid=pla-1 943952718742&gclid=Cj0KCQiA6L yfBhC3ARIsAG4gkF_AYBpn5EdGL q3mc-RU-nanT5vM4ac9r3-obbzqJoWKPkIPIJU6e1caAjWmEA Lw_wcB&th=1 Estimated Cost: $14.76 |
||
| Stackable Lens Tube 1/2" (x3) | Thorlabs | SM1L05 | To mount CL1-3 Estimated Cost: $40.86 |
| Stackable Lens Tube 1" | Thorlabs | SM1L10 | To mount O3 Estimated Cost: $15.41 |
| Stackable Lens Tube 2" (x2) | Thorlabs | SM1L20 | For camera path Estimated Cost: $35.7 |
| Studded Pedestal Base Adapter (x37) | Thorlabs | BE1 | To attach post mounts to table Estimated Cost: $400.71 |
| Translating Lens Mount (x3) | Thorlabs | LM1XY | To fine-translate pinhole, O2 and O3 Estimated Cost: $441 |
| Translation Stage with Standard Micrometer (x2) | Thorlabs | PT1/M | TS1-2 Estimated Cost: $647.54 |
| Travel Manual Translation Stage | Thorlabs | CT1A | O3 cage translation mount Estimated Cost: $497.3 |
| Tube Lens | Nikon | MXA20696 | TL3 Estimated Cost: $359 |
| White Mounted LED | Thorlabs | MNWHL4 | Brightfield light source Estimated Cost: $171.28 |
| TOTAL ESTIMATED COST: $84,858.98 | |||
| The authors note that many parts were bought used. Here, we have attempted to reflect the retail price of all items, so the total cost can be greatly reduced by buying particular items used, especially the more expensive ones. | |||
| OPTIONAL COMPONENTS | |||
| Grasshopper3 USB3 | FLIR | GS3-U3-23S6C-C | For diagnostic checks during alignment. Acquisiton camera can be used instead, but requires realignment afterwards. Estimated Cost: $1089 |
References
- Girkin, J. M., Carvalho, M. T. The light-sheet microscopy revolution. Journal Optics. 20 (5), 053002 (2018).
- You, R., McGorty, R. Light sheet fluorescence microscopy illuminating soft matter. Frontiers in Physics. 9, 760834 (2021).
- Fuchs, E., Jaffe, J. S., Long, R. A., Azam, F. Thin laser light sheet microscope for microbial oceanography. Optics Express. 10 (2), 145-154 (2002).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Dunsby, C. Optically sectioned imaging by oblique plane microscopy. Optics Express. 16 (25), 20306-20316 (2008).
- Bouchard, M. B., et al. Swept confocally-aligned planar excitation (SCAPE) microscopy for high-speed volumetric imaging of behaving organisms. Nature Photonics. 9 (2), 113-119 (2015).
- Smith, C. W., Botcherby, E. J., Wilson, T. Resolution of oblique-plane images in sectioning microscopy. Optics Express. 19 (3), 2662-2669 (2011).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Wu, Y., et al. Simultaneous multiview capture and fusion improves spatial resolution in wide-field and light-sheet microscopy. Optica. 3 (8), 897-910 (2016).
- Sahasrabudhe, A., Vittal, V., Ghose, A. Peeping in on the cytoskeleton: Light microscopy approaches to actin and microtubule organization. Current Science. 105 (11), 1562-1570 (2013).
- Kumar, M., Kishore, S., Nasenbeny, J., McLean, D. L., Kozorovitskiy, Y. Integrated one- and two-photon scanned oblique plane illumination (SOPi) microscopy for rapid volumetric imaging. Optics Express. 26 (10), 13027-13041 (2018).
- Kim, J., et al. Oblique-plane single-molecule localization microscopy for tissues and small intact animals. Nature Methods. 16 (9), 853-857 (2019).
- Sapoznik, E., et al. A versatile oblique plane microscope for large-scale and high-resolution imaging of subcellular dynamics. eLife. 9, e57681 (2020).
- Bernardello, M., Marsal, M., Gualda, E. J., Loza-Alvarez, P. Light-sheet fluorescence microscopy for the in vivo study of microtubule dynamics in the zebrafish embryo. Biomedical Optics Express. 12 (10), 6237-6254 (2021).
- Shelden, E. A., Colburn, Z. T., Jones, J. C. R. Focusing super resolution on the cytoskeleton. F1000Res. 5, (2016).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), (2019).
- Sheung, J. Y., Garamella, J., Kahl, S. K., Lee, B. Y., McGorty, R. J., Robertson-Anderson, R. M. Motor-driven advection competes with crowding to drive spatiotemporally heterogeneous transport in cytoskeleton composites. Frontiers in Physics. 10, 1055441 (2022).
- Zeiss Lightsheet 7. Light-Sheet Multiview Imaging of Living and Cleared Specimens. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lightsheet-7.html (2023)
- Zeiss Lattice Lightsheet 7. Long-Term Volumetric Imaging of Living Cells. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lattice-lightsheet-7.html (2023)
- Kumar, M., Kishore, S., McLean, D. L., Kozorovitskiy, Y. Crossbill: An open access single objective light-sheet microscopy platform. bioRxiv. , (2021).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: A tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Pitrone, P. G., et al. OpenSPIM: An open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Single Objective Light Sheet Microscope (SOLS) Guide. Sheung Lab Available from: https://sites.google.com/view/sheunglab/microscopy/single-objective-light-microscope-sols (2023)
- Lamb, J. R., Ward, E. N., Kaminski, C. F. Open-source software package for on-the-fly deskewing and live viewing of volumetric lightsheet microscopy data. Biomedical Optics Express. 14 (2), 834-845 (2023).
- . Harvard University. Mitchison Lab Available from: https://mitchison.hms.harvard.edu/home (2023)
- Watkins, S. C., St. Croix, C. M. Light sheet imaging comes of age. Journal of Cell Biology. 217 (5), 1567-1569 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Berezney, J., Goode, B. L., Fraden, S., Dogic, Z. Extensile to contractile transition in active microtubule-actin composites generates layered asters with programmable lifetimes. Proceedings of the National Academy of Sciences of the United States of America. 119 (5), e2115895119 (2022).
- Kim, K., et al. Isomorphic coalescence of aster cores formed in vitro from microtubules and kinesin motors. Physical Biology. 13 (5), 056002 (2016).
- Millett-Sikking, A., et al. . High NA single-objective lightsheet. , (2019).
- Bourgenot, C., Saunter, C. D., Taylor, J. M., Girkin, J. M., Love, G. D. 3D adaptive optics in a light sheet microscope. Optics Express. 20 (12), 13252-13261 (2012).
- Bernardello, M., Gualda, E. J., Loza-Alvarez, P. Modular multimodal platform for classical and high throughput light sheet microscopy. Scientific Reports. 12 (1), 1969 (2022).
- Crombez, S., Leclerc, P., Ray, C., Ducros, N. Computational hyperspectral light-sheet microscopy. Optics Express. 30 (4), 4856-4866 (2022).

