Проектирование и создание настраиваемого однообъективного флуоресцентного микроскопа для визуализации сетей цитоскелета
Summary
В этом протоколе подробно описывается, как построить однообъективный флуоресцентный микроскоп со световым листом и как его использовать для визуализации сетей цитоскелета.
Abstract
Восстановленные композиты цитоскелета стали ценной модельной системой для изучения неравновесной мягкой материи. Точное воспроизведение динамики этих 3D-плотных сетей требует оптического секционирования, которое часто ассоциируется с флуоресцентными конфокальными микроскопами. Тем не менее, недавние разработки в области световой флуоресцентной микроскопии (LSFM) зарекомендовали себя как экономически эффективная, а иногда и превосходная альтернатива. Чтобы сделать LSFM доступным для исследователей цитоскелетов, менее знакомых с оптикой, мы представляем пошаговое руководство для начинающих по созданию универсального флуоресцентного микроскопа со световым листом из готовых компонентов. Чтобы обеспечить возможность монтажа образцов с традиционными образцами слайдов, этот LSFM использует конструкцию с одним объективом (SOLS), в которой используется один объектив как для возбуждения, так и для сбора излучения. Мы описываем функции каждого компонента SOLS достаточно подробно, чтобы читатели могли модифицировать инструментарий и спроектировать его в соответствии со своими конкретными потребностями. Наконец, мы демонстрируем использование этого специального инструмента SOLS, визуализируя астры в сетях микротрубочек, управляемых кинезином.
Introduction
Световая флуоресцентная микроскопия (LSFM) представляет собой семейство методов флуоресцентной визуализации с высоким разрешением, в которых возбуждающий свет формируется в лист 1,2, включая селективную плоскую иллюминированную микроскопию (SPIM), развертку конфо-выровненного планарного возбуждения (SCAPE) и микроскопию в наклонной плоскости (OPM)3,4,5,6,7. В отличие от других методов микроскопии, таких как эпифлуоресценция, флуоресцентная микроскопия с полным внутренним отражением (TIRFM) или конфокальная микроскопия, фототоксичность при LSFM минимальна, и образцы могут быть визуализированы в течение более длительных временных масштабов, поскольку освещается только плоскость активно визуализируемого образца 8,9,10. Таким образом, методы LSFM чрезвычайно полезны для визуализации 3D-образцов в течение длительных периодов времени, особенно даже тех, которые слишком толсты для методов конфокальной микроскопии. По этим причинам, с момента своей первоначальной разработки в 2004 году, LSFM стала предпочтительным методом визуализации для многих физиологов, биологов развития и нейробиологов для визуализации целых организмов, таких как живые рыбки данио и эмбрионы дрозофилы 3,4,6,11 . В последние два десятилетия преимущества LSFM были использованы для визуализации структуры и динамики во все меньших масштабах, включая тканевые 11,12, клеточные и субклеточные масштабы, как in vivo, так и in vitro13,14,15,17.
Несмотря на сообщения об успешных вариантах использования в литературе, высокая стоимость коммерческих LSFM-систем (~0,25 млн. долларов США на момент написания статьи)18,19 препятствует широкому использованию методики. Для того, чтобы сделать сборку своими руками возможной альтернативой для исследователей, было опубликовано несколько руководств по сборке 8,13,20,21, включая проект открытого доступа OpenSPIM 22. Однако на сегодняшний день исследователи с минимальным опытом работы с оптикой могут использовать только более ранние конструкции ЛСФМ, которые несовместимы с традиционными образцами на затворе (рис. 1А). В недавней реализации однообъективного светового листа (SOLS) используется один объектив как для возбуждения, так и для детектирования (рис. 1C), тем самым преодолевая ограничение, связанное с совместимостью 5,6,8,13,20. Тем не менее, цена универсальности конструкции SOLS заключается в существенном увеличении сложности сборки из-за необходимости использования двух дополнительных объективов для ретрансляции, снятия наклона и повторного изображения плоскости объекта на камеру для получения изображения (рис. 1D). Чтобы облегчить доступ к сложным установкам в стиле SOLS, в этом документе представлено пошаговое руководство по проектированию, сборке, процессу юстировки и использования системы SOLS, совместимой со слайдами, которое будет полезно исследователям, знающим только начальный курс оптики.
Несмотря на то, что сам протокол является кратким, читатели должны обратиться к другим ресурсам на этапах подготовки, чтобы узнать больше о конкретных частях проекта или аппаратных аспектах. Однако, если читатель намерен следовать спецификациям этой конструкции, ему может не понадобиться понимание того, как выбрать те или иные оптические компоненты.
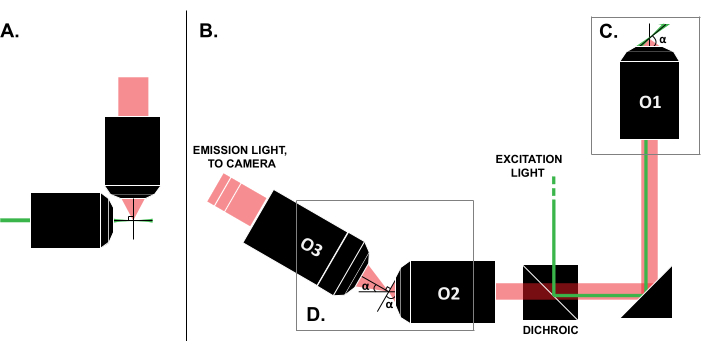
Рисунок 1: Характеристики различных конфигураций LSFM. (A) Установка с двумя ортогональными объективами, характерная для ранних конструкций LSFM. В этой конфигурации для размещения образца используется капиллярная трубка или цилиндр с гелем, что несовместимо с традиционными методами монтажа на скольжение. (B) Схема светового листа SOLS, показывающая следующее: (C) единственный объектив, используемый как для возбуждения, так и для сбора излучения в плоскости образца (O1); Это позволяет установить сверху традиционный ползун и (D) систему релейных объективов на пути излучения SOLS. O2 собирает излучаемый свет и уменьшает изображение. O3 визуализирует плоскость под правильным углом наклона на датчик камеры. Сокращения: LSFM = световая флуоресцентная микроскопия; SOLS = однообъективный световой лист; O1-O3 = цели. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Двумя важными деталями, касающимися этого протокола, являются общая стоимость системы и ожидаемое время сборки и выравнивания. Хотя точная стоимость варьируется, мы можем с уверенностью оценить, что общая стоимость этой SOLS или аналогичной системы DIY будет находиться в диапазоне 85 000 долларов США. Мы отмечаем, что эта оценка учитывает розничную цену всех компонентов, поэтому эта общая цена может быть значительно снижена за счет использования бывших в употреблении компонентов. С точки зрения времени сборки, было бы разумно ожидать, что пользователь с небольшим опытом в области оптики построит и выровняет всю эту систему SOLS в течение 1-2 месяцев, при условии, что все компоненты доступны и готовы. Несмотря на длину и сложность протокола, мы считаем, что количество деталей в письменной рукописи в сочетании с видеопротоколом должно сделать этот протокол простым и быстрым для выполнения.
В этом протоколе есть два важных шага. Во-первых, расположение гальвы определяет расположение многих линз, поскольку она является частью трех отдельных пар объективов 4f. Крайне важно, чтобы гальво был сопряжен с задними фокальными плоскостями O1 и O2 и правильно центрирован для обеспечения тилт-инвариантного сканирования. Во-вторых, качество изображения чрезвычайно чувствительно к выравниванию O2 и O3 по отношению друг к другу. При этом необходимо следить за тем, чтобы, во-первых, угол выравнивания O3 к O2 соответствовал наклону светового листа возбуждения, что обеспечивает максимально ровное освещение по аналогично наклоненному полю зрения. Во-вторых, O3 должен располагаться на правильном осевом расстоянии, чтобы поддерживать плоский угол обзора с как можно большей площадью. В-третьих, O3 должен быть размещен на правильном боковом расстоянии от O2, чтобы максимизировать сигнал, проходящий через интерфейс O2-O3.
С точки зрения полезного поля зрения, эта система обеспечила плоское, надежное поле с постоянным освещением на площади 80 мкм x 80 мкм. Эта область меньше, чем максимальное поле зрения, обеспечиваемое камерой, поэтому полезное поле зрения обозначено желтым прямоугольником на рисунке 13. С точки зрения разрешающей способности, эта система достигла минимального разрешимого расстояния 432 нм по оси x и 421 нм по оси y, которое было измерено путем нахождения средних сигма x и y гауссовых функций аппроксимации к точке разброса (PSF) в хорошем поле зрения и умножения на два. Мы отмечаем, что эта система не была оптимизирована с точки зрения общего NA, а это означает, что есть возможности для значительного улучшения, если пользователи хотят иметь разрешающую способность выше, чем та, которую достигла эта система. Существует множество совместимых объективных опций для этого типа построения SOLS, многие из которых способствуют более высокому разрешению системы, но имеют недостатки, такие как более высокая стоимость, меньшее поле зрения или более сложные методы юстировки на интерфейсе реле 8,11,13,20. Кроме того, если пользователи захотят получить более широкий угол обзора, включение второго гальванического датчика для обеспечения 2D-сканирования позволит достичь этой цели, но потребует интеграциив конструкцию дополнительной оптики и механики управления. Более подробную информацию об изменениях в системе мы разместили на странице нашего веб-сайта, а также ссылки на другие полезные ресурсы, касающиеся процесса проектирования23.
Помимо улучшения конкретных компонентов для этой конкретной конструкции, было бы вполне реально добавить в эту конструкцию другие методы или модальности микроскопии с высоким разрешением. Одним из таких усовершенствований было бы включение многоволновой подсветки, что потребовало бы юстировки дополнительных возбуждающих лазеров по исходному тракту возбуждения8. Кроме того, поскольку этот тип конструкции SOLS оставляет образец доступным, добавление дополнительных функций к микроскопу, включая, помимо прочего, оптический пинцет, микрофлюидику и реометрию, является относительно простым 2,33.
По сравнению с мириадами опубликованных руководств по освещению, этот протокол предоставляет инструкции на уровне понимания, которые могут быть полезны пользователю, не имеющему значительного опыта работы с оптикой. Сделав удобную для пользователя конструкцию SOLS с традиционными возможностями монтажа образцов слайдов доступной для более широкой аудитории, мы надеемся обеспечить еще большее расширение применения исследований на основе SOLS во всех областях, в которых инструмент используется или может быть использован. Несмотря на то, что количество применений инструментов SOLS быстро растет (2,34,35), мы считаем, что многие преимущества и способы использования инструментов типа SOLS все еще остаются неизученными, и выражаем воодушевление по поводу возможностей для развития этого типа инструментов.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержана премией RUI Национального научного фонда (NSF) (DMR-2203791) J.S. Мы благодарны за руководство, предоставленное доктором Бин Янгом и доктором Манишем Кумаром в процессе выравнивания. Мы благодарим д-ра Дженни Росс и К. Элис Линдсей за инструкции по подготовке кинезиновых моторов.
Materials
| 1" Plano-Concave Lens f = -50 mm | Thorlabs | LC1715-A-ML | For alignment laser Estimated Cost: $49.5 |
| 1" Achromatic Doublet f = 100 mm (x3) | Thorlabs | AC254-100-A-ML | L2, L4 and alignment laser Estimated Cost: $342.42 |
| 1" Achromatic Doublet f = 125 mm | Thorlabs | AC254-125-A-ML | SL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | L3 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | TL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 45 mm | Thorlabs | AC254-045-A-ML | L1 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 75 mm | Thorlabs | AC254-075-A-ML | SL1 Estimated Cost: $114.14 |
| 1" Cylindrical Lens f = 100 mm | Thorlabs | LJ1567RM | CL3 Estimated Cost: $117.62 |
| 1" Cylindrical Lens f = 200 mm | Thorlabs | LJ1653RM | CL2 Estimated Cost: $111.22 |
| 1" Cylindrical Lens f = 50 mm | Thorlabs | LJ1695RM | CL1 Estimated Cost: $117.62 |
| 1" Mounted Pinhole, 30 µm Pinhole Diameter | Thorlabs | P30K | Estimated Cost: $77.08 |
| 1" Silver Mirror (x3) | Thorlabs | PF10-03-P01 | M1, M2, one for alignment Estimated Cost: $168.78 |
| 2" Elliptical Mirror | Thorlabs | PFE20-P01 | M3 Estimated Cost: $179.98 |
| 2" Post Holder (x11) | Thorlabs | PH2 | For custom laser mount, ND wheel, safety screens Estimated Cost: $98.45 |
| 2" Posts (x47) | Thorlabs | TR2 | For custom laser mount and optical components Estimated Cost: $277.3 |
| 3" Posts (x4) | Thorlabs | TR3 | For M3 supports and other mounts Estimated Cost: $24.6 |
| 3" Post Holder (x4) | Thorlabs | PH3 | Estimated Cost: $38.48 |
| 30 to 60 mm Cage Adapter | Thorlabs | LCP33 | To mount O1 Estimated Cost: $45.42 |
| 30mm Cage Filter Wheel | Thorlabs | CFW6 | To mount ND filters Estimated Cost: $172.36 |
| 30mm Cage Plate (x6) | Thorlabs | CP33 | To build alignment cage and alignment laser Estimated Cost: $114.54 |
| 30mm Right-Angle Kinematic Mirror Mount (x3) | Thorlabs | KCB1 | To mount M1 and M2 and for alignment laser Estimated Cost: $463.95 |
| 4" Post Holder (x30) | Thorlabs | PH4 | Estimated Cost: $320.1 |
| 561 nm Laser and Power Supply | Opto Engine LLC | MGL-FN-561-100mW | Excitation laser Estimated Cost: $6000 |
| 60mm Cage Plate (x2) | Thorlabs | LCP01 | To mount TL1 and M3 mount Estimated Cost: $88.52 |
| 60mm Right-Angle Kinematic Mirror Mount | Thorlabs | KCB2 | To mount M3 Estimated Cost: $187.26 |
| 90° Flip Mount | Thorlabs | TRF90 | For alignment laser Estimated Cost: $95.5 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | Thorlabs | SM1A9 | To connect lens tube to camera Estimated Cost: $20.96 |
| Adapter with External SM1 Threads and Internal C-Mount Threads | Thorlabs | SM1A10 | To connect tube lens to lens mount Estimated Cost: $21.82 |
| Adapter with External SM1 Threads and Internal M25 Threads (x2) | Thorlabs | SM1A12 | To mount O1 and O2 Estimated Cost: $47.06 |
| Adapter with External SM1 Threads and Internal M26 Threads | Thorlabs | SM1A27 | To mount O3 Estimated Cost: $22.38 |
| Alignment Disk | Thorlabs | SM1A7 | Estimated Cost: $20.45 |
| Alignment Laser | BISKEE | https://www.amazon.com/Tactical-Presentation-Teaching-Interactive-Adjustable/dp/B09B1VXPNM Estimated Cost: $16.98 |
|
| Autoluorescent Plastic Slide, Red | Chroma | 92001 | Estimated Cost: $20 |
| Beam Shutter | Thorlabs | SM1SH1 | To block laser light Estimated Cost: $65.8 |
| Cage Rotation Mount (x3) | Thorlabs | CRM1T | To mount CL1-3 Estimated Cost: $282.15 |
| Cage System Rods 1" (x8) | Thorlabs | ER1 | To mount M3 and O1 Estimated Cost: $44.8 |
| Cage System Rods 3" (x2) | Thorlabs | ER3 | To mount O3 Estimated Cost: $14.28 |
| Cage System Rods 4" (x4) | Thorlabs | ER4 | To mount slit Estimated Cost: $30.76 |
| Cage System Rods 8" (x2) | Thorlabs | ER8 | For tube lens alignment Estimated Cost: $25.3 |
| Cage System Rods 12" (x8) | Thorlabs | ER12 | For alignment cage Estimated Cost: $145.36 |
| Camera | Andor | Zyla 4.2 sCMOS | Estimated Cost: ~$14,000 |
| Clamping Fork (x35) | Thorlabs | CF125 | To clamp down post mounts Estimated Cost: $338.8 |
| Cover Glass, 22 x 22 mm | Corning | 2850-22 | For slide samples Estimated Cost: $265 |
| Dichroic | AVR | DI01-R405/488/561/635-25×36 | To split exciation/emission paths Estimated Cost: $965 |
| Dovetail Translation Stage | Thorlabs | DT12 | To translate pinhole Estimated Cost: $90.55 |
| Emission Filter | Thorlabs | FELHO600 | Estimated Cost: $140.99 |
| Frosted Glass Alignment Disk (x2) | Thorlabs | DG10-1500-H1 | For alignment cage and intermediate plane Estimated Cost: $75.14 |
| Function Generator | Hewlett-Packard | HP 33120A 15 MHz | To control galvo Estimated Cost: $900 |
| Galvanometer – 1D Large Beam Diameter System | Thorlabs | GVS011 | Estimated Cost: $1715.78 |
| Galvanometer Power Supply | Siglent | SPD3303C | Estimated Cost: $300 |
| Gelrite | Research Products International | G35020-100.0 | Gellan gum for 3D bead sample Estimated Cost: $68.25 |
| FIJI Software | Open-source | Download from https://imagej.net/software/fiji/downloads Estimated Cost: Free |
|
| Hot Plate/ Stirrer | Corning | 6795-220 | For preparing sample solutions Estimated Cost: $550 |
| K-Cube Brushed Motor Controller | Thorlabs | KDC101 | Drives Z825B Estimated Cost: $757.51 |
| Kinematic Mount | Thorlabs | KM100S | To mount dichroic Estimated Cost: $92.01 |
| Kinesis Software | Thorlabs | Download from https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=10285 Estimated Cost: Free |
|
| Laser Light Blocker | Thorlabs | LB1 | For ND filter reflections Estimated Cost: $57.65 |
| Laser Mount | custom made | 3D printed Estimated Cost: N/A |
|
| Laser Safety Screen (x2) | Thorlabs | TPS4 | For blocking stray laser light Estimated Cost: $92.02 |
| Laser Scanning Tube Lens | Thorlabs | TTL200MP | TL1 Estimated Cost: $1491 |
| Lens Mount (x10) | Thorlabs | LMR1 | To mount all lens and extra alignment mirror. Estimated Cost: $164.7 |
| Magnetic Ruler | Thorlabs | BHM4 | To check alignment Estimated Cost: $52.74 |
| Micro-Manager Software | Open-source | Download from https://micro-manager.org/Download_Micro-Manager_Latest_Release Estimated Cost: Free |
|
| Microscope Slides | Thermo Fisher Scientific | 12550400 | For slide samples Estimated Cost: $123.9 |
| Microscope Stage | ASI | FTP-2000 with custom parts | To fine-translate samples Estimated Cost: ~$16,000 |
| Mini Vortex Mixer | VWR | 10153-688 | For sample preparation Estimated Cost: $152.64 |
| Motorized Actuator | Thorlabs | Z825B | To fine-translate M1 Estimated Cost: $729.07 |
| Mounted Standard Iris (x2) | Thorlabs | ID20 | At least 2 for alignment Estimated Cost: $118.02 |
| ND Filter Set | Thorlabs | NDK01 | To reduce excitation intensity Estimated Cost: $726.73 |
| Objective Lens 1 | Nikon | Plan Apo 60X/ 1.20 WI | O1 Estimated Cost: ~$15,000 |
| Objective Lens 2 | Nikon | TU Plan Fluor 100X/0.90 | O2 Estimated Cost: ~$6,000 |
| Objective Lens 3 | Mitutoyo | Plan Apo HR 50X/0.75 | O3 Estimated Cost: ~$6,800 |
| OPM Deskewing Software | Open-source | For image processing. Download from https://github.com/QI2lab/OPM Estimated Cost: Free |
|
| Photodiode Power Sensor | Thorlabs | S121C | For measuring laser intensity Estimated Cost: $379.68 |
| Positive Grid Distortion Target | Thorlabs | R1L3S3P | Brightfield alignment Estimated Cost: $267.87 |
| Power Meter Digital Console | Thorlabs | PM100D | For measuring laser intensity Estimated Cost: $1245.48 |
| Rhodamine 6G | Thermo Scientific | J62315.14 | For fluorescent coated slide sample Estimated Cost: $27.7 |
| Right-Angle Clamp for Posts | Thorlabs | RA90 | For M3 support and flip down mirror Estimated Cost: $32.46 |
| RMS-Threaded Cage Plate (x2) | Thorlabs | CP42 | For alignment laser Estimated Cost: $70.56 |
| Shear Plate 2.5-5.0 mm | Thorlabs | SI050P | Estimated Cost: $182.85 |
| Shear Plate 5.0-10.0 mm | Thorlabs | SI100P | Estimated Cost: $201.47 |
| Shear Plate 10.0-25.4 mm | Thorlabs | SI254P | Estimated Cost: $236.42 |
| Shear Plate Viewing Screen | Thorlabs | SIVS | Estimated Cost: $337.74 |
| Shearing Interferometer with 1-3 mm Plate | Thorlabs | SI035 | For checking collimation Estimated Cost: $465.85 |
| Slip-On Post Collar (x35) | Thorlabs | R2 | To maintain post height Estimated Cost: $208.25 |
| Slit | Thorlabs | VA100 | Estimated Cost: $294.64 |
| Slotted Lens Tube, 3" | Thorlabs | SM1L30C | For alignment laser Estimated Cost: $77.45 |
| Square Mirror, 1 x 1" | https://www.amazon.com/Small-Square-Mirror-Pieces-Mosaic/dp/B07FBNMDC1/ref=asc_df_B07FBNMDC1/?tag=hyprod-20&linkCode=df0&hva did=642191768069&hvpos=&hvne tw=g&hvrand=1336734911900437 4691&hvpone=&hvptwo=&hvqmt= &hvdev=c&hvdvcmdl=&hvlocint=& hvlocphy=9031212&hvtargid=pla-1 943952718742&gclid=Cj0KCQiA6L yfBhC3ARIsAG4gkF_AYBpn5EdGL q3mc-RU-nanT5vM4ac9r3-obbzqJoWKPkIPIJU6e1caAjWmEA Lw_wcB&th=1 Estimated Cost: $14.76 |
||
| Stackable Lens Tube 1/2" (x3) | Thorlabs | SM1L05 | To mount CL1-3 Estimated Cost: $40.86 |
| Stackable Lens Tube 1" | Thorlabs | SM1L10 | To mount O3 Estimated Cost: $15.41 |
| Stackable Lens Tube 2" (x2) | Thorlabs | SM1L20 | For camera path Estimated Cost: $35.7 |
| Studded Pedestal Base Adapter (x37) | Thorlabs | BE1 | To attach post mounts to table Estimated Cost: $400.71 |
| Translating Lens Mount (x3) | Thorlabs | LM1XY | To fine-translate pinhole, O2 and O3 Estimated Cost: $441 |
| Translation Stage with Standard Micrometer (x2) | Thorlabs | PT1/M | TS1-2 Estimated Cost: $647.54 |
| Travel Manual Translation Stage | Thorlabs | CT1A | O3 cage translation mount Estimated Cost: $497.3 |
| Tube Lens | Nikon | MXA20696 | TL3 Estimated Cost: $359 |
| White Mounted LED | Thorlabs | MNWHL4 | Brightfield light source Estimated Cost: $171.28 |
| TOTAL ESTIMATED COST: $84,858.98 | |||
| The authors note that many parts were bought used. Here, we have attempted to reflect the retail price of all items, so the total cost can be greatly reduced by buying particular items used, especially the more expensive ones. | |||
| OPTIONAL COMPONENTS | |||
| Grasshopper3 USB3 | FLIR | GS3-U3-23S6C-C | For diagnostic checks during alignment. Acquisiton camera can be used instead, but requires realignment afterwards. Estimated Cost: $1089 |
References
- Girkin, J. M., Carvalho, M. T. The light-sheet microscopy revolution. Journal Optics. 20 (5), 053002 (2018).
- You, R., McGorty, R. Light sheet fluorescence microscopy illuminating soft matter. Frontiers in Physics. 9, 760834 (2021).
- Fuchs, E., Jaffe, J. S., Long, R. A., Azam, F. Thin laser light sheet microscope for microbial oceanography. Optics Express. 10 (2), 145-154 (2002).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Dunsby, C. Optically sectioned imaging by oblique plane microscopy. Optics Express. 16 (25), 20306-20316 (2008).
- Bouchard, M. B., et al. Swept confocally-aligned planar excitation (SCAPE) microscopy for high-speed volumetric imaging of behaving organisms. Nature Photonics. 9 (2), 113-119 (2015).
- Smith, C. W., Botcherby, E. J., Wilson, T. Resolution of oblique-plane images in sectioning microscopy. Optics Express. 19 (3), 2662-2669 (2011).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Wu, Y., et al. Simultaneous multiview capture and fusion improves spatial resolution in wide-field and light-sheet microscopy. Optica. 3 (8), 897-910 (2016).
- Sahasrabudhe, A., Vittal, V., Ghose, A. Peeping in on the cytoskeleton: Light microscopy approaches to actin and microtubule organization. Current Science. 105 (11), 1562-1570 (2013).
- Kumar, M., Kishore, S., Nasenbeny, J., McLean, D. L., Kozorovitskiy, Y. Integrated one- and two-photon scanned oblique plane illumination (SOPi) microscopy for rapid volumetric imaging. Optics Express. 26 (10), 13027-13041 (2018).
- Kim, J., et al. Oblique-plane single-molecule localization microscopy for tissues and small intact animals. Nature Methods. 16 (9), 853-857 (2019).
- Sapoznik, E., et al. A versatile oblique plane microscope for large-scale and high-resolution imaging of subcellular dynamics. eLife. 9, e57681 (2020).
- Bernardello, M., Marsal, M., Gualda, E. J., Loza-Alvarez, P. Light-sheet fluorescence microscopy for the in vivo study of microtubule dynamics in the zebrafish embryo. Biomedical Optics Express. 12 (10), 6237-6254 (2021).
- Shelden, E. A., Colburn, Z. T., Jones, J. C. R. Focusing super resolution on the cytoskeleton. F1000Res. 5, (2016).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), (2019).
- Sheung, J. Y., Garamella, J., Kahl, S. K., Lee, B. Y., McGorty, R. J., Robertson-Anderson, R. M. Motor-driven advection competes with crowding to drive spatiotemporally heterogeneous transport in cytoskeleton composites. Frontiers in Physics. 10, 1055441 (2022).
- Zeiss Lightsheet 7. Light-Sheet Multiview Imaging of Living and Cleared Specimens. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lightsheet-7.html (2023)
- Zeiss Lattice Lightsheet 7. Long-Term Volumetric Imaging of Living Cells. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lattice-lightsheet-7.html (2023)
- Kumar, M., Kishore, S., McLean, D. L., Kozorovitskiy, Y. Crossbill: An open access single objective light-sheet microscopy platform. bioRxiv. , (2021).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: A tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Pitrone, P. G., et al. OpenSPIM: An open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Single Objective Light Sheet Microscope (SOLS) Guide. Sheung Lab Available from: https://sites.google.com/view/sheunglab/microscopy/single-objective-light-microscope-sols (2023)
- Lamb, J. R., Ward, E. N., Kaminski, C. F. Open-source software package for on-the-fly deskewing and live viewing of volumetric lightsheet microscopy data. Biomedical Optics Express. 14 (2), 834-845 (2023).
- . Harvard University. Mitchison Lab Available from: https://mitchison.hms.harvard.edu/home (2023)
- Watkins, S. C., St. Croix, C. M. Light sheet imaging comes of age. Journal of Cell Biology. 217 (5), 1567-1569 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Berezney, J., Goode, B. L., Fraden, S., Dogic, Z. Extensile to contractile transition in active microtubule-actin composites generates layered asters with programmable lifetimes. Proceedings of the National Academy of Sciences of the United States of America. 119 (5), e2115895119 (2022).
- Kim, K., et al. Isomorphic coalescence of aster cores formed in vitro from microtubules and kinesin motors. Physical Biology. 13 (5), 056002 (2016).
- Millett-Sikking, A., et al. . High NA single-objective lightsheet. , (2019).
- Bourgenot, C., Saunter, C. D., Taylor, J. M., Girkin, J. M., Love, G. D. 3D adaptive optics in a light sheet microscope. Optics Express. 20 (12), 13252-13261 (2012).
- Bernardello, M., Gualda, E. J., Loza-Alvarez, P. Modular multimodal platform for classical and high throughput light sheet microscopy. Scientific Reports. 12 (1), 1969 (2022).
- Crombez, S., Leclerc, P., Ray, C., Ducros, N. Computational hyperspectral light-sheet microscopy. Optics Express. 30 (4), 4856-4866 (2022).

