Chimeric Antigen Receptor T-cellefremstilling på en automatiseret celleprocessor
Summary
Denne artikel beskriver fremstillingsprocessen for kimære antigenreceptor T-celler til klinisk brug, specifikt ved hjælp af en automatiseret celleprocessor, der er i stand til at udføre viral transduktion og dyrkning af T-celler. Vi giver anbefalinger og beskriver faldgruber, der bør overvejes under procesudvikling og implementering af et tidligt fase klinisk forsøg.
Abstract
Chimeric antigen receptor (CAR)-T-celler repræsenterer en lovende immunterapeutisk tilgang til behandling af forskellige maligne og ikke-maligne sygdomme. CAR-T-celler er genetisk modificerede T-celler, der udtrykker et kimært protein, der genkender og binder til et celleoverflademål, hvilket resulterer i drab på målcellen. Traditionelle CAR-T-cellefremstillingsmetoder er arbejdskrævende, dyre og kan medføre risiko for kontaminering. CliniMACS Prodigy, en automatiseret celleprocessor, giver mulighed for at fremstille celleterapiprodukter i klinisk skala i et lukket system, hvilket minimerer risikoen for kontaminering. Behandling sker halvautomatisk under kontrol af en computer og minimerer dermed menneskelig involvering i processen, hvilket sparer tid og reducerer variabilitet og fejl.
Dette manuskript og video beskriver T-celletransduktionsprocessen (TCT) til fremstilling af CAR-T-celler ved hjælp af denne processor. TCT-processen involverer CD4 + / CD8 + T-celleberigelse, aktivering, transduktion med en viral vektor, ekspansion og høst. Ved hjælp af aktivitetsmatrixen, en funktionalitet, der tillader bestilling og timing af disse trin, kan TCT-processen tilpasses i vid udstrækning. Vi leverer en gennemgang af CAR-T-cellefremstilling i overensstemmelse med gældende god fremstillingspraksis (cGMP) og diskuterer påkrævet frigivelsestest og prækliniske eksperimenter, der understøtter en Investigational New Drug (IND) applikation. Vi demonstrerer gennemførligheden og diskuterer fordele og ulemper ved at bruge en halvautomatisk proces til klinisk CAR-T-cellefremstilling. Endelig beskriver vi et igangværende investigator-initieret klinisk forsøg, der er målrettet pædiatriske B-cellemaligniteter [NCT05480449] som et eksempel på, hvordan denne fremstillingsproces kan anvendes i en klinisk indstilling.
Introduction
Adoptiv overførsel af T-celler konstrueret til at udtrykke en kimær antigenreceptor (CAR) har vist bemærkelsesværdig effekt til behandling af patienter med ildfaste B-cellemaligniteter 1,2,3,4,5. De traditionelle fremstillingsmetoder til CAR-T-celler er imidlertid arbejdskrævende, tidskrævende og kræver højtuddannede teknikere til at udføre højt specialiserede trin. For eksempel involverer den traditionelle fremstillingsproces af et autologt CAR-T-celleprodukt densitetsgradientcentrifugering, elutriering eller magnetisk adskillelse for at berige T-celler, aktivering og transduktion med en viral vektor i en steril kolbe og ekspansion i en bioreaktor inden høst og formulering. Forskellige systemer er dukket op for nylig, der sigter mod delvist at automatisere denne proces. For eksempel er Miltenyi CliniMACS Prodigy (i det følgende benævnt “processoren”) en automatiseret cellebehandlingsenhed, der kan udføre mange af disse trin på en automatiseret måde 6,7,8,9. En indgående diskussion af traditionelle og automatiserede CAR-T-fremstillingsmetoder præsenteres i en nylig revisionsartikel10.
Processoren bygger på funktionaliteten af CliniMACS Plus, en amerikansk Food and Drug Administration (FDA) -godkendt medicinsk enhed til behandling af hæmatopoietiske stamceller. Processoren inkluderer en celledyrkningsenhed, der muliggør automatiseret vask, fraktionering og dyrkning af celler (figur 1). T-celletransduktionsprocessen (TCT) er et forudindstillet program i processorenheden, der stort set replikerer manuel CAR-T-cellefremstilling. TCT giver mulighed for tilpasselig cellebehandling ved hjælp af en grafisk brugergrænseflade (“Activity Matrix”, figur 2). Da processoren automatiserer mange trin og konsoliderer funktionaliteten af flere enheder i én maskine, kræver den mindre træning og specialiserede fejlfindingsfærdigheder fra teknologer. Da alle trin udføres i et lukket engangsslangesæt, kan processoren anvendes i faciliteter med mindre streng luftbehandlingsinfrastruktur, end det ville blive anset for acceptabelt for en åben fremstillingsproces. For eksempel driver vi processoren i et anlæg, der er certificeret som ISO-klasse 8 (sammenlignelig med EU-klasse C).
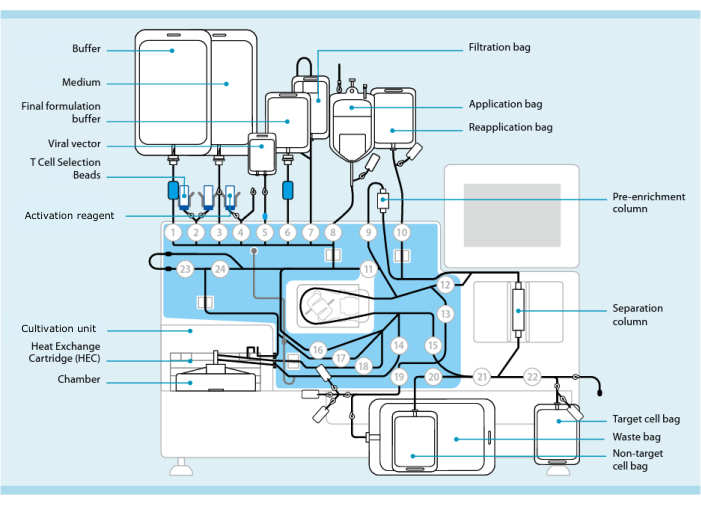
Figur 1: CAR-T-cellefremstilling ved hjælp af T-celletransduktionssystemet. Vist er processoren med slangesættet installeret. Slangesættet giver mulighed for at forbinde andre komponenter såsom poser, der indeholder behandlingsbuffer, dyrkningsmedium og lentiviral vektor via steril svejsning. Når leukafereseproduktet er føjet til applikationsposen, kan det mærkes med T-cellevalgsperler, føres gennem separationskolonnen og derefter overføres til genapplikationsposen. Udvalgte celler dirigeres derefter til dyrkningsenheden i kulturinstrumentet og aktiveres med aktiveringsreagenset (se materialetabel). Det endelige produkt samles i målcelleposen. Under hele processen er det muligt at fjerne prøver til kvalitetskontrol aseptisk. Grå tal inde i cirkler repræsenterer de nummererede ventiler på processoren, der leder væskevejen gennem slangesættet. Gengivet med tilladelse fra 11. Klik her for at se en større version af denne figur.
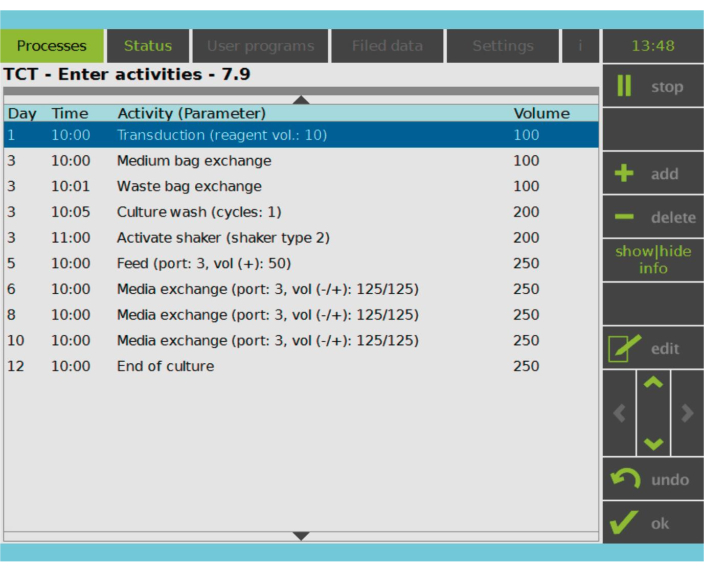
Figur 2: Aktivitetsmatrix. Efter valg og aktivering af T-celler kan resten af CAR-T-cellefremstillingsprocessen tilpasses fuldt ud. Aktiviteter kan tilføjes eller slettes og planlægges til den relevante dag og det relevante tidspunkt, og kulturvolumen efter aktiviteten kan angives (Volumen). Transduktionsaktiviteten blev f.eks. konfigureret til at begynde kl. 10:00 på dag 1, og kulturvolumenet ved aktivitetens afslutning blev indstillet til 100 ml. Aktivitetsmatrixen kan redigeres i hele dyrkningsperioden. Status for processen kan overvåges på behandlingsenhedens integrerede skærm. Klik her for at se en større version af denne figur.
Formålet med dette manuskript er at give en detaljeret gennemgang af fremstillingen af CAR-T-celler ved hjælp af processoren og desuden give vejledning om den test under processen og produktfrigivelse, der sandsynligvis vil blive krævet af tilsynsmyndigheder for at godkende en forsøgsansøgning om nyt lægemiddel (IND). Den præsenterede protokol holder sig tæt på leverandørens anbefalede tilgang og er den underliggende protokol for IND 28617, som i øjeblikket evalueres i et enkeltcenter-investigator-initieret fase I/II klinisk forsøg. Dette forsøg har til formål at bestemme sikkerheden og effektiviteten ved at bruge denne processor til fremstilling af humaniserede CD19-rettede autologe CAR-T-celler til patienter med B-celle akut lymfoblastær leukæmi (B-ALL) eller B-afstamning lymfoblastisk lymfom (B-Lly) [NCT05480449]. Forsøget startede i september 2022 og er planlagt til at rekruttere op til 89 patienter i alderen 0-29 år med B-ALL eller B-Lly. Vi rapporterer nogle fremstillingsresultater fra forsøget i manuskriptet.
Vi vil gerne påpege, at selvom manuskriptet præsenteres som en protokol med trin, der skal følges, bør det betragtes som et udgangspunkt for andre at begynde at optimere deres egen CAR-T-cellefremstillingsproces. En ikke-udtømmende liste over mulige variationer af den præsenterede protokol omfatter: anvendelse af friske i stedet for kryopræserverede T-celler som udgangsmateriale; ved hjælp af en anden metode til T-celleberigelse eller udeladelse af det helt; ved hjælp af forskellige medier og cytokincocktails såsom IL7 / IL15 i stedet for IL2; ændre koncentrationen af humant AB-serum eller helt udelade den tidspunkt for transduktion ved hjælp af “multi-hit” transduktioner; varierende agitation, dyrkningsmængder og fodringsplan; anvendelse af forskellige metoder til genetisk overførsel, herunder elektroporation af nukleinsyrer eller ikke-lentivirale vektorer anvendelse af en anden buffer og/eller kryoprotektormiddel til slutformulering og infundere CAR-T-celler friske i stedet for kryokonservering til infusion på et senere tidspunkt. Disse variationer kan have en betydelig indvirkning på det terapeutiske produkts cellulære sammensætning og styrke.
| Samlet procestrin | Proces dag | Tekniske detaljer | |||
| Berigelse af celler | Dag 0 | Markering af CD4+/CD8+ T-celler | |||
| Celle aktivering | T-cellekultur såning og aktivering | ||||
| Celletransduktion | Dag 1 | Lentiviral transduktion (100 ml kulturvolumen) | |||
| Celleudvidelse (efterfulgt af celleformulering) | Dag 2 | — | |||
| Dag 3 | Kulturvask (1 cyklus); Shaker aktiveret; Kulturvolumen stiger til 200 ml | ||||
| Dag 4 | — | ||||
| Dag 5 | foder (50 ml); Kulturvolumen når slutvolumen på 250 ml | ||||
| Dag 6 | Prøve under fremstilling; Medieudveksling (-125 ml / +125 ml) | ||||
| Dag 7 | Medieudveksling (-150 ml / +150 ml) eller høst | ||||
| Dag 8 | Prøve under fremstilling; Medieudveksling (-150 ml / +150 ml) eller høst | ||||
| Dag 9 | Medieudveksling (-180 ml / +180 ml) eller høst | ||||
| Dag 10 | Prøve under fremstilling; Medieudveksling (-180 ml / +180 ml) eller høst | ||||
| Dag 11 | Medieudveksling (-180 ml / +180 ml) eller høst | ||||
| Dag 12 | Medieudveksling (-180 ml / +180 ml) eller høst | ||||
| Dag 13 | Høst | ||||
Tabel 1: Procestidslinje og oversigt. Denne tabel opsummerer TCT-procestrinnene, der anvendes i et aktuelt klinisk forsøg [NCT05480449]. Processen starter med T-celleberigelse ved CD4+/CD8+ udvælgelse, kultursåning og aktivering på dag 0 efterfulgt af transduktion på dag 1. Celler hviler i 48 timer efterfulgt af en kulturvask, en stigning i kulturvolumenet til 200 ml og omrøring ved hjælp af en rystemekanisme. På dag 6 udtages den første procesprøve. Celler høstes, når der er tilstrækkelige celler til rådighed til mindst tre fulde doser CAR-T-celler (5 × 10 6 CAR-T-celler / kg, hvis patienten er <50 kg, ellers 2,5 × 108 CAR-T-celler) og kvalitetskontroltest (~ 2 × 106 CAR-T-celler); eller når kulturen når i alt 4-5 x 109 celler. Forkortelser: TCT = T-celletransduktion; CAR-T = kimære antigenreceptor T-celler; MACS = magnetisk aktiveret cellesortering.
Protocol
Representative Results
Discussion
CAR-T-celleterapi har vist sig at være en lovende behandlingsmetode for B-celle og andre maligniteter. Imidlertid har traditionelle CAR-T-cellefremstillingsmetoder flere begrænsninger, såsom høje omkostninger, arbejdskrævende produktion og åbne trin, der øger risikoen for kontaminering. For nylig er flere halvautomatiske platforme, herunder Miltenyi CliniMACS Prodigy (“processoren”), dukket op for at løse disse begrænsninger. T-celletransduktionsprocessen (TCT), integreret i processoren beskrevet i dette manuskr…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne vil gerne anerkende bidragene fra flere enkeltpersoner og organisationer til dette arbejde. Cell and Gene Therapy Laboratory og Penn Translational and Correlative Studies Laboratory ydede værdifuld hjælp til procesudvikling og forberedelse til IND-indsendelser. Melissa Varghese og Amanda DiNofia bidrog til procesudviklingen og forberedelsen af IND-indlæg, der ligger til grund for dette manuskript. Dette arbejde blev støttet af et accelerationstilskud fra Cell and Gene Therapy Collaborative of the Children’s Hospital of Philadelphia. Forfatterne vil også gerne takke Miltenyi Biotec for deres tekniske og forskningsmæssige støtte. Figur 1 er omfattet af copyright © 2023 Miltenyi Biotec B.V. & Co. KG; Alle rettigheder forbeholdes.
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

