Fabrication de lymphocytes T à récepteur antigénique chimérique sur un processeur cellulaire automatisé
Summary
Cet article détaille le processus de fabrication des lymphocytes T à récepteurs antigéniques chimériques à usage clinique, en particulier à l’aide d’un processeur cellulaire automatisé capable d’effectuer la transduction virale et la culture de lymphocytes T. Nous formulons des recommandations et décrivons les pièges à éviter qui doivent être pris en compte lors de l’élaboration du processus et de la mise en œuvre d’un essai clinique de phase précoce.
Abstract
Les cellules T à récepteurs antigéniques chimériques (CAR)-T représentent une approche immunothérapeutique prometteuse pour le traitement de diverses maladies malignes et non malignes. Les cellules CAR-T sont des cellules T génétiquement modifiées qui expriment une protéine chimérique qui reconnaît et se lie à une cible de surface cellulaire, entraînant la destruction de la cellule cible. Les méthodes traditionnelles de fabrication des cellules CAR-T sont à forte intensité de main-d’œuvre, coûteuses et peuvent comporter un risque de contamination. Le CliniMACS Prodigy, un processeur cellulaire automatisé, permet de fabriquer des produits de thérapie cellulaire à l’échelle clinique dans un système fermé, minimisant ainsi le risque de contamination. Le traitement s’effectue de manière semi-automatique sous le contrôle d’un ordinateur et minimise ainsi l’implication humaine dans le processus, ce qui permet de gagner du temps et de réduire la variabilité et les erreurs.
Ce manuscrit et cette vidéo décrivent le processus de transduction des cellules T (TCT) pour la fabrication de cellules CAR-T à l’aide de ce processeur. Le processus TCT implique l’enrichissement des lymphocytes T CD4+/CD8+, l’activation, la transduction avec un vecteur viral, l’expansion et la récolte. À l’aide de la matrice d’activité, une fonctionnalité qui permet d’ordonner et de chronométrer ces étapes, le processus TCT peut être largement personnalisé. Nous fournissons une présentation de la fabrication des cellules CAR-T conformément aux bonnes pratiques de fabrication (BPF) actuelles et discutons des tests de libération requis et des expériences précliniques qui soutiendront une demande de nouveau médicament expérimental (IND). Nous démontrons la faisabilité et discutons des avantages et des inconvénients de l’utilisation d’un processus semi-automatique pour la fabrication clinique de cellules CAR-T. Enfin, nous décrivons un essai clinique en cours initié par un chercheur qui cible les tumeurs malignes à cellules B pédiatriques [NCT05480449] comme un exemple de la façon dont ce processus de fabrication peut être appliqué dans un cadre clinique.
Introduction
Le transfert adoptif de lymphocytes T modifiés pour exprimer un récepteur antigénique chimérique (CAR) a montré une efficacité remarquable dans le traitement des patients atteints de tumeurs malignes à cellules B réfractaires 1,2,3,4,5. Cependant, les méthodes traditionnelles de fabrication des cellules CAR-T sont à forte intensité de main-d’œuvre, prennent beaucoup de temps et nécessitent des techniciens hautement qualifiés pour effectuer des étapes hautement spécialisées. Par exemple, le processus de fabrication traditionnel d’un produit cellulaire CAR-T autologue implique la centrifugation par gradient de densité, l’élutriation ou la séparation magnétique pour enrichir les lymphocytes T, l’activation et la transduction avec un vecteur viral dans un flacon stérile, et l’expansion dans un bioréacteur avant la récolte et la formulation. Divers systèmes ont vu le jour récemment dans le but d’automatiser partiellement ce processus. Par exemple, le Miltenyi CliniMACS Prodigy (ci-après dénommé le « processeur ») est un dispositif de traitement cellulaire automatisé qui peut effectuer un grand nombre de ces étapes de manière automatisée 6,7,8,9. Une discussion approfondie des méthodes de fabrication CAR-T traditionnelles et automatisées est présentée dans un récent article de synthèse10.
Le processeur s’appuie sur les fonctionnalités du CliniMACS Plus, un dispositif médical approuvé par la Food and Drug Administration (FDA) des États-Unis pour le traitement des cellules progénitrices hématopoïétiques. Le processeur comprend une unité de culture cellulaire qui permet le lavage, le fractionnement et la culture automatisés des cellules (Figure 1). Le processus de transduction des cellules T (TCT) est un programme prédéfini dans le dispositif du processeur qui reproduit en grande partie la fabrication manuelle des cellules CAR-T. TCT permet un traitement personnalisable des cellules à l’aide d’une interface utilisateur graphique (la « matrice d’activité », Figure 2). Étant donné que le processeur automatise de nombreuses étapes et consolide les fonctionnalités de plusieurs appareils en une seule machine, il nécessite moins de formation et de compétences de dépannage spécialisées de la part des technologues. Étant donné que toutes les étapes sont effectuées à l’intérieur d’un ensemble de tubes fermés à usage unique, le processeur peut être utilisé dans des installations dotées d’une infrastructure de traitement de l’air moins stricte que celle qui serait considérée comme acceptable pour un processus de fabrication ouvert. Par exemple, nous exploitons le transformateur dans une installation certifiée ISO classe 8 (comparable à la classe C de l’UE).
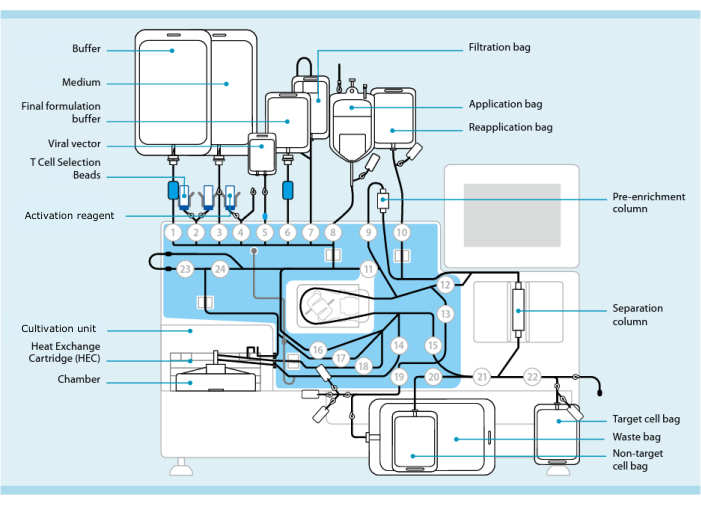
Figure 1 : Fabrication de cellules CAR-T à l’aide du système de transduction des cellules T. L’illustration montre le processeur avec le jeu de tubes installé. L’ensemble de tubes permet de connecter d’autres composants tels que des sacs contenant un tampon de traitement, un milieu de culture et un vecteur lentiviral par soudage stérile. Une fois que le produit de leucaphérèse est ajouté au sac d’application, il peut être étiqueté avec des billes de sélection de lymphocytes T, passé à travers la colonne de séparation, puis transféré dans le sac de réapplication. Les cellules sélectionnées sont ensuite dirigées vers l’unité de culture de l’instrument pour la culture et activées avec le réactif d’activation (voir le tableau des matériaux). Le produit final est collecté dans le sac de cellules cibles. Tout au long du processus, il est possible de prélever des échantillons pour le contrôle de la qualité de manière aseptique. Les chiffres gris à l’intérieur des cercles représentent les vannes numérotées du processeur qui dirigent le chemin du liquide à travers le jeu de tubes. Reproduit avec la permission de 11. Veuillez cliquer ici pour voir une version agrandie de cette figure.
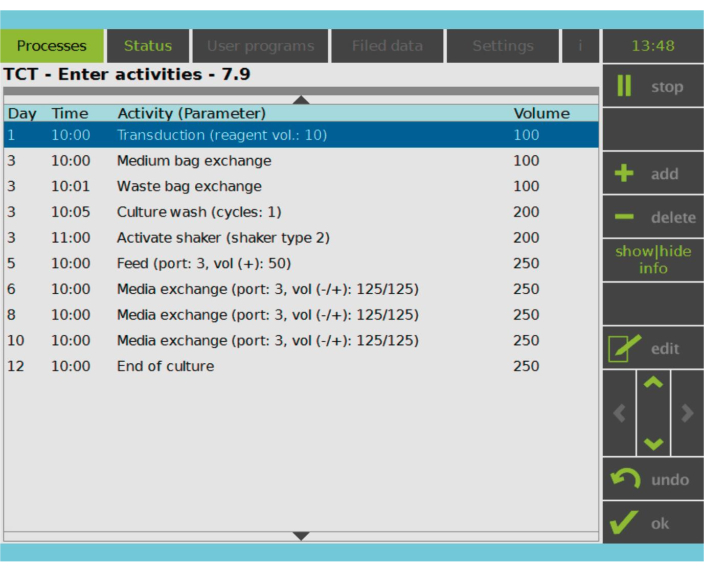
Figure 2 : Matrice d’activité. Après la sélection et l’activation des cellules T, le reste du processus de fabrication des cellules CAR-T est entièrement personnalisable. Les activités peuvent être ajoutées ou supprimées et programmées pour le jour et l’heure appropriés, et le volume de culture après l’activité peut être spécifié (Volume). Par exemple, l’activité de transduction a été configurée pour commencer à 10h00 le jour 1 et le volume de culture à la fin de l’activité a été défini sur 100 ml. La matrice d’activité peut être modifiée tout au long de la période de culture. L’état du processus peut être surveillé sur l’écran intégré de l’appareil de traitement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’objectif de ce manuscrit est de fournir un aperçu détaillé de la fabrication des cellules CAR-T à l’aide du processeur et de fournir des conseils sur les tests en cours de fabrication et de libération du produit qui seront probablement requis par les organismes de réglementation pour approuver une demande de nouveau médicament expérimental (IND). Le protocole présenté reste proche de l’approche recommandée par le fournisseur et constitue le protocole sous-jacent de l’IND 28617, qui est actuellement en cours d’évaluation dans le cadre d’un essai clinique de phase I/II initié par un investigateur monocentrique. Cet essai vise à déterminer l’innocuité et l’efficacité de l’utilisation de ce processeur pour fabriquer des cellules CAR-T autologues humanisées dirigées contre CD19 pour les patients atteints de leucémie aiguë lymphoblastique à cellules B (LAL B) ou de lymphome lymphoblastique de lignée B (B-LLY) [NCT05480449]. L’essai a débuté en septembre 2022 et devrait recruter jusqu’à 89 patients âgés de 0 à 29 ans atteints de B-ALL ou de B-Lly. Nous rapportons quelques résultats de fabrication de l’essai dans le manuscrit.
Nous tenons à souligner que, bien que le manuscrit soit présenté comme un protocole avec des étapes à suivre, il devrait être considéré comme un point de départ pour que d’autres commencent à optimiser leur propre processus de fabrication de cellules CAR-T. Une liste non exhaustive des variations possibles du protocole présenté comprend : l’utilisation de lymphocytes T frais au lieu de lymphocytes T cryoconservés comme matériau de départ ; l’utilisation d’une méthode différente d’enrichissement des lymphocytes T ou son omission totale ; l’utilisation de différents milieux et cocktails de cytokines tels que l’IL7/IL15 au lieu de l’IL2 ; faire varier la concentration de sérum AB humain ou l’omettre complètement ; le moment de la transduction ; l’utilisation de transductions « multi-hits » ; variation de l’agitation, des volumes de culture et du calendrier d’alimentation ; l’utilisation de différentes méthodes de transfert génétique, y compris l’électroporation d’acides nucléiques ou de vecteurs non lentiviraux ; l’utilisation d’un tampon de formulation finale et/ou d’un cryoprotecteur différent ; et l’infusion de cellules CAR-T fraîches au lieu d’être cryoconservées pour une perfusion ultérieure. Ces variations peuvent avoir un impact significatif sur la composition cellulaire et la puissance du produit thérapeutique.
| Étape globale du processus | Journée du processus | Détails techniques | |||
| Enrichissement cellulaire | Jour 0 | Sélection des lymphocytes T CD4+/CD8+ | |||
| Activation cellulaire | Ensemencement et activation de la culture des lymphocytes T | ||||
| Transduction cellulaire | Jour 1 | Transduction lentivirale (volume de culture de 100 ml) | |||
| Expansion cellulaire (suivie de la formulation cellulaire) | Jour 2 | — | |||
| Jour 3 | Lavage de culture (1 cycle) ; Agitateur activé ; Le volume de culture augmente jusqu’à 200 mL | ||||
| Jour 4 | — | ||||
| Jour 5 | Aliment (50 ml) ; Le volume de culture atteint le volume final de 250 mL | ||||
| Jour 6 | Échantillon en cours de fabrication ; Échange de médias (-125 mL / +125 mL) | ||||
| Jour 7 | Échange de milieux (-150 mL / +150 mL) ou Harvest | ||||
| Jour 8 | Échantillon en cours de fabrication ; Échange de milieux (-150 mL / +150 mL) ou Harvest | ||||
| Jour 9 | Échange de milieux (-180 mL / +180 mL) ou Harvest | ||||
| Jour 10 | Échantillon en cours de fabrication ; Échange de milieux (-180 mL / +180 mL) ou Harvest | ||||
| Jour 11 | Échange de milieux (-180 mL / +180 mL) ou Harvest | ||||
| Jour 12 | Échange de milieux (-180 mL / +180 mL) ou Harvest | ||||
| Jour 13 | Récolter | ||||
Tableau 1 : Chronologie et aperçu du processus. Ce tableau résume les étapes du processus TCT utilisées dans un essai clinique en cours [NCT05480449]. Le processus commence par l’enrichissement des lymphocytes T par la sélection des CD4+/CD8+, l’ensemencement de la culture et l’activation le jour 0, suivi de la transduction le jour 1. Les cellules se reposent pendant 48 h, suivies d’un lavage de culture, d’une augmentation du volume de culture à 200 ml et d’une agitation à l’aide d’un mécanisme d’agitation. Le jour 6, le premier échantillon en cours de fabrication est prélevé. Les cellules sont prélevées une fois qu’il y a suffisamment de cellules disponibles pour au moins trois doses complètes de cellules CAR-T (5 × 10 6 cellules CAR-T/kg si le patient pèse <50 kg, sinon 2,5 × 108 cellules CAR-T) et des tests de contrôle de la qualité (~2 × 106 cellules CAR-T) ; ou une fois que la culture atteint un total de 4-5 x 109 cellules. Abréviations : TCT = transduction des lymphocytes T ; CAR-T = lymphocytes T récepteurs de l’antigène chimérique ; MACS = tri cellulaire activé par magnétisme.
Protocol
Representative Results
Discussion
La thérapie cellulaire CAR-T est apparue comme une approche thérapeutique prometteuse pour les cellules B et d’autres tumeurs malignes. Cependant, les méthodes traditionnelles de fabrication des cellules CAR-T présentent plusieurs limites, telles qu’un coût élevé, une production à forte intensité de main-d’œuvre et des étapes ouvertes qui augmentent le risque de contamination. Récemment, plusieurs plates-formes semi-automatisées, dont Miltenyi CliniMACS Prodigy (le « processeur »), ont vu le jour pou…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Les auteurs tiennent à souligner la contribution de plusieurs personnes et organisations à ce travail. Le laboratoire de thérapie cellulaire et génique et le laboratoire d’études translationnelles et corrélatives de Pennsylvanie ont fourni une aide précieuse pour le développement de processus et la préparation des demandes d’IND. Melissa Varghese et Amanda DiNofia ont contribué à l’élaboration du processus et à la préparation des soumissions d’IND qui sous-tendent ce manuscrit. Ce travail a été soutenu par une subvention d’accélération du Cell and Gene Therapy Collaborative de l’hôpital pour enfants de Philadelphie. Les auteurs tiennent également à remercier Miltenyi Biotec pour son soutien technique et de recherche. La figure 1 est couverte par le droit d’auteur © 2023 Miltenyi Biotec B.V. & Co. KG ; Tous droits réservés.
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

