Fabricação de células T do receptor de antígeno quimérico em um processador de células automatizado
Summary
Este artigo detalha o processo de fabricação de células T do receptor de antígeno quimérico para uso clínico, especificamente usando um processador de células automatizado capaz de realizar transdução viral e cultivo de células T. Fornecemos recomendações e descrevemos armadilhas que devem ser consideradas durante o processo de desenvolvimento e implementação de um ensaio clínico de fase inicial.
Abstract
As células T do receptor de antígeno quimérico (CAR) representam uma abordagem imunoterapêutica promissora para o tratamento de várias doenças malignas e não malignas. As células CAR-T são células T geneticamente modificadas que expressam uma proteína quimérica que reconhece e se liga a um alvo de superfície celular, resultando na morte da célula-alvo. Os métodos tradicionais de fabricação de células CAR-T são trabalhosos, caros e podem trazer o risco de contaminação. O CliniMACS Prodigy, um processador de células automatizado, permite a fabricação de produtos de terapia celular em escala clínica em um sistema fechado, minimizando o risco de contaminação. O processamento ocorre de forma semiautomática sob o controle de um computador e, assim, minimiza o envolvimento humano no processo, o que economiza tempo e reduz a variabilidade e os erros.
Este manuscrito e vídeo descrevem o processo de transdução de células T (TCT) para a fabricação de células CAR-T usando este processador. O processo de TCT envolve enriquecimento, ativação, transdução de células T CD4+/CD8+ com vetor viral, expansão e colheita. Usando a Matriz de Atividades, uma funcionalidade que permite ordenar e cronometrar essas etapas, o processo de TCT pode ser personalizado extensivamente. Fornecemos um passo a passo da fabricação de células CAR-T em conformidade com as Boas Práticas de Fabricação atuais (cGMP) e discutimos os testes de liberação necessários e os experimentos pré-clínicos que darão suporte a uma aplicação de Novo Medicamento Investigacional (IND). Demonstramos a viabilidade e discutimos as vantagens e desvantagens do uso de um processo semiautomático para a fabricação clínica de células CAR-T. Finalmente, descrevemos um ensaio clínico em andamento iniciado por pesquisadores que tem como alvo malignidades pediátricas de células B [NCT05480449] como um exemplo de como esse processo de fabricação pode ser aplicado em um ambiente clínico.
Introduction
A transferência adotiva de células T projetadas para expressar um receptor de antígeno quimérico (CAR) tem demonstrado notável eficácia no tratamento de pacientes com neoplasias malignas refratárias de células B 1,2,3,4,5. No entanto, os métodos tradicionais de fabricação de células CAR-T são trabalhosos, demorados e exigem técnicos altamente treinados para realizar etapas altamente especializadas. Por exemplo, o processo tradicional de fabricação de um produto autólogo de células CAR-T envolve centrifugação por gradiente de densidade, elutriação ou separação magnética para enriquecer células T, ativação e transdução com um vetor viral em um frasco estéril e expansão em um biorreator antes da colheita e formulação. Vários sistemas têm surgido recentemente que visam automatizar parcialmente esse processo. Por exemplo, o Miltenyi CliniMACS Prodigy (doravante denominado “processador”) é um dispositivo de processamento celular automatizado que pode executar muitas dessas etapas de forma automatizada 6,7,8,9. Uma discussão aprofundada dos métodos de fabricação CAR-T tradicionais e automatizados é apresentada em um artigo de revisão recente10.
O processador se baseia na funcionalidade do CliniMACS Plus, um dispositivo médico aprovado pela Food and Drug Administration (FDA) dos EUA para o processamento de células progenitoras hematopoiéticas. O processador inclui uma unidade de cultivo de células que permite a lavagem, o fracionamento e o cultivo automatizados de células (Figura 1). O processo de transdução de células T (TCT) é um programa predefinido dentro do dispositivo do processador que replica amplamente a fabricação manual de células CAR-T. O TCT permite o processamento de células personalizáveis usando uma interface gráfica do usuário (a “Matriz de Atividade”, Figura 2). Como o processador automatiza muitas etapas e consolida a funcionalidade de vários dispositivos em uma máquina, ele exige menos treinamento e habilidades especializadas de solução de problemas dos tecnólogos. Como todas as etapas são executadas dentro de um conjunto de tubos fechados e de uso único, o processador pode ser operado em instalações com infraestrutura de tratamento de ar menos rigorosa do que seria considerado aceitável para um processo de fabricação aberto. Por exemplo, estamos operando o processador em uma instalação certificada como classe ISO 8 (comparável à classe C da UE).
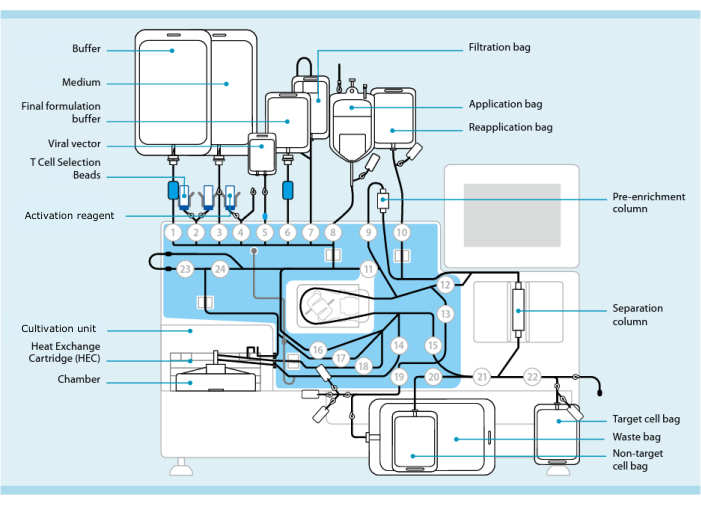
Figura 1: Fabricação de células CAR-T utilizando o sistema de transdução de células T. Mostrado é o processador com o conjunto de tubos instalado. O conjunto de tubos permite conectar outros componentes, como sacos contendo tampão de processamento, meio de cultura e vetor lentiviral via soldagem estéril. Uma vez que o produto de leucaferese é adicionado ao saco de aplicação, ele pode ser rotulado com contas de seleção de células T, passado através da coluna de separação e, em seguida, transferido para o saco de reaplicação. As células selecionadas são então direcionadas para a unidade de cultivo do instrumento para cultura e ativadas com o reagente de ativação (ver Tabela de Materiais). O produto final é coletado no saco de célula alvo. Durante todo o processo, é possível retirar amostras para controle de qualidade de forma asséptica. Números cinzas dentro de círculos representam as válvulas numeradas no processador que direcionam o caminho do líquido através do conjunto de tubos. Reproduzido com permissão de 11. Clique aqui para ver uma versão maior desta figura.
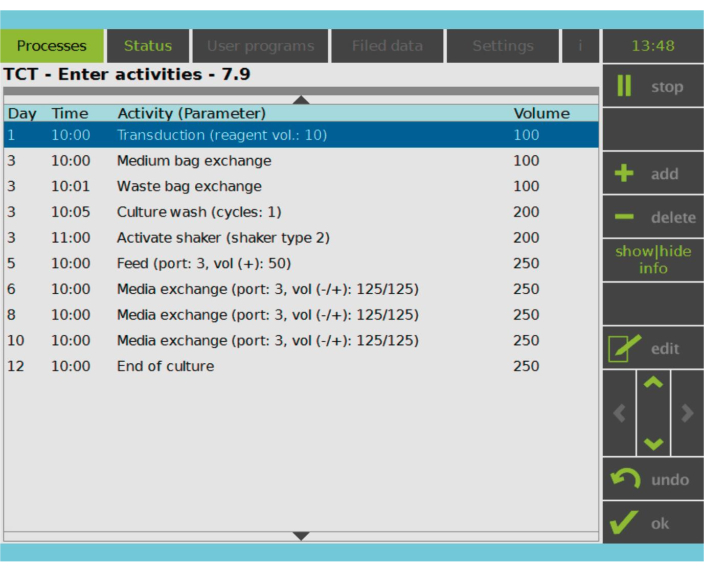
Figura 2: Matriz de atividades. Após a seleção e ativação da célula T, o restante do processo de fabricação da célula CAR-T é totalmente personalizável. As atividades podem ser adicionadas ou excluídas e agendadas para o dia e hora apropriados, e o volume de cultura após a atividade pode ser especificado (Volume). Por exemplo, a atividade de transdução foi configurada para começar às 10:00 AM no Dia 1, e o volume de cultura no final da atividade foi definido como 100 mL. A Matriz de Atividades pode ser editada durante todo o período de cultivo. O status do processo pode ser monitorado na tela integrada do dispositivo de processamento. Clique aqui para ver uma versão maior desta figura.
O objetivo deste manuscrito é fornecer um passo a passo detalhado da fabricação de células CAR-T usando o processador e, adicionalmente, fornecer orientação sobre os testes em processo e de liberação do produto que provavelmente serão exigidos pelos reguladores para aprovar uma aplicação experimental de novo medicamento (IND). O protocolo apresentado permanece próximo da abordagem recomendada pelo fornecedor e é o protocolo subjacente para o IND 28617, que está atualmente sendo avaliado em um ensaio clínico de fase I/II iniciado por um investigador de um único centro. Este estudo tem como objetivo determinar a segurança e eficácia do uso deste processador na fabricação de células CAR-T autólogas CD19-dirigidas humanizadas para pacientes com leucemia linfoblástica aguda de células B (LLA-B) ou linfoma linfoblástico de linhagem B (L-BLY) [NCT05480449]. O estudo começou em setembro de 2022 e está planejado para inscrever até 89 pacientes com idades entre 0 e 29 anos com LLA-B ou B-Lly. Relatamos alguns resultados de fabricação do ensaio no manuscrito.
Gostaríamos de ressaltar que, embora o manuscrito seja apresentado como um protocolo com etapas a serem seguidas, ele deve ser considerado um ponto de partida para que outros comecem a otimizar seu próprio processo de fabricação de células CAR-T. Uma lista não abrangente de possíveis variações do protocolo apresentado inclui: uso de células T frescas em vez de criopreservadas como material de partida; usar um método diferente de enriquecimento de células T ou omiti-lo completamente; usando diferentes meios e coquetéis de citocinas, como IL7/IL15 em vez de IL2; variar a concentração de soro AB humano ou omiti-la completamente; temporização da transdução; utilizando transduções “multi-hit”; variação da agitação, dos volumes das culturas e do horário de alimentação; utilizando diferentes métodos de transferência genética, incluindo a eletroporação de ácidos nucleicos ou vetores não lentivirais; utilizar outro tampão de formulação final e/ou crioprotetor; e infundir células CAR-T frescas em vez de criopreservando para infusão em um momento posterior. Essas variações podem ter um impacto significativo na composição celular e potência do produto terapêutico.
| Etapa geral do processo | Dia do Processo | Detalhes Técnicos | |||
| Enriquecimento Celular | Dia 0 | Seleção de células T CD4+/CD8+ | |||
| Ativação Celular | Semeadura e ativação de cultura de células T | ||||
| Transdução de células | Dia 1 | Transdução lentiviral (volume de cultura de 100 mL) | |||
| Expansão Celular (seguida de formulação celular) | Dia 2 | — | |||
| Dia 3 | Lavagem de Cultura (1 ciclo); Agitador ativado; Volume de cultura aumenta para 200 mL | ||||
| Dia 4 | — | ||||
| Dia 5 | Ração (50 mL); O volume de cultura atinge o volume final de 250 mL | ||||
| Dia 6 | Amostra em processo; Troca de mídia (-125 mL / +125 mL) | ||||
| Dia 7 | Troca de meios (-150 mL / +150 mL) ou Harvest | ||||
| Dia 8 | Amostra em processo; Troca de meios (-150 mL / +150 mL) ou Harvest | ||||
| Dia 9 | Troca de meios (-180 mL / +180 mL) ou Harvest | ||||
| Dia 10 | Amostra em processo; Troca de meios (-180 mL / +180 mL) ou Harvest | ||||
| Dia 11 | Troca de meios (-180 mL / +180 mL) ou Harvest | ||||
| Dia 12 | Troca de meios (-180 mL / +180 mL) ou Harvest | ||||
| Dia 13 | Colheita | ||||
Tabela 1: Cronograma e visão geral do processo. Esta tabela resume as etapas do processo de TCT empregadas em um ensaio clínico atual [NCT05480449]. O processo inicia-se com o enriquecimento de células T por seleção CD4+/CD8+, semeadura da cultura e ativação no Dia 0, seguido de transdução no Dia 1. As células descansam por 48 h, seguida de lavagem com cultura, aumento do volume de cultura para 200 mL e agitação com mecanismo de agitação. No dia 6, a primeira amostra em processo é coletada. As células são colhidas quando estão disponíveis células suficientes para pelo menos três doses completas de células CAR-T (5 × 10 6 células CAR-T/kg se o paciente tiver <50 kg, caso contrário, 2,5 × 108 células CAR-T) e testes de controle de qualidade (~2 × 106 células CAR-T); ou quando a cultura atinge um total de 4-5 x 109 células. Abreviações: TCT = transdução de células T; CAR-T = células T do receptor de antígeno quimérico; MACS = classificação de células ativadas por magnetismo.
Protocol
Representative Results
Discussion
A terapia com células CAR-T tem emergido como uma abordagem de tratamento promissora para células B e outras neoplasias. No entanto, os métodos tradicionais de fabricação de células CAR-T têm várias limitações, como alto custo, produção intensiva em mão-de-obra e etapas abertas que aumentam o risco de contaminação. Recentemente, várias plataformas semi-automatizadas, incluindo o Miltenyi CliniMACS Prodigy (o “processador”), surgiram para resolver essas limitações. O processo de transdução de células …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Os autores gostariam de agradecer as contribuições de vários indivíduos e organizações para este trabalho. O Laboratório de Terapia Celular e Gênica e o Laboratório de Estudos Translacionais e Correlativos da Penn forneceram assistência valiosa com o desenvolvimento de processos e preparação para submissões de IND. Melissa Varghese e Amanda DiNofia contribuíram para o processo de desenvolvimento e preparação para as submissões de IND que fundamentam este manuscrito. Este trabalho foi apoiado por uma Bolsa de Aceleração da Terapia Celular e Gênica Colaborativa do Hospital Infantil da Filadélfia. Os autores também gostariam de agradecer à Miltenyi Biotec por seu apoio técnico e de pesquisa. A Figura 1 é coberta pelos direitos autorais © 2023 Miltenyi Biotec B.V. & Co. Todos os direitos reservados.
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

