הכנה וצביעה אימונופלואורסצנטית של צרורות ותאי סיבים בודדים מקליפת המוח וגרעין עדשת העין
Summary
פרוטוקול זה מתאר שיטות להכנת תאי סיבי עדשת עין היקפיים, בוגרים וגרעיניים לצביעת אימונופלואורסנציה כדי לחקור אינטרדיגיטציות מורכבות בין תאים ואת ארכיטקטורת הממברנה.
Abstract
העדשה היא איבר שקוף ואליפסואידי בחדר הקדמי של העין שמשנה צורה כדי למקד אור עדין על הרשתית ליצירת תמונה ברורה. חלק הארי של רקמה זו מורכב מתאי סיבים מיוחדים, ממוינים, בעלי חתך משושה ונמשכים מהקוטב הקדמי ועד האחורי של העדשה. תאים ארוכים ורזים אלה מנוגדים מאוד לתאים שכנים ויש להם אינטרדיגיטציות מורכבות לאורך התא. המבנים השלובים המיוחדים נדרשים לתכונות ביומכניות רגילות של העדשה ותוארו בהרחבה באמצעות טכניקות של מיקרוסקופ אלקטרונים. פרוטוקול זה מדגים את השיטה הראשונה לשימור ואימונוסטיין יחיד כמו גם צרורות של תאי סיבי עדשה עכבריים כדי לאפשר לוקליזציה מפורטת של חלבונים בתוך תאים בעלי צורה מורכבת זו. הנתונים המייצגים מראים צביעה של תאי הסיבים ההיקפיים, המתמיינים, הבוגרים והגרעיניים בכל אזורי העדשה. שיטה זו יכולה לשמש באופן פוטנציאלי על תאי סיבים שבודדו מעדשות של מינים אחרים.
Introduction
העדשה היא רקמה שקופה וביצית בחדר הקדמי של העין שמורכבת משני סוגי תאים, תאי אפיתל ותאי סיבים 1 (איור 1). יש monolayer של תאי אפיתל המכסה את ההמיספרה הקדמית של העדשה. תאי סיבים נבדלים מתאי אפיתל ומהווים את עיקר העדשה. תאי הסיבים המתמחים עוברים תהליך התארכות, התמיינות והבשלה, המתבטא בשינויים ברורים במורפולוגיית קרום התא מפריפריית העדשה למרכז העדשה 2,3,4,5,6,7,8,9,10,11,12 ידוע גם בשם גרעין העדשה., תפקידה של העדשה למקד אור עדין המגיע ממרחקים שונים אל הרשתית תלוי בתכונותיה הביומכניות, כולל קשיחות ואלסטיות 13,14,15,16,17,18,19. האינטרדיגיטציות המורכבות של סיבי העדשה הועלו20,21 ולאחרונה הוכחו כחשובות לנוקשות העדשה22,23.
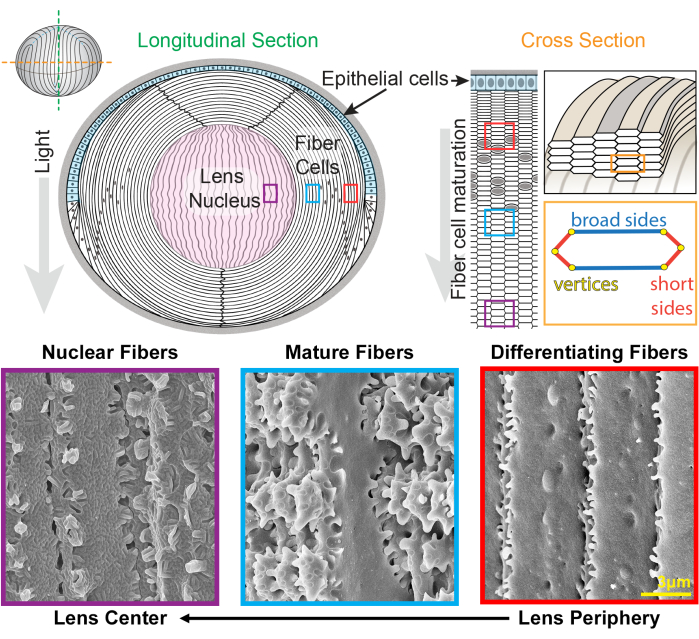
איור 1: דיאגרמות אנטומיה של עדשה ותמונות של מיקרוסקופ אלקטרונים סורק מייצג (SEM) מסיבי עדשה. הקריקטורה מראה מבט אורכי (קדמי עד אחורי מלמעלה למטה) של השכבה הקדמית של תאי אפיתל (מוצללת בתכלת) ומסה גדולה של תאי סיבי עדשה (לבן). מרכז העדשה (מוצלל בוורוד) ידוע כגרעין והוא מורכב מתאי סיבים דחוסים מאוד. מימין, קריקטורה בחתך רוחב חושפת את צורת תא המשושה המוארך של סיבי עדשה הארוזים בתבנית חלת דבש. לתאי סיבים יש שני צדדים רחבים וארבעה צדדים קצרים. תמונות SEM מייצגות לאורך החלק התחתון מראות את האינטרדיגיטציות המורכבות של הממברנה בין תאי סיבי העדשה בעומקים שונים של העדשה. מימין, סיבי עדשה חדשים שנוצרו בשולי העדשה הם בעלי בליטות קטנות לאורך הצדדים הקצרים וכדורים ושקעים לאורך הצד הרחב (קופסאות אדומות). במהלך ההתבגרות, סיבי העדשה מפתחים אזורי משוטים גדולים המעוטרים על ידי בליטות קטנות לאורך הצדדים הקצרים (קופסאות כחולות). תאי סיבים בוגרים הם בעלי תחומי משוט גדולים המודגמים על ידי בליטות קטנות. תחומים שלובים אלה חשובים לתכונות ביומכניות של העדשה. לתאי סיבים בגרעין העדשה יש פחות בליטות קטנות לאורך הצדדים הקצרים שלהם ויש להם אינטרדיגיטציות מורכבות של לשון וחריץ (קופסאות סגולות). הצדדים הרחבים של התא מציגים מורפולוגיה של קרום כדורי. הקריקטורה שונתהמ-22,32 ולא צוירה בקנה מידה. סרגל קנה מידה = 3 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
העדשה גדלה על ידי הוספת קליפות של תאי סיבים חדשים על גבי הדורות הקודמים של סיבים24,25. לתאי סיבים יש צורת חתך משושה מוארכת עם שתי צלעות רחבות וארבע צלעות קצרות. תאים אלה משתרעים מהקוטב הקדמי לקוטב האחורי של העדשה, ובהתאם למין, סיבי העדשה יכולים להיות באורך של כמה מילימטרים. כדי לתמוך במבנה של תאים מוארכים ורזים אלה, אינטרדיגיטציות מיוחדות לאורך הצדדים הרחבים והקצרים יוצרות מבנים שלובים כדי לשמור על צורת העדשה ועל התכונות הביומכניות. שינויים בצורת קרום התא במהלך התמיינות ובגרות תאי סיבים תועדו בהרחבה על ידי מחקרי מיקרוסקופ אלקטרונים (EM) 2,3,4,5,6,7,8,9,10,20,26,27,28,29 . לתאי סיבים שזה עתה נוצרו יש כדורים ושקעים לאורך הצדדים הרחבים שלהם עם בליטות קטנות מאוד לאורך הצדדים הקצרים שלהם, בעוד שלסיבים בוגרים יש בליטות משתלבות ומשוטים לאורך הצדדים הקצרים שלהם. סיבים גרעיניים מציגים אינטרדיגיטציות של לשון וחריץ ומורפולוגיה של קרום כדורי. מעט ידוע על החלבונים הדרושים לממברנות שלובות מורכבות אלה. מחקרים קודמים על לוקליזציה של חלבונים בתאי סיבים הסתמכו על מקטעי רקמת העדשה, שאינם מאפשרים הדמיה ברורה של ארכיטקטורת התא המורכבת.
עבודה זו יצרה ושכללה שיטה חדשנית לקיבוע בודדים וצרורות של תאי סיבי עדשה כדי לשמר את המורפולוגיה המורכבת ולאפשר צביעה חיסונית של חלבונים בקרום התא ובתוך הציטופלסמה. שיטה זו משמרת נאמנה את ארכיטקטורת קרום התא, הדומה לנתונים ממחקרי EM, ומאפשרת צביעה בנוגדנים ראשוניים לחלבונים ספציפיים. בעבר יש לנו סיבי עדשה קורטיקלית חיסונית שעוברים התמיינות והתבגרות22,23. בפרוטוקול זה קיימת גם שיטה חדשה להכתמת תאי סיבים מגרעין העדשה. פרוטוקול זה פותח את הדלת להבנת מנגנוני היווצרות ושינויים באינטרדיגיטציות של ממברנות במהלך הבשלת תאי סיבים ודחיסת גרעין העדשה.
Protocol
Representative Results
Discussion
פרוטוקול זה הדגים את שיטות הקיבוע, השימור והצביעה החיסונית המשמרת נאמנה את המורפולוגיה של הממברנה התלת-ממדית של צרורות או תאי סיבי עדשה בודדים מעומקים שונים בעדשה. סיבי העדשה המוכתמים מושווים לתכשירי SEM המשמשים זה מכבר לחקר המורפולוגיה של תאי סיבי העדשה. התוצאות מראות מבני קרום דומים בין …
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי מענק R01 EY032056 (ל- CC) מהמכון הלאומי לעיניים. המחברים מודים לד”ר תרזה פאסל וקימברלי ונדרפול במתקן סקריפס למיקרוסקופיה על עזרתם בתמונות מיקרוסקופ אלקטרונים.
Materials
| 100% Triton X-100 | FisherScientific | BP151-500 | |
| 60mm plate | FisherScientific | FB0875713A | |
| 16% paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| 10X phosphate buffered saline | ThermoFisher | 70011-044 | |
| 1X phosphate buffered saline | ThermoFisher | 14190136 | |
| 48-well plate | CytoOne | CC7672-7548 | |
| Cover slips (22 x 40 mm) | FisherScientific | 12-553-467 | |
| Curved tweezers | World Precision Instruments | 501981 | |
| Dissection microscope | Carl Zeiss | Stereo Discovery V8 | |
| Fine tip straight tweezers | Electron Microscopy Sciences | 72707-01 | |
| Fisherbrand Superfrost Plus Microscope Slides | FisherScientific | 12-550-15 | |
| LSM 800 confocal microscope with Airyscan (63X) and Zen 3.5 Software | Carl Zeiss | ||
| Nail polish | |||
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| Phalloidin (rhodamine) | ThermoFisher | R415 | |
| Primary antibody | |||
| Scalpel Feather Disposable, steril, No. 11 | VWR | 76241-186 | |
| Secondary antibody | |||
| Straight forceps | World Precision Instruments | 11252-40 | |
| Thermo Scientific Nunc MicroWell MiniTrays (dissection tray) | FisherScientific | 12-565-154 | |
| Ultra-fine scissors | World Precision Instruments | 501778 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | |
| Wheat germ agglutinin (fluorescein) | Vector Laboratories | FL-1021-5 |
References
- Lovicu, F. J., McAvoy, J. W. Growth factor regulation of lens development. 발생학. 280 (1), 1-14 (2005).
- Kuszak, J., Alcala, J., Maisel, H. The surface morphology of embryonic and adult chick lens-fiber cells. The American Journal of Anatomy. 159 (4), 395-410 (1980).
- Kuszak, J. R. The ultrastructure of epithelial and fiber cells in the crystalline lens. International Review of Cytology. 163, 305-350 (1995).
- Kuszak, J. R., Macsai, M. S., Rae, J. L. Stereo scanning electron microscopy of the crystalline lens. Scanning Electron Microscopy. , 1415-1426 (1983).
- Lo, W. K., Harding, C. V. Square arrays and their role in ridge formation in human lens fibers. Journal of Ultrastructure Research. 86 (3), 228-245 (1984).
- Taylor, V. L., et al. Morphology of the normal human lens. Investigative Ophthalmology & Visual Science. 37 (7), 1396-1410 (1996).
- Vrensen, G. F. Aging of the human eye lens-a morphological point of view. Comparative Biochemistry and Physiology. Part A, Physiology. 111 (4), 519-532 (1995).
- Vrensen, G. F., Duindam, H. J. Maturation of fiber membranes in the human eye lens. Ultrastructural and Raman microspectroscopic observations. Ophthalmic Research. 27, 78-85 (1995).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rabbit. A scanning electron microscopic reinvestigation. Albrecht von Graefe’s Archive for Clinical and Experimental Opthalmology. 216 (4), 275-289 (1981).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rhesus monkey. Graefe’s Archive for Clinical and Experimental Ophthalmology. 219 (3), 112-120 (1982).
- Zhou, C. J., Lo, W. K. Association of clathrin, AP-2 adaptor and actin cytoskeleton with developing interlocking membrane domains of lens fibre cells. Experimental Eye Research. 77 (4), 423-432 (2003).
- Kuwabara, T. The maturation of the lens cell: a morphologic study. Experimental Eye Research. 20 (5), 427-443 (1975).
- Weeber, H. A., Eckert, G., Pechhold, W., vander Heijde, R. G. Stiffness gradient in the crystalline lens. Graefe’s Archive for Clinical and Experimental Ophthalmology. 245 (9), 1357-1366 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Experimental Eye Research. 80 (3), 425-434 (2005).
- Weeber, H. A., vander Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Experimental Eye Research. 85 (5), 602-607 (2007).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Molecular Vision. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Glasser, A., Campbell, M. C. Biometric, optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Research. 39 (11), 1991-2015 (1999).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Experimental Eye Research. 60 (3), 325-332 (1995).
- Biswas, S. K., Lee, J. E., Brako, L., Jiang, J. X., Lo, W. K. Gap junctions are selectively associated with interlocking ball-and-sockets but not protrusions in the lens. Molecular Vision. 16, 2328-2341 (2010).
- Lo, W. K., et al. Aquaporin-0 targets interlocking domains to control the integrity and transparency of the eye lens. Investigative Ophthalmology & Visual Science. 55 (3), 1202-1212 (2014).
- Cheng, C., et al. Tropomyosin 3.5 protects the F-actin networks required for tissue biomechanical properties. Journal of Cell Science. 131 (23), (2018).
- Cheng, C., et al. Tropomodulin 1 regulation of actin is required for the formation of large paddle protrusions between mature lens fiber cells. Investigative Ophthalmology & Visual Science. 57 (10), 4084-4099 (2016).
- Kuszak, J. R. The development of lens sutures. Progress in Retinal and Eye Research. 14 (2), 567-591 (1995).
- Bassnett, S., Costello, M. J. The cause and consequence of fiber cell compaction in the vertebrate lens. Experimental Eye Research. 156, 50-57 (2017).
- Biswas, S., Son, A., Yu, Q., Zhou, R., Lo, W. K. Breakdown of interlocking domains may contribute to formation of membranous globules and lens opacity in ephrin-A5(-/-) mice. Experimental Eye Research. 145, 130-139 (2016).
- Blankenship, T., Bradshaw, L., Shibata, B., Fitzgerald, P. Structural specializations emerging late in mouse lens fiber cell differentiation. Investigative Ophthalmology & Visual Science. 48 (7), 3269-3276 (2007).
- Cheng, C., et al. Age-related changes in eye lens biomechanics, morphology, refractive index and transparency. Aging. 11 (24), 12497-12531 (2019).
- Cheng, C., et al. EphA2 affects development of the eye lens nucleus and the gradient of refractive index. Investigative Ophthalmology & Visual Science. 63 (1), 2 (2022).
- Cheng, C., Gokhin, D. S., Nowak, R. B., Fowler, V. M. Sequential application of glass coverslips to assess the compressive stiffness of the mouse lens: strain and morphometric analyses. Journal of Visualized Experiments. (111), e53986 (2016).
- Forrester, J. V., Dick, A. D., McMenamin, P. G., Roberts, F., Pearlman, E., Saunders, W. B. Anatomy of the eye and orbit. The Eye (Fourth Edition). , 1 (2016).
- Cheng, C., Nowak, R. B., Fowler, V. M. The lens actin filament cytoskeleton: Diverse structures for complex functions. Experimental Eye Research. 156, 58-71 (2017).
- Goldberg, M. W., Fiserova, J. Immunogold labeling for scanning electron microscopy. Methods in Molecular Biology. 1474, 309-325 (2016).
- Goldberg, M. W. High-resolution scanning electron microscopy and immuno-gold labeling of the nuclear lamina and nuclear pore complex. Methods in Molecular Biology. 1411, 441-459 (2016).
- Hermann, R., Walther, P., Muller, M. Immunogold labeling in scanning electron microscopy. Histochemistry and Cell Biology. 106 (1), 31-39 (1996).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734 (2012).

