Präparation und Immunfluoreszenzfärbung von Bündeln und Einzelfaserzellen aus der Hirnrinde und dem Zellkern der Augenlinse
Summary
Dieses Protokoll beschreibt Methoden zur Vorbereitung von peripheren, reifen und nukleären Augenlinsenfaserzellen für die Immunfluoreszenzfärbung, um komplexe Zell-zu-Zell-Vermischungen und die Membranarchitektur zu untersuchen.
Abstract
Die Linse ist ein transparentes und ellipsoides Organ in der vorderen Augenkammer, das seine Form ändert, um Licht fein auf die Netzhaut zu fokussieren und ein klares Bild zu erzeugen. Der Großteil dieses Gewebes besteht aus spezialisierten, differenzierten Faserzellen, die einen hexagonalen Querschnitt aufweisen und sich vom vorderen bis zum hinteren Pol der Linse erstrecken. Diese langen und dünnen Zellen stehen in engem Gegensatz zu benachbarten Zellen und haben komplexe Verflechtungen entlang der Länge der Zelle. Die spezialisierten ineinandergreifenden Strukturen sind für normale biomechanische Eigenschaften der Linse erforderlich und wurden mit elektronenmikroskopischen Techniken ausführlich beschrieben. Dieses Protokoll demonstriert die erste Methode zur Konservierung und Immunfärbung von Einzelzellen sowie Bündeln von Mauslinsenfaserzellen, um die detaillierte Lokalisierung von Proteinen in diesen komplex geformten Zellen zu ermöglichen. Die repräsentativen Daten zeigen eine Färbung der peripheren, differenzierenden, reifen und nukleären Faserzellen in allen Regionen der Linse. Diese Methode kann möglicherweise auf Faserzellen angewendet werden, die aus Linsen anderer Spezies isoliert wurden.
Introduction
Die Linse ist ein klares und eiförmiges Gewebe in der vorderen Augenkammer, das aus zwei Zelltypen besteht, Epithel- und Faserzellen 1 (Abbildung 1). Es gibt eine Monoschicht von Epithelzellen, die die vordere Hemisphäre der Linse bedeckt. Faserzellen werden von Epithelzellen unterschieden und machen den Großteil der Linse aus. Die hochspezialisierten Faserzellen durchlaufen eine Elongations-, Differenzierungs- und Reifungsprogrammierung, die durch deutliche Veränderungen der Zellmembranmorphologie von der Linsenperipherie bis zum Linsenzentrum gekennzeichnetist 2,3,4,5,6,7,8,9,10,11,12 , auch bekannt als Linsenkern. Die Funktion der Linse, Licht aus verschiedenen Entfernungen auf die Netzhaut zu fokussieren, hängt von ihren biomechanischen Eigenschaften ab, einschließlich Steifigkeit und Elastizität 13,14,15,16,17,18,19. Die komplexen Verzahnungen von Linsenfasern wurden hypothetisch aufgestellt20,21 und haben kürzlich gezeigt, dass sie für die Linsensteifigkeitwichtig sind 22,23.
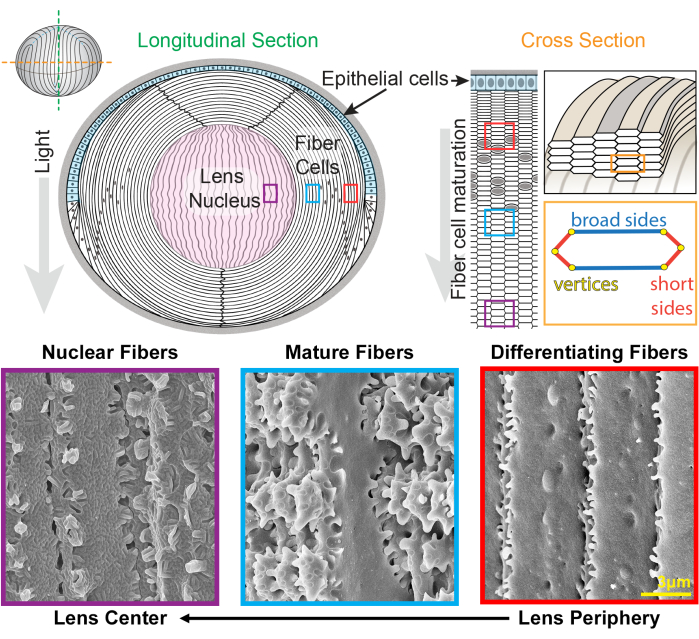
Abbildung 1: Linsenanatomiediagramme und repräsentative Rasterelektronenmikroskopie-Aufnahmen (REM) von Linsenfasern. Die Karikatur zeigt eine Längsansicht (von oben nach hinten von oben nach unten) der vorderen Monoschicht von Epithelzellen (hellblau schattiert) und einer Masse von Linsenfaserzellen (weiß). Das Zentrum der Linse (rosa schattiert) wird als Zellkern bezeichnet und besteht aus hochverdichteten Faserzellen. Auf der rechten Seite zeigt ein Querschnitts-Cartoon die längliche sechseckige Zellform von Linsenfasern, die in ein Wabenmuster gepackt sind. Faserzellen haben zwei breite Seiten und vier kurze Seiten. Repräsentative REM-Bilder entlang der Unterseite zeigen die komplexen Membranverflechtungen zwischen Linsenfaserzellen in verschiedenen Tiefen der Linse. Von rechts haben neu gebildete Linsenfasern an der Linsenperipherie kleine Ausstülpungen an den kurzen Seiten und Kugeln an der Breitseite (rote Kästchen). Während der Reifung entwickeln Linsenfasern große Paddeldomänen, die durch kleine Ausstülpungen entlang der kurzen Seiten (blaue Kästchen) verziert sind. Reife Faserzellen besitzen große Paddeldomänen, die durch kleine Ausstülpungen gekennzeichnet sind. Diese ineinandergreifenden Domänen sind wichtig für die biomechanischen Eigenschaften von Linsen. Faserzellen im Linsenkern haben weniger kleine Ausstülpungen entlang ihrer kurzen Seiten und haben komplexe Nut-Feder-Verflechtungen (violette Kästchen). Die Breitseiten der Zelle weisen eine globuläre Membranmorphologie auf. Die Karikatur wurde von22,32 modifiziert und nicht maßstabsgetreu gezeichnet. Maßstabsleiste = 3 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Linse wächst durch Hinzufügen von Schalen aus neuen Faserzellen, die über frühere Generationen von Fasern24,25 gelegt werden. Faserzellen haben eine längliche, sechseckige Querschnittsform mit zwei breiten Seiten und vier kurzen Seiten. Diese Zellen erstrecken sich vom vorderen zum hinteren Pol der Linse, und je nach Art können die Linsenfasern mehrere Millimeter lang sein. Um die Struktur dieser länglichen und dünnen Zellen zu unterstützen, schaffen spezielle Verflechtungen entlang der breiten und kurzen Seiten ineinandergreifende Strukturen, um die Linsenform und die biomechanischen Eigenschaften zu erhalten. Veränderungen der Zellmembranform während der Differenzierung und Reifung von Faserzellen wurden durch elektronenmikroskopische (EM) Studien umfassend dokumentiert 2,3,4,5,6,7,8,9,10,20,26,27,28,29 . Neu gebildete Faserzellen haben Kugeln und Pfannen entlang ihrer breiten Seiten mit sehr kleinen Vorsprüngen entlang ihrer kurzen Seiten, während reife Fasern ineinandergreifende Vorsprünge und Paddel entlang ihrer kurzen Seiten haben. Kernfasern weisen Nut-Feder-Verflechtungen und eine globuläre Membranmorphologie auf. Über die Proteine, die für diese komplexen ineinandergreifenden Membranen benötigt werden, ist wenig bekannt. Bisherige Studien zur Proteinlokalisierung in Faserzellen stützten sich auf Linsengewebeschnitte, die keine eindeutige Visualisierung der komplexen Zellarchitektur ermöglichen.
In dieser Arbeit wurde eine neuartige Methode entwickelt und perfektioniert, um einzelne und Bündel von Linsenfaserzellen zu fixieren, um die komplexe Morphologie zu erhalten und die Immunfärbung von Proteinen an der Zellmembran und im Zytoplasma zu ermöglichen. Diese Methode bewahrt die Zellmembranarchitektur, vergleichbar mit Daten aus EM-Studien, und ermöglicht die Färbung mit primären Antikörpern für spezifische Proteine. Wir haben zuvor immungefärbte kortikale Linsenfasern in Differenzierung und Reifung22,23. In diesem Protokoll gibt es auch eine neue Methode zur Färbung von Faserzellen aus dem Linsenkern. Dieses Protokoll öffnet die Tür zum Verständnis der Mechanismen für die Bildung und Veränderung der Membraninterdigitation während der Reifung von Faserzellen und der Verdichtung des Linsenkerns.
Protocol
Representative Results
Discussion
Dieses Protokoll hat die Fixierungs-, Konservierungs- und Immunfärbemethoden demonstriert, die die 3D-Membranmorphologie von Bündeln oder einzelnen Linsenfaserzellen aus verschiedenen Tiefen in der Linse originalgetreu erhalten. Die gefärbten Linsenfasern werden mit REM-Präparaten verglichen, die seit langem zur Untersuchung der Zellmorphologie von Linsenfasern verwendet werden. Die Ergebnisse zeigen vergleichbare Membranstrukturen zwischen beiden Präparaten. EM ist nach wie vor der Goldstandard für die Untersuchun…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Diese Arbeit wurde durch das Stipendium R01 EY032056 (an CC) des National Eye Institute unterstützt. Die Autoren danken Dr. Theresa Fassel und Kimberly Vanderpool von der Scripps Research Core Microscopy Facility für ihre Unterstützung bei den elektronenmikroskopischen Bildern.
Materials
| 100% Triton X-100 | FisherScientific | BP151-500 | |
| 60mm plate | FisherScientific | FB0875713A | |
| 16% paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| 10X phosphate buffered saline | ThermoFisher | 70011-044 | |
| 1X phosphate buffered saline | ThermoFisher | 14190136 | |
| 48-well plate | CytoOne | CC7672-7548 | |
| Cover slips (22 x 40 mm) | FisherScientific | 12-553-467 | |
| Curved tweezers | World Precision Instruments | 501981 | |
| Dissection microscope | Carl Zeiss | Stereo Discovery V8 | |
| Fine tip straight tweezers | Electron Microscopy Sciences | 72707-01 | |
| Fisherbrand Superfrost Plus Microscope Slides | FisherScientific | 12-550-15 | |
| LSM 800 confocal microscope with Airyscan (63X) and Zen 3.5 Software | Carl Zeiss | ||
| Nail polish | |||
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| Phalloidin (rhodamine) | ThermoFisher | R415 | |
| Primary antibody | |||
| Scalpel Feather Disposable, steril, No. 11 | VWR | 76241-186 | |
| Secondary antibody | |||
| Straight forceps | World Precision Instruments | 11252-40 | |
| Thermo Scientific Nunc MicroWell MiniTrays (dissection tray) | FisherScientific | 12-565-154 | |
| Ultra-fine scissors | World Precision Instruments | 501778 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | |
| Wheat germ agglutinin (fluorescein) | Vector Laboratories | FL-1021-5 |
References
- Lovicu, F. J., McAvoy, J. W. Growth factor regulation of lens development. 발생학. 280 (1), 1-14 (2005).
- Kuszak, J., Alcala, J., Maisel, H. The surface morphology of embryonic and adult chick lens-fiber cells. The American Journal of Anatomy. 159 (4), 395-410 (1980).
- Kuszak, J. R. The ultrastructure of epithelial and fiber cells in the crystalline lens. International Review of Cytology. 163, 305-350 (1995).
- Kuszak, J. R., Macsai, M. S., Rae, J. L. Stereo scanning electron microscopy of the crystalline lens. Scanning Electron Microscopy. , 1415-1426 (1983).
- Lo, W. K., Harding, C. V. Square arrays and their role in ridge formation in human lens fibers. Journal of Ultrastructure Research. 86 (3), 228-245 (1984).
- Taylor, V. L., et al. Morphology of the normal human lens. Investigative Ophthalmology & Visual Science. 37 (7), 1396-1410 (1996).
- Vrensen, G. F. Aging of the human eye lens-a morphological point of view. Comparative Biochemistry and Physiology. Part A, Physiology. 111 (4), 519-532 (1995).
- Vrensen, G. F., Duindam, H. J. Maturation of fiber membranes in the human eye lens. Ultrastructural and Raman microspectroscopic observations. Ophthalmic Research. 27, 78-85 (1995).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rabbit. A scanning electron microscopic reinvestigation. Albrecht von Graefe’s Archive for Clinical and Experimental Opthalmology. 216 (4), 275-289 (1981).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rhesus monkey. Graefe’s Archive for Clinical and Experimental Ophthalmology. 219 (3), 112-120 (1982).
- Zhou, C. J., Lo, W. K. Association of clathrin, AP-2 adaptor and actin cytoskeleton with developing interlocking membrane domains of lens fibre cells. Experimental Eye Research. 77 (4), 423-432 (2003).
- Kuwabara, T. The maturation of the lens cell: a morphologic study. Experimental Eye Research. 20 (5), 427-443 (1975).
- Weeber, H. A., Eckert, G., Pechhold, W., vander Heijde, R. G. Stiffness gradient in the crystalline lens. Graefe’s Archive for Clinical and Experimental Ophthalmology. 245 (9), 1357-1366 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Experimental Eye Research. 80 (3), 425-434 (2005).
- Weeber, H. A., vander Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Experimental Eye Research. 85 (5), 602-607 (2007).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Molecular Vision. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Glasser, A., Campbell, M. C. Biometric, optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Research. 39 (11), 1991-2015 (1999).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Experimental Eye Research. 60 (3), 325-332 (1995).
- Biswas, S. K., Lee, J. E., Brako, L., Jiang, J. X., Lo, W. K. Gap junctions are selectively associated with interlocking ball-and-sockets but not protrusions in the lens. Molecular Vision. 16, 2328-2341 (2010).
- Lo, W. K., et al. Aquaporin-0 targets interlocking domains to control the integrity and transparency of the eye lens. Investigative Ophthalmology & Visual Science. 55 (3), 1202-1212 (2014).
- Cheng, C., et al. Tropomyosin 3.5 protects the F-actin networks required for tissue biomechanical properties. Journal of Cell Science. 131 (23), (2018).
- Cheng, C., et al. Tropomodulin 1 regulation of actin is required for the formation of large paddle protrusions between mature lens fiber cells. Investigative Ophthalmology & Visual Science. 57 (10), 4084-4099 (2016).
- Kuszak, J. R. The development of lens sutures. Progress in Retinal and Eye Research. 14 (2), 567-591 (1995).
- Bassnett, S., Costello, M. J. The cause and consequence of fiber cell compaction in the vertebrate lens. Experimental Eye Research. 156, 50-57 (2017).
- Biswas, S., Son, A., Yu, Q., Zhou, R., Lo, W. K. Breakdown of interlocking domains may contribute to formation of membranous globules and lens opacity in ephrin-A5(-/-) mice. Experimental Eye Research. 145, 130-139 (2016).
- Blankenship, T., Bradshaw, L., Shibata, B., Fitzgerald, P. Structural specializations emerging late in mouse lens fiber cell differentiation. Investigative Ophthalmology & Visual Science. 48 (7), 3269-3276 (2007).
- Cheng, C., et al. Age-related changes in eye lens biomechanics, morphology, refractive index and transparency. Aging. 11 (24), 12497-12531 (2019).
- Cheng, C., et al. EphA2 affects development of the eye lens nucleus and the gradient of refractive index. Investigative Ophthalmology & Visual Science. 63 (1), 2 (2022).
- Cheng, C., Gokhin, D. S., Nowak, R. B., Fowler, V. M. Sequential application of glass coverslips to assess the compressive stiffness of the mouse lens: strain and morphometric analyses. Journal of Visualized Experiments. (111), e53986 (2016).
- Forrester, J. V., Dick, A. D., McMenamin, P. G., Roberts, F., Pearlman, E., Saunders, W. B. Anatomy of the eye and orbit. The Eye (Fourth Edition). , 1 (2016).
- Cheng, C., Nowak, R. B., Fowler, V. M. The lens actin filament cytoskeleton: Diverse structures for complex functions. Experimental Eye Research. 156, 58-71 (2017).
- Goldberg, M. W., Fiserova, J. Immunogold labeling for scanning electron microscopy. Methods in Molecular Biology. 1474, 309-325 (2016).
- Goldberg, M. W. High-resolution scanning electron microscopy and immuno-gold labeling of the nuclear lamina and nuclear pore complex. Methods in Molecular Biology. 1411, 441-459 (2016).
- Hermann, R., Walther, P., Muller, M. Immunogold labeling in scanning electron microscopy. Histochemistry and Cell Biology. 106 (1), 31-39 (1996).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734 (2012).

