Preparation and Immunofluorescence Staining of Bundles and Single Fiber Cells from the Cortex and Nucleus of the Eye Lens(눈 수정체의 피질과 핵에서 다발 및 단일 섬유 세포의 준비 및 면역형광 염색)
Summary
이 프로토콜은 복잡한 세포 간 간지화 및 막 구조를 연구하기 위해 면역형광 염색을 위해 말초, 성숙 및 핵 수정체 섬유 세포를 준비하는 방법을 설명합니다.
Abstract
수정체는 눈의 전방에 있는 투명한 타원체 기관으로, 모양을 바꾸어 빛을 망막에 미세하게 집중시켜 선명한 이미지를 형성합니다. 이 조직의 대부분은 육각형 단면을 가지고 수정체의 전방에서 후방까지 뻗어 있는 전문적이고 분화된 섬유 세포로 구성되어 있습니다. 이 길고 가느다란 세포는 이웃 세포와 밀접하게 대립하며 세포의 길이를 따라 복잡한 간지(interdigitation)를 가지고 있습니다. 특수 연동 구조는 렌즈의 일반적인 생체역학적 특성에 필요하며 전자 현미경 기술을 사용하여 광범위하게 설명되었습니다. 이 프로토콜은 생쥐 렌즈 섬유 세포의 단수 및 다발을 보존하고 면역염색하여 복잡한 모양의 세포 내에서 단백질의 상세한 국소화를 가능하게 하는 첫 번째 방법을 보여줍니다. 대표적인 데이터는 수정체의 모든 영역에 걸쳐 말초, 분화, 성숙 및 핵 섬유 세포의 염색을 보여줍니다. 이 방법은 잠재적으로 다른 종의 렌즈로부터 분리된 섬유 세포에 사용될 수 있습니다.
Introduction
수정체는 눈의 전방에 있는 투명하고 난형적인 조직으로, 상피 세포와 섬유 세포의 두 가지 세포 유형으로 구성되어있습니다 1(그림 1). 수정체의 전방 반구를 덮고 있는 상피 세포의 단층이 있습니다. 섬유 세포는 상피 세포와 분화되어 수정체의 대부분을 구성합니다. 고도로 전문화된 섬유 세포는 수정체 주변부에서 수정체 중심까지 세포막 형태의 뚜렷한 변화를 특징으로 하는 신장, 분화 및 성숙 프로그래밍을 거칩니다 2,3,4,5,6,7,8,9,10,11,12 , 수정체 핵이라고도 합니다. 다양한 거리에서 망막으로 들어오는 빛의 초점을 미세하게 맞추는 수정체의 기능은 강성 및 탄성 13,14,15,16,17,18,19를 포함한 생체역학적 특성에 따라 달라집니다. 렌즈 섬유의 복잡한 interdigitations는 가설을 세웠으며20,21 최근에는 렌즈 강성(lens stiffness)22,23에 중요한 것으로 나타났습니다.
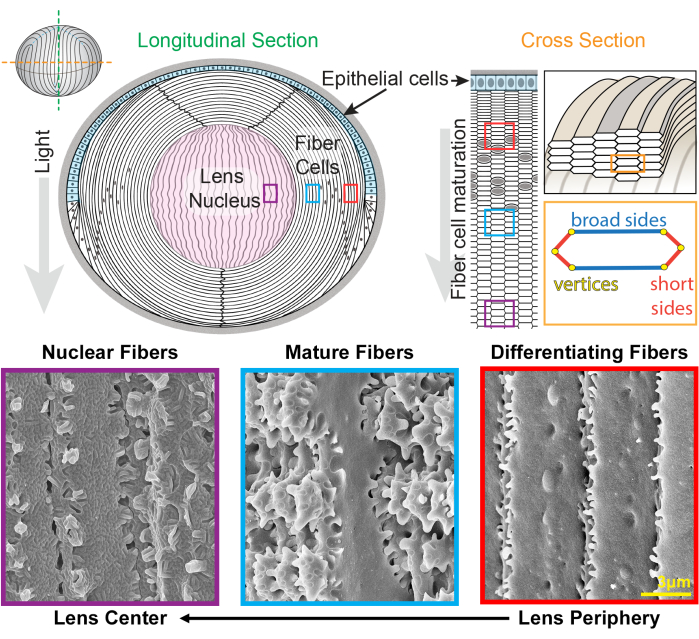
그림 1: 렌즈 해부학적 구조와 렌즈 섬유의 대표적인 주사전자현미경(SEM) 이미지. 이 만화는 상피 세포의 전방 단층(하늘색으로 음영 처리)과 수정체 섬유 세포의 벌크 덩어리(흰색)의 세로(위에서 아래로) 전방 단층을 보여줍니다. 수정체의 중앙(분홍색으로 음영 처리)은 핵으로 알려져 있으며 고도로 압축된 섬유 세포로 구성되어 있습니다. 오른쪽에는 단면 만화가 벌집 패턴으로 포장된 렌즈 섬유의 길쭉한 육각형 세포 모양을 보여줍니다. 섬유 전지에는 2개의 넓은 면과 4개의 짧은 면이 있습니다. 하단의 대표적인 SEM 이미지는 렌즈의 서로 다른 깊이에 있는 렌즈 섬유 셀 사이의 복잡한 막 삽입을 보여줍니다. 오른쪽부터 렌즈 주변부에 새로 형성된 렌즈 섬유는 짧은 면을 따라 작은 돌출부가 있고 넓은 면을 따라 볼과 소켓이 있습니다(빨간색 상자). 성숙하는 동안 렌즈 섬유는 짧은 면을 따라 작은 돌출부(파란색 상자)로 장식된 큰 패들 도메인을 발달시킵니다. 성숙한 섬유 세포는 작은 돌출부로 묘사된 큰 패들 도메인을 가지고 있습니다. 이러한 연동 영역은 렌즈의 생체역학적 특성에 중요합니다. 수정체핵의 섬유세포는 짧은 면을 따라 작은 돌출부가 적고 복잡한 혀와 홈이 있는 인터디지테이션(보라색 상자)이 있습니다. 세포의 넓은 면은 구형막 형태를 나타냅니다. 만화는22,32에서 수정되었으며 축척에 맞게 그려지지 않았습니다. 스케일 바 = 3 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
수정체는 이전 세대의 섬유24,25 위에 겹쳐진 새로운 섬유 세포의 껍질을 추가하여 성장합니다. 섬유 전지는 길쭉한 육각형 단면 모양으로 2개의 넓은 면과 4개의 짧은 면이 있습니다. 이 세포는 수정체의 전방에서 후극까지 뻗어 있으며, 종에 따라 수정체 섬유의 길이는 수 밀리미터에 달할 수 있습니다. 이러한 길고 가느다란 세포의 구조를 지원하기 위해 넓은 면과 짧은 면을 따라 특수한 간지(interdigitation)가 맞물리는 구조를 만들어 수정체 모양과 생체역학적 특성을 유지합니다. 섬유 세포 분화 및 성숙 중 세포막 모양의 변화는 전자 현미경 (EM) 연구 2,3,4,5,6,7,8,9,10,20,26,27,28,29에 의해 광범위하게 문서화되었습니다 . 새로 형성된 섬유 세포는 넓은 면을 따라 볼과 소켓이 있고 짧은 면을 따라 매우 작은 돌출부가 있는 반면, 성숙한 섬유는 짧은 면을 따라 맞물리는 돌출부와 패들이 있습니다. 핵 섬유는 혀와 홈의 간지(tongue-and-groove interdigitations)와 구상막 형태(globular membrane morphology)를 나타낸다. 이러한 복잡한 맞물리는 막에 필요한 단백질에 대해서는 알려진 바가 거의 없습니다. 섬유 세포의 단백질 국소화에 대한 이전 연구는 복잡한 세포 구조를 명확하게 시각화할 수 없는 렌즈 조직 절편에 의존했습니다.
이 연구는 복잡한 형태를 보존하고 세포막과 세포질 내에서 단백질에 대한 면역염색을 허용하기 위해 수정체 섬유 세포의 단일 및 다발을 고정하는 새로운 방법을 만들고 완성했습니다. 이 방법은 EM 연구의 데이터와 비교할 수 있는 세포막 구조를 충실하게 보존하고 특정 단백질에 대한 1차 항체로 염색할 수 있습니다. 우리는 이전에 분화 및 성숙을 겪는 면역 염색 된 피질 수정체 섬유를 가지고 있습니다22,23. 이 프로토콜에는 수정체 핵에서 섬유 세포를 염색하는 새로운 방법도 있습니다. 이 프로토콜은 섬유 세포 성숙 및 수정체 핵 압축 중 막 삽입의 형성 및 변화를 위한 메커니즘을 이해할 수 있는 문을 열어줍니다.
Protocol
Representative Results
Discussion
이 프로토콜은 렌즈의 다양한 깊이에서 번들 또는 단일 렌즈 섬유 세포의 3D 멤브레인 형태를 충실하게 보존하는 고정, 보존 및 면역염색 방법을 입증했습니다. 염색된 렌즈 섬유는 렌즈 섬유 세포 형태를 연구하는 데 오랫동안 사용되어 온 SEM 제제와 비교됩니다. 결과는 두 제제 간의 유사한 멤브레인 구조를 보여줍니다. EM은 세포 형태 연구의 황금 표준으로 남아 있지만, 단백질33,34…
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 연구는 미국 국립안과연구소(National Eye Institute)의 보조금 R01 EY032056(to CC)의 지원을 받았습니다. 저자들은 전자 현미경 이미지에 도움을 준 Scripps Research Core Microscopy Facility의 Theresa Fassel 박사와 Kimberly Vanderpool 박사에게 감사를 표합니다.
Materials
| 100% Triton X-100 | FisherScientific | BP151-500 | |
| 60mm plate | FisherScientific | FB0875713A | |
| 16% paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| 10X phosphate buffered saline | ThermoFisher | 70011-044 | |
| 1X phosphate buffered saline | ThermoFisher | 14190136 | |
| 48-well plate | CytoOne | CC7672-7548 | |
| Cover slips (22 x 40 mm) | FisherScientific | 12-553-467 | |
| Curved tweezers | World Precision Instruments | 501981 | |
| Dissection microscope | Carl Zeiss | Stereo Discovery V8 | |
| Fine tip straight tweezers | Electron Microscopy Sciences | 72707-01 | |
| Fisherbrand Superfrost Plus Microscope Slides | FisherScientific | 12-550-15 | |
| LSM 800 confocal microscope with Airyscan (63X) and Zen 3.5 Software | Carl Zeiss | ||
| Nail polish | |||
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| Phalloidin (rhodamine) | ThermoFisher | R415 | |
| Primary antibody | |||
| Scalpel Feather Disposable, steril, No. 11 | VWR | 76241-186 | |
| Secondary antibody | |||
| Straight forceps | World Precision Instruments | 11252-40 | |
| Thermo Scientific Nunc MicroWell MiniTrays (dissection tray) | FisherScientific | 12-565-154 | |
| Ultra-fine scissors | World Precision Instruments | 501778 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | |
| Wheat germ agglutinin (fluorescein) | Vector Laboratories | FL-1021-5 |
References
- Lovicu, F. J., McAvoy, J. W. Growth factor regulation of lens development. 발생학. 280 (1), 1-14 (2005).
- Kuszak, J., Alcala, J., Maisel, H. The surface morphology of embryonic and adult chick lens-fiber cells. The American Journal of Anatomy. 159 (4), 395-410 (1980).
- Kuszak, J. R. The ultrastructure of epithelial and fiber cells in the crystalline lens. International Review of Cytology. 163, 305-350 (1995).
- Kuszak, J. R., Macsai, M. S., Rae, J. L. Stereo scanning electron microscopy of the crystalline lens. Scanning Electron Microscopy. , 1415-1426 (1983).
- Lo, W. K., Harding, C. V. Square arrays and their role in ridge formation in human lens fibers. Journal of Ultrastructure Research. 86 (3), 228-245 (1984).
- Taylor, V. L., et al. Morphology of the normal human lens. Investigative Ophthalmology & Visual Science. 37 (7), 1396-1410 (1996).
- Vrensen, G. F. Aging of the human eye lens-a morphological point of view. Comparative Biochemistry and Physiology. Part A, Physiology. 111 (4), 519-532 (1995).
- Vrensen, G. F., Duindam, H. J. Maturation of fiber membranes in the human eye lens. Ultrastructural and Raman microspectroscopic observations. Ophthalmic Research. 27, 78-85 (1995).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rabbit. A scanning electron microscopic reinvestigation. Albrecht von Graefe’s Archive for Clinical and Experimental Opthalmology. 216 (4), 275-289 (1981).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rhesus monkey. Graefe’s Archive for Clinical and Experimental Ophthalmology. 219 (3), 112-120 (1982).
- Zhou, C. J., Lo, W. K. Association of clathrin, AP-2 adaptor and actin cytoskeleton with developing interlocking membrane domains of lens fibre cells. Experimental Eye Research. 77 (4), 423-432 (2003).
- Kuwabara, T. The maturation of the lens cell: a morphologic study. Experimental Eye Research. 20 (5), 427-443 (1975).
- Weeber, H. A., Eckert, G., Pechhold, W., vander Heijde, R. G. Stiffness gradient in the crystalline lens. Graefe’s Archive for Clinical and Experimental Ophthalmology. 245 (9), 1357-1366 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Experimental Eye Research. 80 (3), 425-434 (2005).
- Weeber, H. A., vander Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Experimental Eye Research. 85 (5), 602-607 (2007).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Molecular Vision. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Glasser, A., Campbell, M. C. Biometric, optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Research. 39 (11), 1991-2015 (1999).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Experimental Eye Research. 60 (3), 325-332 (1995).
- Biswas, S. K., Lee, J. E., Brako, L., Jiang, J. X., Lo, W. K. Gap junctions are selectively associated with interlocking ball-and-sockets but not protrusions in the lens. Molecular Vision. 16, 2328-2341 (2010).
- Lo, W. K., et al. Aquaporin-0 targets interlocking domains to control the integrity and transparency of the eye lens. Investigative Ophthalmology & Visual Science. 55 (3), 1202-1212 (2014).
- Cheng, C., et al. Tropomyosin 3.5 protects the F-actin networks required for tissue biomechanical properties. Journal of Cell Science. 131 (23), (2018).
- Cheng, C., et al. Tropomodulin 1 regulation of actin is required for the formation of large paddle protrusions between mature lens fiber cells. Investigative Ophthalmology & Visual Science. 57 (10), 4084-4099 (2016).
- Kuszak, J. R. The development of lens sutures. Progress in Retinal and Eye Research. 14 (2), 567-591 (1995).
- Bassnett, S., Costello, M. J. The cause and consequence of fiber cell compaction in the vertebrate lens. Experimental Eye Research. 156, 50-57 (2017).
- Biswas, S., Son, A., Yu, Q., Zhou, R., Lo, W. K. Breakdown of interlocking domains may contribute to formation of membranous globules and lens opacity in ephrin-A5(-/-) mice. Experimental Eye Research. 145, 130-139 (2016).
- Blankenship, T., Bradshaw, L., Shibata, B., Fitzgerald, P. Structural specializations emerging late in mouse lens fiber cell differentiation. Investigative Ophthalmology & Visual Science. 48 (7), 3269-3276 (2007).
- Cheng, C., et al. Age-related changes in eye lens biomechanics, morphology, refractive index and transparency. Aging. 11 (24), 12497-12531 (2019).
- Cheng, C., et al. EphA2 affects development of the eye lens nucleus and the gradient of refractive index. Investigative Ophthalmology & Visual Science. 63 (1), 2 (2022).
- Cheng, C., Gokhin, D. S., Nowak, R. B., Fowler, V. M. Sequential application of glass coverslips to assess the compressive stiffness of the mouse lens: strain and morphometric analyses. Journal of Visualized Experiments. (111), e53986 (2016).
- Forrester, J. V., Dick, A. D., McMenamin, P. G., Roberts, F., Pearlman, E., Saunders, W. B. Anatomy of the eye and orbit. The Eye (Fourth Edition). , 1 (2016).
- Cheng, C., Nowak, R. B., Fowler, V. M. The lens actin filament cytoskeleton: Diverse structures for complex functions. Experimental Eye Research. 156, 58-71 (2017).
- Goldberg, M. W., Fiserova, J. Immunogold labeling for scanning electron microscopy. Methods in Molecular Biology. 1474, 309-325 (2016).
- Goldberg, M. W. High-resolution scanning electron microscopy and immuno-gold labeling of the nuclear lamina and nuclear pore complex. Methods in Molecular Biology. 1411, 441-459 (2016).
- Hermann, R., Walther, P., Muller, M. Immunogold labeling in scanning electron microscopy. Histochemistry and Cell Biology. 106 (1), 31-39 (1996).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734 (2012).

