Ikke-invasiv overvågning af mikrovaskulær iltning og reaktiv hyperæmi ved hjælp af hybrid, nær-infrarød diffus optisk spektroskopi til kritisk pleje
Summary
Vi beskriver en protokol til ikke-invasivt og kontinuerligt at måle absolut mikrovaskulært blodgennemstrømningsindeks og iltmætning i blodet ved hjælp af en multimodal enhed baseret på nær-infrarød diffus optik. Vi evaluerer derefter den metaboliske hastighed af iltforbrug og reaktiv hyperæmi ved hjælp af en vaskulær okklusionstest.
Abstract
Påvisning af niveauer af svækkelse i mikrovaskulært iltforbrug og reaktiv hyperæmi er afgørende i kritisk pleje. Der er imidlertid ingen praktiske midler til en solid og kvantitativ evaluering. Dette papir beskriver en protokol til evaluering af disse forringelser ved hjælp af en hybrid nær-infrarød diffus optisk enhed. Enheden indeholder moduler til nær-infrarød tidsopløst og diffus korrelationsspektroskopi og pulsoximetri. Disse moduler tillader ikke-invasiv, kontinuerlig og realtidsmåling af den absolutte, mikrovaskulære blod / væv iltmætning (StO2) og blodgennemstrømningsindekset (BFI) sammen med den perifere arterielle iltmætning (SpO2). Denne enhed bruger et integreret, computerstyret tourniquet-system til at udføre en standardiseret protokol med optisk dataindsamling fra brachioradialis-musklen. Den standardiserede vaskulære okklusionstest (VOT) tager sig af variationerne i okklusionsvarigheden og trykket, der er rapporteret i litteraturen, mens automatiseringen minimerer forskelle mellem operatører. Den protokol, vi beskriver, fokuserer på en 3-minutters okklusionsperiode, men detaljerne beskrevet i dette papir kan let tilpasses andre varigheder og manchettryk såvel som andre muskler. Medtagelsen af en udvidet baseline- og postokklusionsmåling af restitutionsperioden gør det muligt at kvantificere baselineværdierne for alle parametrene og den blod-/vævsdeoxygeneringshastighed, der svarer til iltforbrugets metaboliske hastighed. Når manchetten er frigivet, karakteriserer vi vævets reoxygeneringshastighed, størrelse og varighed af det hyperemiske respons i BFI og StO2. Disse sidstnævnte parametre svarer til kvantificeringen af den reaktive hyperæmi, som giver information om endotelfunktionen. Desuden giver de ovennævnte målinger af den absolutte koncentration af iltet og deoxygeneret hæmoglobin, BFI, den afledte metaboliske hastighed for iltforbrug, StO2 og SpO2 et endnu ikke udforsket rigt datasæt, der kan udvise sygdommens sværhedsgrad, personlig terapi og ledelsesinterventioner.
Introduction
Kritisk syge patienter, især dem med sepsis og andre lignende tilstande, udviser ofte nedsat reaktiv hyperæmi og mikrovaskulær iltning 1,2,3. Under de første bølger af COVID-19-pandemien krævede et uforudset antal patienter intensivbehandling, hvor virusets indvirkning på endotelet blev tydelig, men uden en klar strategi for at vurdere og håndtere 4,5,6. Som følge heraf har der været en voksende anerkendelse af vigtigheden af at detektere endoteldysfunktion, som indirekte kan evalueres ved reaktiv hyperæmi, i kritisk pleje, dvs. intensivafdelingen (ICU) populationer7. En praktisk, robust og bredt tilgængelig vurdering af ilttilførsel og forbrug til vævene forventes at være af største betydning for optimering af genoplivningsstrategier og direkte adressering af mikrocirkulationsproblemer. Undersøgelser har konsekvent vist, at vedvarende mikrocirkulatoriske ændringer og manglende sammenhæng mellem makrocirkulation og mikrocirkulation til en vis grad forudsiger organsvigt og ugunstige resultater hos patienter, der er ramt af septisk chok eller hæmoragisk shock, blandt andre kritiske tilstande, selv når systemiske parametre anses for at være normale 8,9,10. Det er blevet klart, at det er utilstrækkeligt udelukkende at stole på makrocirkulatoriske parametre, da mikrocirkulation spiller en kritisk rolle i vævets iltning og organfunktion 11,12,13. Dette papir beskriver en protokol, der bruger en ny multimodal enhed baseret på nær-infrarøde diffuse optiske teknologier, der er udviklet inden for et internationalt konsortium, der fokuserer på ICU-patienter. Projektet, VASCOVID (https://vascovid.eu), var motiveret af COVID-19-pandemien til at evaluere mikrovaskulær sundhed i perifere muskler i intensiv pleje. Vi har designet en protokol ved hjælp af den udviklede VASCOVID-enhed, der har til formål at forbedre vores forståelse af disse parametre, og hvordan disse parametre kan være nyttige til håndtering af kritisk syge patienter med et meget bredere omfang end COVID-19-patienter.
Nærinfrarød spektroskopi (NIRS) er blevet brugt til at vurdere mikrocirkulation ikke-invasivt i årtier i en bred vifte af kliniske applikationer, herunder ICU-patienterne 14,15,16,17. Det er vigtigt at bemærke, at den enkleste anvendelse af NIRS, dvs. kontinuerlig bølge NIRS (CW-NIRS), implementeres i almindeligt anvendt og klinisk godkendt udstyr17,18, der anvendes til måling af de absolutte koncentrationer af oxy- (HbO) og deoxy-hæmoglobin (HbR) til beregning af blodets / vævets iltmætning (StO2) af mikrovaskulaturen. Mens disse enheder har fundet nicheanvendelser i klinisk styring, såsom under hjertekirurgi, har de klare begrænsninger på grund af fysikken bag fotonudbredelse i væv. Dette betyder, at deres nøjagtighed, præcision og repeterbarhed er tvivlsom, derfor bruges de ofte som trendmonitorer19,20. Desuden er deres resultater stærkt påvirket af overfladiske væv såsom overlejring af fedt- og hudlag.
Tidsopløst NIRS (TRS) anvender korte laserimpulser i picosekundområdet ved flere bølgelængder for at vurdere deres forsinkelse og udvidelse efter at have krydset gennem et væv21. Dette gør det muligt for TRS at adskille virkningerne af absorption fra spredning for at opnå robuste, nøjagtige og præcise estimater, hvilket også gør det muligt at beregne den samlede hæmoglobinkoncentration (HbT). Da TRS også løser stilængder, kan den bruges til bedre at adskille overfladiske signaler fra de dybe signaler af interesse18,21. Dette kommer på bekostning af kompleksitet, pris og bulkiness. I de senere år er TRS-systemer imidlertid faldet i kompleksitet og omkostninger, hvilket resulterer i mere tilgængelige og lettere at bruge enheder. Dette manuskript beskriver en enhed, der bruger et kompakt originalt udstyrsproducent (OEM) kommercielt TRS-modul 22,23.
Diffus korrelationsspektroskopi (DCS) er en anden nær-infrarød teknologi, der udnytter den tidsmæssige statistik over diffuse pletter til at kvantificere bevægelsen af lysspredningspartikler, som domineres af røde blodlegemer i væv 16,24. Dette er igen velkendt for at være en indikator for mikrovaskulær blodgennemstrømning, som vi kalder blodgennemstrømningsindekset (BFI)25. Samtidig brug af TRS og DCS i en hybrid optisk enhed giver indsigt i iltmetabolisme ved at bruge almindelige modeller til at udlede den lokale iltekstraktionsfraktion og gange med blodgennemstrømningen 15,26,27.
For at vurdere mikrocirkulationen på ICU bruges NIRS ofte med en vaskulær okklusionstest (VOT), som er en iskæmisk udfordring, der udføres ved at blokere blodtilførslen til den undersøgte perifere muskel i en vis varighed (et par minutter)28,29,30,31,32. Mest almindeligt udføres det ved at oppuste en tourniquet viklet rundt om overarmen over det systoliske tryk33. Under VOT vurderer klinikerne responsen af den mikrovaskulære blodiltning på ændringer i blodgennemstrømningen for at udlede iltmetabolisme i hvile og reaktiv hyperæmi34. Antagelsen er, at der under VOT, med manchetten oppustet godt over lemmernes okklusionstryk, ikke er nogen tilstrømning eller udstrømning af blod. Derfor viser starten af VOT en nedadgående hældning afStO2, dvs. deoxygenering (DeO2), da ilt forbruges af vævet, hvilket muliggør et skøn over den metaboliske hastighed af iltforbrug. Når VOT slutter, og manchetten tømmes, strømmer blod ind for at kompensere for dens udtømning, hvilket fører til et hyperemisk respons. Dette rush genererer en skarp opadgående hældning i StO2, dvs. en reoxygenering (ReO2). Det hyperemiske respons, som er en stigning ud over den oprindelige baseline med en langsom genopretning tilbage til baseline, estimerer den reaktive hyperæmi. Kombinationen af NIRS med en VOT har fået stigende interesse for intensiv pleje på grund af dets brugervenlighed og potentiale til at forudsige negative resultater og endda dødelighed under kritiske tilstande som sepsis 35,36,37.
Under COVID-19-pandemien har vores grupper startet et verdensomspændende konsortium og for nylig afsluttet det såkaldte HEMOCOVID-19-forsøg, der viser en sammenhæng mellem perifere mikrocirkulatoriske ændringer og sværhedsgraden af akut respiratorisk distress syndrom hos COVID-19-patienter6. Dette blev også understøttet af andre værker 7,38. Alle disse undersøgelser blev udført med de ovennævnte CW-NIRS-systemer og led derfor af deres mangler. Desuden blev udførelsen af VOT ikke standardiseret på tværs af forskellige undersøgelser og påvirkes af forskellige parametre som okklusionsvarighed, turneringstryk og operatørbaserede variationer 29,39,40. En litteraturgennemgang viser tydeligt, at for at VOT og NIRS kan få trækkraft i klinikkerne, er det vigtigt at måle blodgennemstrømningen, have standardiserede protokoller og have et robust NIRS-system11. Derfor har vi foreslået, at ved at bruge en mere avanceret form for NIRS (TRS), måle blodgennemstrømning og standardisere manchetkontrollen under VOT, kunne der opnås en bedre diskrimination af patologiske tilstande fra sunde. Til dette formål har vi udviklet denne hybrid diffuse optiske enhed, der integrerer flere moduler, der omfatter to nær-infrarøde diffuse optiske moduler af TRS og DCS, pulsoximetri og en automatiseret tourniquet. Pulsoximetrimodulet giver puls (HR), perfusionsindeks og procentdel af arteriel iltmætning (SpO2). En hurtig turnering bruges i enheden, hvilket er kritisk for at udføre VOT. Enheden leveres med en valgfri tilbehørsboks, der giver os mulighed for at erhverve yderligere oplysninger under brugen til udvidet og kontinuerlig kvalitetskontrol, såsom rutinemæssig og praktisk måling af instrumentresponsfunktionen (IRF) til TRS og måling på et vævsefterlignende fantom, til evaluering af langsgående stabilitet. Enheden er vist som brugt i ICU i figur 1.
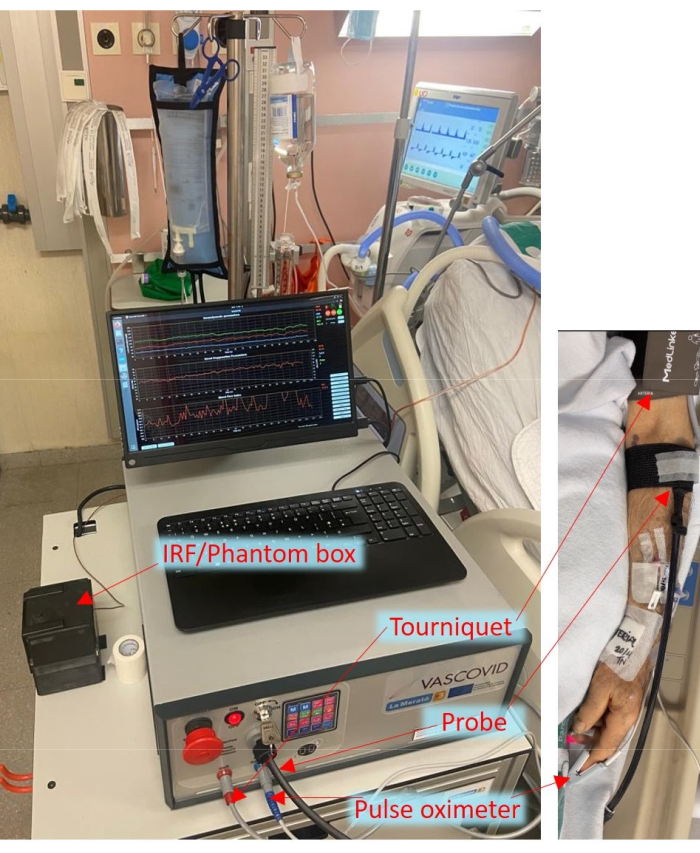
Figur 1: Sengearrangement af den bærbare enhed på intensivafdelingen med sonder og manchet fastgjort til patienten. Klik her for at se en større version af denne figur.
Den multimodale smarte sonde inkorporerer kilde- og detektoroptiske fibre til både TRS og DCS med optiske filtre inde i enheden, der forhindrer interferens mellem DCS og TRS. Kildedetektoradskillelsen, der anvendes i dette system, er 25 mm. Derudover indeholder sonden en kapacitiv berøringssensor, der giver en værdifuld sikkerhedsfunktion til forebyggelse af laserfarer i henhold til lasersikkerhedsstandarden (IEC 60601-2-22:2019)41. Lasersikkerhedssystemet i enheden sikrer, at laserudsendelsen kun sker, når sonden er i kontakt med vævet. Hvis sonden frigøres, slukkes laserne straks, hvilket sikrer sikkerheden for både patienter og operatører. Desuden er sonden integreret med et accelerometer, belastningssensor og lyssensor til yderligere funktionalitet og dataindsamlingsformål.
Dette papir beskriver den automatiserede protokol, hvor vi sonderer brachioradialis-musklen samtidigt med en VOT ved hjælp af den udviklede enhed. Protokollens tidslinje er vist i figur 2. Protokollen er fuldstændig automatiseret, og der er ikke behov for operatørinterventioner under hele udførelsen. Ved at udnytte mulighederne i denne nye enhed sigter vi mod at få værdifuld indsigt, der lader lægerne forstå fysiopatologien ved perifert iltforbrug bedre og også vurdere forholdet mellem iltforbrug og levering og derved hjælpe dem med at forbedre patientplejen omfattende og effektivt.
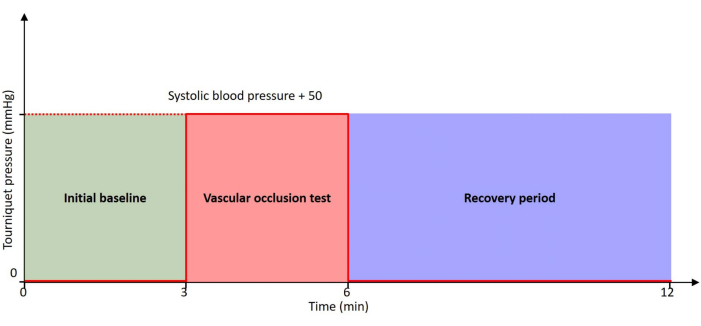
Figur 2: Tidslinje for protokollen. Patienten er i ro gennem hele tidslinjen med 0 mmHg tryk ved indledende baseline og restitutionsperiode. VOT udføres med en tourniquet oppustet til et tryk på 50 mmHg højere end patientens systoliske blodtryk. Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
Vi har demonstreret en fuldautomatisk, robust, ikke-invasiv enhed til kontinuerlig måling og overvågning af skeletmuskulatur ved hjælp af hybrid diffus optik til evaluering af mikrovaskulær iltning, blodperfusion og reaktiv hyperæmi. Ved hjælp af denne protokol med VASCOVID-enhed kan vi samtidig måle absolutte hæmodynamiske parametre for HbO, HbR og HbT; iltmætning fraStO2 ogSpO2; DeO2 og ReO2; og BFI. Den viste StO2 og BFI i realtid opnås fra rådataene fra det foregående sekund fra henholdsvis TRS- og DCS-modulerne. Monteringsproceduren er ikke tidskrævende, da moderne processorer bruger standardmodeller af et semi-uendeligt, homogent medium. De erhvervede parametre maler ikke det komplette billede af endotelfunktionen. Imidlertid har reaktiv hyperæmi målt vist prognostisk værdi ved flere akutte tilstande, hvor endotelsvækkelse spiller en stor rolle, såsom septisk shock eller COVID-19. 6,28 Protokollen indeholder også en automatiseret kvalitetskontrol, der registrerer enhedsparametrene, som er nyttige til en forskningsprotokol, hvis der senere opdages en uforklarlig anomali i en patients data.
Kvantificeringen af det overliggende fedtlag og armomkredsen er vigtig under måling af brachioradialis-musklen i denne protokol, da fotonerne primært passerer gennem det overliggende væv, når de injiceres, og når de detekteres. Det er velkendt i diffus optik, at der er en tilhørende partiel volumeneffekt. Derfor bør de overfladiske oplysninger registreres og anvendes ved analyse af dataene for at tage højde for effekten af variationer i fedtvæv46,47. Dette forstærkes yderligere i disse patientpopulationer af interesse, da det er almindeligt hos ICU-patienter at udvikle ødem, hvor lemmerne er hævede, da vand er fanget på grund af immobilisering og andre grunde48. Hos sådanne patienter kan variationen i omkreds under ICU-ophold give information om sværhedsgraden af ødem. Vejen for lyskilden, der når detektorerne, skal passere gennem alle de overfladiske lag.
Manchetten skal være komfortabelt viklet rundt om armen og sikre en tæt pasform. Det er dog vigtigt at undgå overdreven tæthed, der kan udøve overdreven pres på armen udelukkende ved at pakke manchetten49. Målet er at opnå en sikker og behagelig pasform uden at forårsage unødvendig kompression, hvilket kan ændre baseline hæmodynamiske parametre. Hvis det komprimerer armen, kompromitteres datakvaliteten for hele protokollen, og det udøvede tryk tilføjes effektivt til VOT-måltrykket. Hvis manchetten er løst viklet til armen, kræves der mere luft for at nå måltrykket, og der vil derfor blive taget mere tid. Dette kan give tid til væv til justering af fysiologi, da iltforsyningen reduceres langsomt, hvilket bør undgås50.
Det er vigtigt at fastgøre den smarte sonde på en måde, der opretholder korrekt kontakt uden at udøve for stort pres på vævet. Dette giver mulighed for pålidelige målinger, samtidig med at risikoen for lokal iskæmi undgås. Lokal iskæmi opstår, når blodgennemstrømningen til området er begrænset, hvilket fører til kompromitteret cirkulation og potentielt ødelægger målingerne51.
Den kapacitive berøringssensor på sonden bruges af lasersikkerhedssystemet til at sikre, at laseren kun skinner, når sonden er fastgjort til vævet. Hvis patienten har høj hårtæthed på armen, kan berøringssensorens følsomhed kompromitteres. Anvendelsen af et tyndt gennemsigtigt dobbeltbånd på sondens sensorside kan effektivt afbøde berøringssensorproblemet. Når sonden er fastgjort til den behårede arm sammen med dette bånd, giver det et pålideligt og stabilt berøringssignal. Foruddefinerede snit af dette bånd er tilgængelige for den smarte sonde med adskillelse mellem lyskilder og detektorer. Adskillelsen er afgørende for at forhindre dannelsen af en direkte lyskanal mellem kilde- og detektorvinduer, hvilket kan påvirke målingernes kvalitet. Brugen af gennemsigtig dobbelttape fungerer som en praktisk løsning til at forbedre pålideligheden af berøringsregistrering under disse omstændigheder. Hvis berøringssensoren går tabt under protokollen, slukker den laserne, og målingen går tabt. Sonden har også en belastningssensor, som i fremtiden kan bruges som en backup-sikkerhedsforanstaltning.
Hvis patienten bevæger armen, eller et lille klinisk indgreb forstyrrer stabiliteten af erhvervede signaler i baselinefasen, hvilket resulterer i skarpe toppe, anbefales det at bruge udvidelsesfunktionen. Denne funktion giver mulighed for at opnå en stabil baseline i tre minutter, hvilket sikrer ensartet og pålidelig signalmåling.
Det er vigtigt at overveje, at patientens blodtryk kan undergå betydelige ændringer efter påbegyndelse af protokollen, hvilket kan påvirke evnen til at nå måltrykket på 50 mmHg højere end det systoliske blodtryk for VOT. Disse udsving i blodtrykket kan påvirkes af forskellige faktorer, såsom patientens fysiologiske respons, medicinvirkninger eller andre kliniske tilstande52. Derfor bør måltrykket justeres ved om nødvendigt at trykke på “+” eller “-” knapperne for at sikre ensartet administration af VOT.
Den typiske udførelse af VOT har begrænsninger på grund af operatørvariabilitet, som behandles i denne protokol ved at have en automatisk VOT. Vi bruger strategien til at indstille okklusionstrykket på 50 mmHg over det systoliske blodtryksniveau. Denne metode stopper blodgennemstrømningen og er blevet rapporteret i tidligere undersøgelser for udførelse af VOT 53,54. Det individualiserede måltryk for VOT i denne protokol hjælper med at undgå vasokonstriktion, der kan ske ved at fastsætte et generelt måltryk for VOT. Smerter forårsaget af et unødvendigt højt tryk kan påvirke målingen, der forårsager vasokonstriktion, f.eks. hos en patient med systolisk tryk på 120 mmHg og måltryk på 200 mmHg eller 250 mmHg29. Vi bemærker, at patienter indlagt på intensivafdelinger står over for en øget risiko for trombose, primært på grund af faktorer som langvarig immobilitet og sedation55. Dette indebærer, at denne protokol ikke kan anvendes til patienter, der lider af trombose eller tromboflebitis, for at undgå risici.
Anvendelsen af denne protokol kan være nyttig i ICU-populationen, hvor nedsat reaktiv hyperæmi er et fælles træk og kan bidrage til mikrovaskulære abnormiteter 3,56. De parametre, der er erhvervet i denne protokol, uden operatørinterventioner under målingen, er tidligere blevet anvendt i litteraturen enkeltvis eller i en lille kombination for sepsis, kræft, slagtilfælde osv. for at skelne patologiske tilstande 1,11,15,31. Derfor mener vi, at kombinationen af disse relevante parametre er gavnlig for flere kliniske anvendelser. De data, der registreres af denne protokol, kan hjælpe med at vælge passende terapeutiske strategier til forbedring af vaskulær sundhed57. Den værdifulde indsigt i vævets iltning og blodgennemstrømningsdynamik under okklusion og reperfusion giver os mulighed for at vurdere tilstrækkeligheden af blodforsyningen til vitale organer. Det kan hjælpe med at identificere vævshypoxi og vejlede interventioner for at optimere organperfusion58. Ved at bruge realtidsinformation om mikrovaskulær iltning og reaktiv hyperæmi hjælper det som et ekstra værktøj til at styre hæmodynamisk styring, væskegenoplivning og vasopressorbehandling59,60. Dette sikrer, at interventionerne skræddersys til individuelle patientbehov, hvilket optimerer vævets iltning og perfusion61,62. Desuden kan evolutive ændringer i mikrovaskulær iltning og blodgennemstrømning inden for et spontant vejrtrækningsforsøg hos mekanisk ventilerede patienter være af største betydning, når man vurderer den kardiovaskulære tolerance for at imødekomme og overvinde den øgede metaboliske byrde, der stammer fra arbejdet med at trække vejret uden hjælp2. På den baggrund er en daglig kritisk og udfordrende beslutning for intensivpatienterne om mekanisk ventilation fravænningsprocessen, som slutter, når patienten anses for at være i stand til at trække vejret selv, og endotrakealrøret fjernes. Den langsgående anvendelse af denne protokol kan bruges til at evaluere effektiviteten af interventioner, spore sygdomsprogression og vejlede behandlingsstrategier.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denne forskning blev finansieret af Fundació CELLEX Barcelona, Fundació Mir-Puig, Ajuntament de Barcelona, Agencia Estatal de Investigación (PHOTOMETABO, PID2019-106481RB-C31/10.13039/501100011033), “Severo Ochoa”-programmet for ekspertisecentre inden for F&U (CEX2019-000910-S), Generalitat de Catalunya (CERCA, AGAUR-2017-SGR-1380, RIS3CAT-001-P-001682 CECH), FEDER EC, Fundacion Joan Ribas Araquistain, l’FCRI (Convocatòria Joan Oró 2023), Europa-Kommissionen Horizon 2020 (tilskud nr. 101016087 (VASCOVID), 101017113(TinyBrains), 871124 (LASERLAB-EUROPE V), 101062306 (Marie Skłodowska-Curie)), Fundació La Marató de TV3 (2017,2020) og specialprogrammerne LUX4MED/MEDLUX.
Materials
| Alcohol swabs | No specific | N/A | For cleaning the probes and cuff after measurement |
| Black cloth | No specific | N/A | For blocking ambient light |
| Blood pressure monitor | OMRON | N/A | Hopital ICU equipment or off the shelf product |
| Body fat Calliper | Healifty | 3257040-6108-1618385551 | For measuring the fat layer |
| Examination gloves | No specific | N/A | To be used for interacting with patients |
| Kintex tape | No specific | N/A | For attaching the probe on arm |
| Koban wrap | No specific | N/A | For attaching the probe on arm |
| Measuring tape | YDM Industries | 25-SB-30-150V3-19-1 | For measuring the arm circumference |
| Scissors | No specific | N/A | for cutting tapes |
| VASCOVID precommercial prototype | VASCOVID consortium | N/A | Integrated at ICFO |
References
- Mesquida, J., Masip, J., Gili, G., Artigas, A., Baigorri, F. Thenar oxygen saturation measured by near infrared spectroscopy as a noninvasive predictor of low central venous oxygen saturation in septic patients. Intensive Care Medicine. 35, 1106-1109 (2009).
- Mesquida, J., et al. Thenar oxygen saturation (StO2) alterations during a spontaneous breathing trial predict extubation failure. Annals of Intensive Care. 10 (1), 1-7 (2020).
- Mikacenic, C., et al. Biomarkers of endothelial activation are associated with poor outcome in critical illness. PloS One. 10 (10), e0141251 (2015).
- Varga, Z., et al. Endothelial cell infection and endotheliitis in COVID-19. The Lancet. 395 (10234), 1417-1418 (2020).
- Castro, P., et al. Is the endothelium the missing link in the pathophysiology and treatment of COVID-19 complications. Cardiovascular Drugs and Therapy. 36 (3), 547-560 (2022).
- Mesquida, J., et al. Peripheral microcirculatory alterations are associated with the severity of acute respiratory distress syndrome in COVID-19 patients admitted to intermediate respiratory and intensive care units. Critical Care. 25, 1-10 (2021).
- Fernández, S., et al. Distinctive biomarker features in the endotheliopathy of COVID-19 and septic syndromes. Shock (Augusta, Ga). 57 (1), 95 (2022).
- Sakr, Y., Dubois, M. J., De Backer, D., Creteur, J., Vincent, J. L. Persistent microcirculatory alterations are associated with organ failure and death in patients with septic shock). Critical Care Medicine. 32 (9), 1825-1831 (2004).
- Trzeciak, S., et al. Early microcirculatory perfusion derangements in patients with severe sepsis and septic shock: relationship to hemodynamics, oxygen transport, and survival. Annals of Emergency Medicine. 49 (1), 88-98 (2007).
- Tachon, G., et al. Microcirculatory alterations in traumatic hemorrhagic shock. Critical Care Medicine. 42 (6), 1433-1441 (2014).
- Duranteau, J., et al. The future of intensive care: the study of the microcirculation will help to guide our therapies. Critical Care. 27 (1), 1-13 (2023).
- Mason McClatchey, P., et al. Impaired tissue oxygenation in metabolic syndrome requires increased microvascular perfusion heterogeneity. Journal of Cardiovascular Translational Research. 10 (1), 69-81 (2017).
- Gurley, K., Shang, Y., Yu, G. Noninvasive optical quantification of absolute blood flow, blood oxygenation, and oxygen consumption rate in exercising skeletal muscle. Journal of Biomedical Optics. 17 (7), 075010 (2012).
- Lin, P. Y., et al. Non-invasive optical measurement of cerebral metabolism and hemodynamics in infants. Journal of Visualized Experiments. (73), e4379 (2013).
- Cortese, L., et al. The LUCA device: a multi-modal platform combining diffuse optics and ultrasound imaging for thyroid cancer screening. Biomedical Optics Express. 6 (6), 3392-3409 (2021).
- Durduran, T., Yodh, A. G. Diffuse correlation spectroscopy for non-invasive, micro-vascular cerebral blood flow measurement. Neuroimage. 85, 51-63 (2014).
- Hong, K. S., Yaqub, M. A. Application of functional near-infrared spectroscopy in the healthcare industry: A review. Journal of Innovative Optical Health Sciences. 12 (06), 1930012 (2019).
- Torricelli, A., et al. Time domain functional NIRS imaging for human brain mapping. Neuroimage. 85, 28-50 (2014).
- Tremblay, J. C., King, T. J. Near-infrared spectroscopy: can it measure endothelial function. Experimental Physiology. 101 (11), 1443-1444 (2016).
- Cortese, L., et al. Performance assessment of a commercial continuous-wave near-infrared spectroscopy tissue oximeter for suitability for use in an international, multi-center clinical trial. Sensors. 21 (21), 6957 (2021).
- Contini, D., et al. Multi-channel time-resolved system for functional near infrared spectroscopy. Optics Express. 14 (12), 5418-5432 (2006).
- Lacerenza, M., et al. Wearable and wireless time-domain near-infrared spectroscopy system for brain and muscle hemodynamic monitoring. Biomedical Optics Express. 11 (10), 5934-5949 (2020).
- Lacerenza, M., et al. Performance and reproducibility assessment across multiple time-domain near-infrared spectroscopy device replicas. Design and Quality for Biomedical Technologies XV – SPIE. 11951, 43-48 (2022).
- Durduran, T., Choe, R., Baker, W. B., Yodh, A. G. Diffuse optics for tissue monitoring and tomography. Reports on Progress in Physics. 73 (7), 076701 (2010).
- Boas, D. A., Campbell, L. E., Yodh, A. G. Scattering and imaging with diffusing temporal field correlations. Physical Review Letters. 75 (9), 1855 (1995).
- Giovannella, M., et al. BabyLux device: a diffuse optical system integrating diffuse correlation spectroscopy and time-resolved near-infrared spectroscopy for the neuromonitoring of the premature newborn brain. Neurophotonics. 6 (2), 025007-025007 (2019).
- Amendola, C., et al. A compact multi-distance DCS and time domain NIRS hybrid system for hemodynamic and metabolic measurements. Sensors. 21 (3), 870 (2021).
- Mesquida, J., Gruartmoner, G., Espinal, C. Skeletal muscle oxygen saturation (StO2) measured by near-infrared spectroscopy in the critically ill patients. BioMed Research International. (2013), (2013).
- Gerovasili, V., Dimopoulos, S., Tzanis, G., Anastasiou-Nana, M., Nanas, S. Utilizing the vascular occlusion technique with NIRS technology. International Journal of Industrial Ergonomics. 40 (2), 218-222 (2010).
- Siafaka, A., et al. Acute effects of smoking on skeletal muscle microcirculation monitored by near-infrared spectroscopy. Chest. 131 (5), 1479-1485 (2007).
- Donati, A., et al. Near-infrared spectroscopy for assessing tissue oxygenation and microvascular reactivity in critically ill patients: a prospective observational study. Critical Care. 20, 1-10 (2016).
- Iannetta, D., et al. Reliability of microvascular responsiveness measures derived from near-infrared spectroscopy across a variety of ischemic periods in young and older individuals. Microvascular Research. 122, 117-124 (2019).
- Niezen, C. K., Massari, D., Vos, J. J., Scheeren, T. W. L. The use of a vascular occlusion test combined with near-infrared spectroscopy in perioperative care: a systematic review. Journal of Clinical Monitoring and Computing. 36 (4), 933-946 (2022).
- Donati, A., et al. Recombinant activated protein C treatment improves tissue perfusion and oxygenation in septic patients measured by near-infrared spectroscopy. Critical Care. 5 (5), 1-7 (2009).
- Neto, A. S., et al. Association between static and dynamic thenar near-infrared spectroscopy and mortality in patients with sepsis: a systematic review and meta-analysis. Journal of Trauma and Acute Care Surgery. 76 (1), 226-233 (2014).
- Shapiro, N. I., et al. The association of near-infrared spectroscopy-derived tissue oxygenation measurements with sepsis syndromes, organ dysfunction and mortality in emergency department patients with sepsis. Critical Care. 15 (5), 1-10 (2011).
- Orbegozo, D., et al. Peripheral muscle near-infrared spectroscopy variables are altered early in septic shock. Shock. 50 (1), 87-95 (2018).
- Lu, S., et al. Comparison of COVID-19 induced respiratory failure and typical ARDS: similarities and differences. Frontiers in Medicine. 9, 829771 (2022).
- Parežnik, R., Knezevic, R., Voga, G., Podbregar, M. Changes in muscle tissue oxygenation during stagnant ischemia in septic patients. Intensive Care Medicine. 32, 87-92 (2006).
- Nanas, S., et al. Inotropic agents improve the peripheral microcirculation of patients with end-stage chronic heart failure. Journal of Cardiac Failure. 14 (5), 400-406 (2008).
- International electrical equipment – IEC. Medical electrical equipment – Part 2-22: Particular requirements for basic safety and essential performance of surgical, cosmetic, therapeutic and diagnostic laser equipment. International electrical equipment – IEC. , (2019).
- Cortese, L., et al. Recipes for diffuse correlation spectroscopy instrument design using commonly utilized hardware based on targets for signal-to-noise ratio and precision. Biomedical Optics Express. 12 (6), 3265-3281 (2021).
- Zhou, C., et al. Diffuse optical correlation tomography of cerebral blood flow during cortical spreading depression in rat brain. Optics Express. 14 (3), 1125-1144 (2006).
- Selb, J., et al. Sensitivity of near-infrared spectroscopy and diffuse correlation spectroscopy to brain hemodynamics: simulations and experimental findings during hypercapnia. Neurophotonics. 1 (1), 015005-015005 (2014).
- Amendola, C., et al. Assessment of power spectral density of microvascular hemodynamics in skeletal muscles at very low and low-frequency via near-infrared diffuse optical spectroscopies. Biomedical Optics Express. 14 (11), 5994-6015 (2023).
- Craig, J. C., Broxterman, R. M., Wilcox, S. L., Chen, C., Barstow, T. J. Effect of adipose tissue thickness, muscle site, and sex on near-infrared spectroscopy derived total-[hemoglobin+ myoglobin]. Journal of Applied Physiology. 123 (6), 1571-1578 (2017).
- Nasseri, N., Kleiser, S., Ostojic, D., Karen, T., Wolf, M. Quantifying the effect of adipose tissue in muscle oximetry by near infrared spectroscopy. Biomedical Optics Express. 7 (11), 4605-4619 (2016).
- Ahmadinejad, M., Razban, F., Jahani, Y., Heravi, F. Limb edema in critically ill patients: Comparing intermittent compression and elevation. International Wound Journal. 19 (5), 1085-1091 (2022).
- Van Vo, T., Hammer, P. E., Hoimes, M. L., Nadgir, S., Fantini, S. Mathematical model for the hemodynamic response to venous occlusion measured with near-infrared spectroscopy in the human forearm. IEEE Transactions on Biomedical Engineering. 54 (4), 573-584 (2007).
- Junejo, R. T., Ray, C. J., Marshall, J. M. Cuff inflation time significantly affects blood flow recorded with venous occlusion plethysmography. European Journal of Applied Physiology. 119, 665-674 (2019).
- Baker, W. B., et al. Pressure modulation algorithm to separate cerebral hemodynamic signals from extracerebral artifacts. Neurophotonics. 3 (3), 035004-035004 (2015).
- Martirosov, A. L., et al. Improving transitions of care for critically ill adult patients on pulmonary arterial hypertension medications. American Journal of Health-System Pharmacy. 77 (12), 958-965 (2020).
- Bezemer, R., Lima, A., Klijn, E., Bakker, J., Ince, C. Assessment of tissue oxygen saturation during a vascular occlusion test using near-infrared spectroscopy: Role of the probe spacing and measurement site studied in healthy volunteers. Critical Care. (13), 1-2 (2009).
- Futier, E., et al. Use of near-infrared spectroscopy during a vascular occlusion test to assess the microcirculatory response during fluid challenge. Critical Care. (15), 1-10 (2011).
- Attia, J. R., et al. Deep vein thrombosis and its prevention in critically ill adults. Archives of Internal Medicine. 161 (10), 1268-1279 (2001).
- Reinhart, K., Bayer, O., Brunkhorst, F., Meisner, M. Markers of endothelial damage in organ dysfunction and sepsis. Critical Care Medicine. 30 (5), S302-S312 (2002).
- Georger, J. F., et al. Restoring arterial pressure with norepinephrine improves muscle tissue oxygenation assessed by near-infrared spectroscopy in severely hypotensive septic patients. Intensive Care Medicine. 36, 1882-1889 (2010).
- Lipcsey, M., Woinarski, N. C., Bellomo, R. Near infrared spectroscopy (NIRS) of the thenar eminence in anesthesia and intensive care. Annals of Intensive Care. 2 (1), 1-9 (2012).
- Kazune, S., Caica, A., Luksevics, E., Volceka, K., Grabovskis, A. Impact of increased mean arterial pressure on skin microcirculatory oxygenation in vasopressor-requiring septic patients: an interventional study. Annals of Intensive Care. 9 (1), 1-10 (2019).
- Lima, A., van Bommel, J., Jansen, T. C., Ince, C., Bakker, J. Low tissue oxygen saturation at the end of early goal-directed therapy is associated with worse outcome in critically ill patients. Critical Care. 13 (5), 1-7 (2009).
- Rogers, C. A., et al. Randomized trial of near-infrared spectroscopy for personalized optimization of cerebral tissue oxygenation during cardiac surgery. BJA: British Journal of Anaesthesia. 119 (3), 384-393 (2017).
- Jozwiak, M., Chambaz, M., Sentenac, P., Monnet, X., Teboul, J. L. Assessment of tissue oxygenation to personalize mean arterial pressure target in patients with septic shock. Microvascular Research. 132, 104068 (2020).

