중환자 치료를 위한 하이브리드, 근적외선 확산 광학 분광법을 사용한 미세혈관 산소화 및 반응성 충혈의 비침습적 모니터링
Summary
근적외선 확산 광학을 기반으로 하는 다중 모드 장치를 사용하여 절대 미세혈관 혈류 지수와 혈중 산소 포화도를 비침습적으로 지속적으로 측정하는 프로토콜을 설명합니다. 그런 다음 혈관 폐색 검사를 사용하여 산소 소비량과 반응성 충혈의 대사율을 평가합니다.
Abstract
미세혈관 산소 소비량과 반응성 충혈의 손상 수준을 감지하는 것은 중환자 치료에서 매우 중요합니다. 그러나 강력하고 정량적인 평가를 위한 실용적인 수단은 없습니다. 이 백서에서는 하이브리드 근적외선 확산 광학 장치를 사용하여 이러한 손상을 평가하는 프로토콜에 대해 설명합니다. 이 장치에는 근적외선, 시간 분해 및 확산 상관 분광법과 펄스 산소 측정을 위한 모듈이 포함되어 있습니다. 이 모듈을 사용하면 말초 동맥 산소 포화도(SpO2)와 함께 절대 미세혈관 혈액/조직 산소 포화도(StO2) 및 혈류 지수(BFI)를 비침습적이고 연속적으로 실시간으로 측정할 수 있습니다. 이 장치는 통합된 컴퓨터 제어 지혈대 시스템을 사용하여 상완 근육에서 광학 데이터를 수집하여 표준화된 프로토콜을 실행합니다. 표준화된 혈관 폐색 검사(VOT)는 문헌에 보고된 교합 기간과 압력의 변화를 처리하는 동시에 자동화는 작업자 간 차이를 최소화합니다. 우리가 설명하는 프로토콜은 3분 교합 기간에 초점을 맞추지만 이 논문에 설명된 세부 사항은 다른 지속 시간과 커프 압력 및 다른 근육에 쉽게 적용할 수 있습니다. 확장된 기준선 및 폐색 후 회복 기간 측정을 포함하면 모든 매개변수에 대한 기준선 값과 산소 소비량의 대사율에 해당하는 혈액/조직 탈산소화 속도를 정량화할 수 있습니다. 커프가 풀리면 BFI 및 StO2에서 조직 재산소화 속도, 크기 및 충혈 반응의 지속 기간을 특성화합니다. 이러한 후자의 매개변수는 내피 기능에 대한 정보를 제공하는 반응성 충혈의 정량화에 해당합니다. 또한, 위에서 언급한 산소화 및 탈산소화 헤모글로빈의 절대 농도, BFI, 산소 소비량의 파생 대사율, StO2 및 SpO2 측정은 질병 중증도, 맞춤형 치료 및 관리 개입을 나타낼 수 있는 아직 탐색되지 않은 풍부한 데이터 세트를 제공합니다.
Introduction
중증 환자, 특히 패혈증 및 기타 유사한 질환을 앓고 있는 환자는 반응성 충혈 및 미세혈관 산소화 장애가 있는 경우가 많다 1,2,3. COVID-19 팬데믹의 첫 번째 물결 동안 예상치 못한 수의 환자가 집중 치료 관리가 필요했으며, 이 기간 동안 바이러스가 내피에 미치는 영향이 분명해졌지만 4,5,6을 평가하고 관리하기 위한 명확한 전략이 없었습니다. 그 결과, 중환자실(ICU) 환자군에서 반응성 충혈에 의해 간접적으로 평가될 수 있는 내피 기능 장애를 감지하는 것의 중요성에 대한 인식이 높아지고 있다7. 조직으로의 산소 전달 및 소비에 대한 실용적이고 강력하며 널리 이용 가능한 평가는 소생술 전략을 최적화하고 미세 순환 문제를 직접 해결하는 데 가장 중요할 것으로 예상됩니다. 여러 연구에 따르면 지속적인 미세순환 변화와 거시순환과 미세순환 사이의 일관성 부족은 전신 매개변수가 정상으로 간주되는 경우에도 패혈성 쇼크 또는 출혈성 쇼크의 영향을 받는 환자에서 장기 부전과 바람직하지 않은 결과를 어느 정도 예측할 수 있습니다 8,9,10. 미세순환은 조직의 산소화와 장기 기능에 중요한 역할을 하기 때문에 거시순환 매개변수에만 의존하는 것은 부적절하다는 것이 분명해졌다 11,12,13. 이 백서는 ICU 환자에 중점을 둔 국제 컨소시엄 내에서 개발된 근적외선 확산 광학 기술을 기반으로 하는 새로운 다중 모드 장치를 사용하는 프로토콜에 대해 설명합니다. VASCOVID(https://vascovid.eu) 프로젝트는 COVID-19 팬데믹을 계기로 중환자실에서 말초 근육의 미세혈관 건강을 평가하기 위해 시작되었습니다. 우리는 이러한 매개변수에 대한 이해를 높이고 이러한 매개변수가 COVID-19 환자보다 훨씬 더 넓은 범위의 중증 환자를 관리하는 데 어떻게 유용할 수 있는지에 대한 이해를 높이는 것을 목표로 개발된 VASCOVID 장치를 사용하여 프로토콜을 설계했습니다.
근적외선 분광법(NIRS)은 ICU 환자를 포함한 광범위한 임상 응용 분야에서 수십 년 동안 비침습적으로 미세 순환을 평가하는 데 활용되어 왔습니다 14,15,16,17. NIRS의 가장 간단한 응용, 즉 연속파 NIRS(CW-NIRS)는 미세혈관의 혈액/조직 산소 포화도(StO2)를 계산하기 위해 옥시-(HbO) 및 데옥시-헤모글로빈(HbR)의 절대 농도를 측정하기 위해 널리 사용되고 임상적으로 승인된 장치(17,18)에서 구현된다는 것을 주목하는 것이 중요하다. 이러한 장치는 심장 수술과 같은 임상 관리에서 틈새 시장을 찾았지만 조직의 광자 전파 물리학으로 인해 분명한 한계가 있습니다. 이것은 정확성, 정밀도 및 반복성이 의심스럽다는 것을 의미하며, 따라서 종종 추세 모니터로 활용됩니다19,20. 또한, 그 결과는 겹쳐진 지방층 및 피부층과 같은 표면 조직의 영향을 크게 받습니다.
시간-분해 NIRS(TRS)는 조직(21)을 통과한 후의 지연 및 넓어짐을 평가하기 위해 다중 파장에서 피코초 범위의 짧은 레이저 펄스를 사용한다. 이를 통해 TRS는 흡수 효과와 산란을 분리하여 강력하고 정확하며 정밀한 추정치를 얻을 수 있으며 총 헤모글로빈 농도(HbT)도 계산할 수 있습니다. TRS는 또한 경로 길이를 분해하기 때문에, 관심 있는 심층 신호로부터 표면 신호를 더 잘 분리하는데 이용될 수 있다 18,21. 이로 인해 복잡성, 가격 및 부피가 커집니다. 그러나 최근 몇 년 동안 TRS 시스템의 복잡성과 비용이 낮아져 더 접근하기 쉽고 사용하기 쉬운 장치가 되었습니다. 이 원고는 소형 OEM(Original Equipment Manufacturer) 상용 TRS 모듈(22,23)을 사용하는 장치를 설명합니다.
확산 상관 분광법(DCS)은 확산 스페클의 시간 통계를 활용하여 조직16,24에서 적혈구가 지배하는 광 산란 입자의 움직임을 정량화하는 또 다른 근적외선 기술입니다. 이것은 차례로 미세혈관 혈류의 지표로 잘 알려져 있으며, 이를 혈류 지수(BFI)25라고 합니다. 하이브리드 광학 장치에서 TRS와 DCS를 동시에 사용하면 공통 모델을 활용하여 국소 산소 추출 분율을 도출하고 혈류를 곱하여 산소 대사에 대한 통찰력을 얻을 수 있습니다 15,26,27.
중환자실에서 미세순환을 평가하기 위해 NIRS는 종종 혈관 폐색 검사(VOT)와 함께 사용되는데, 이는 특정 기간(몇 분) 동안 조사된 말초 근육으로의 혈액 공급을 차단하여 수행되는 허혈성 검사입니다28,29,30,31,32. 가장 일반적으로, 수축기 압력(33) 위의 상완을 감싸는 지혈대를 팽창시킴으로써 실행된다. VOT 동안, 임상의는 혈류의 변화에 대한 미세혈관 혈액 산소화의 반응을 평가하여 휴식 시 산소대사 및 반응성 충혈을 도출한다34. VOT 중에는 커프가 사지 교합 압력보다 훨씬 높게 부풀어 오르면 혈액의 유입 또는 유출이 없다고 가정합니다. 따라서 VOT의 시작은 산소가 조직에 의해 소비됨에 따라 StO2 의 하향 기울기, 즉 탈산소화 (DeO2 )를 보여 주며, 이는 산소 소비의 대사 속도를 추정 할 수 있습니다. VOT가 끝나고 커프의 공기가 빠지면 고갈을 보상하기 위해 혈액이 몰려와 충혈 반응이 일어납니다. 이 러시는 StO2 에서 급격한 상향 경사, 즉 재산소화 (ReO2 )를 생성합니다. 초기 기준선을 넘어 증가하여 기준선으로 회복되는 속도가 느린 충혈 반응은 반응성 충혈을 추정합니다. NIRS와 VOT의 조합은 패혈증35,36,37과 같은 심각한 상태에서 부작용 및 사망률을 예측할 수 있는 가능성과 사용 편의성으로 인해 집중 치료에 대한 관심이 높아지고 있습니다.
COVID-19 팬데믹 기간 동안 우리 그룹은 전 세계 컨소시엄을 시작했고 최근 COVID-19 환자에서 말초 미세 순환 변화와 급성 호흡곤란 증후군의 중증도 사이의 연관성을 보여주는 이른바 HEMOCOVID-19 시험을 완료했습니다6. 이것은 다른 작품들에서도 뒷받침되었다 7,38. 이 모든 연구는 위에서 언급 한 CW-NIRS 시스템으로 수행되었으므로 단점이 있습니다. 더욱이, VOT의 실행은 다른 연구에서 표준화되지 않았으며, 교합 기간, 지혈대 압력 및 작업자 기반 변형과 같은 다양한 매개변수의 영향을 받는다 29,39,40. 문헌 검토에 따르면 VOT와 NIRS가 임상에서 견인력을 얻기 위해서는 혈류를 측정하고, 표준화된 프로토콜을 갖추고, 강력한 NIRS 시스템을 갖추는 것이 중요하다는 것을 분명히 알 수 있다11. 따라서 우리는 보다 발전된 형태의 NIRS(TRS)를 활용하고, 혈류를 측정하고, VOT 중 커프 제어를 표준화함으로써 병리학적 상태와 건강한 상태를 더 잘 구별할 수 있다고 제안했습니다. 이를 위해 우리는 TRS 및 DCS의 두 가지 근적외선 확산 광 모듈, 맥박 산소 측정 및 자동 지혈대를 포함하는 여러 모듈을 통합하는 이 하이브리드 확산 광학 장치를 개발했습니다. 맥박 산소 측정 모듈은 심박수(HR), 관류 지수 및 백분율을 제공합니다.tage 동맥 산소 포화도(SpO2). 장치에 빠른 지혈대가 사용되며, 이는 VOT를 수행하는 데 매우 중요합니다. 이 장치에는 TRS용 기기 응답 함수(IRF)의 일상적이고 실용적인 측정 및 종방향 안정성 평가를 위한 조직 모방 팬텀에서의 측정과 같은 확장되고 지속적인 품질 관리를 위해 사용 중에 추가 정보를 얻을 수 있는 액세서리 상자(옵션)가 함께 제공됩니다. 이 장치는 그림 1의 ICU에서 사용되는 것으로 표시됩니다.
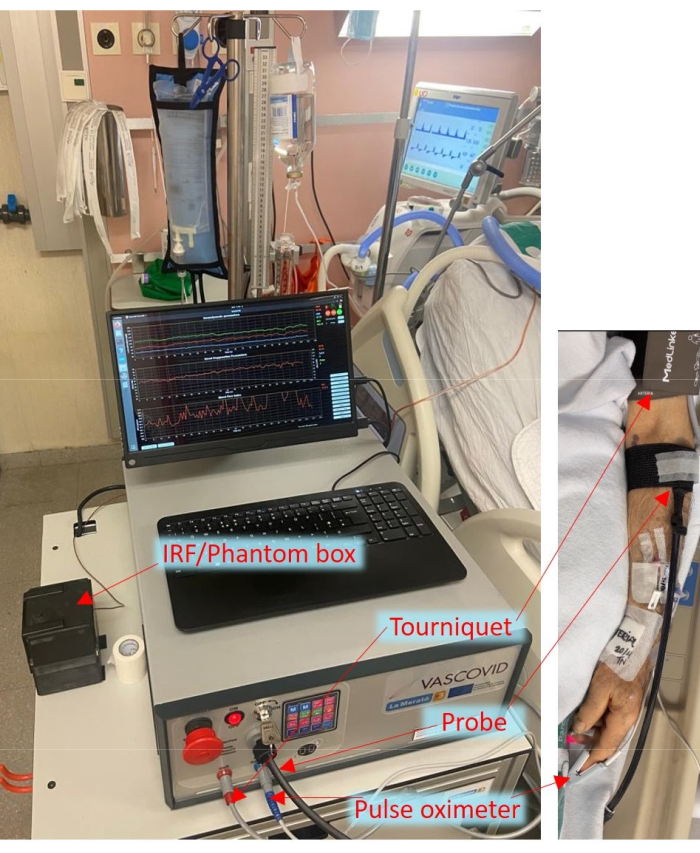
그림 1: 환자에게 부착된 프로브와 커프가 있는 ICU의 휴대용 장치 침대 옆 배치. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
멀티모달 스마트 프로브는 TRS 및 DCS용 소스 및 검출기 광섬유를 DCS와 TRS 간의 간섭을 방지하는 장치 내부의 광학 필터와 통합합니다. 이 시스템에 사용되는 소스-검출기 간격은 25mm입니다. 또한 이 프로브에는 정전식 터치 센서가 통합되어 있어 레이저 안전 표준(IEC 60601-2-22:2019)41에 따라 레이저 위험을 방지하는 중요한 안전 기능을 제공합니다. 장치 내의 레이저 안전 시스템은 프로브가 조직과 접촉할 때만 레이저 방출이 발생하도록 합니다. 프로브의 분리가 감지되면 레이저가 즉시 꺼져 환자와 작업자 모두의 안전을 보장합니다. 또한 프로브는 추가 기능 및 데이터 수집 목적을 위해 가속도계, 부하 센서 및 광 센서와 통합됩니다.
이 논문은 개발된 장치를 사용하여 VOT와 동시에 상완근을 조사하는 자동화된 프로토콜에 대해 설명합니다. 프로토콜 타임라인은 그림 2에 나와 있습니다. 프로토콜은 완전히 자동화되어 있으며 실행 전반에 걸쳐 운영자의 개입이 필요하지 않습니다. 이 새로운 장치의 기능을 활용하여 의사가 말초 산소 소비의 생리병리학을 더 잘 이해하고 산소 소비량과 전달 비율을 평가하여 환자 치료를 포괄적이고 효율적으로 개선할 수 있도록 하는 귀중한 통찰력을 얻는 것을 목표로 합니다.
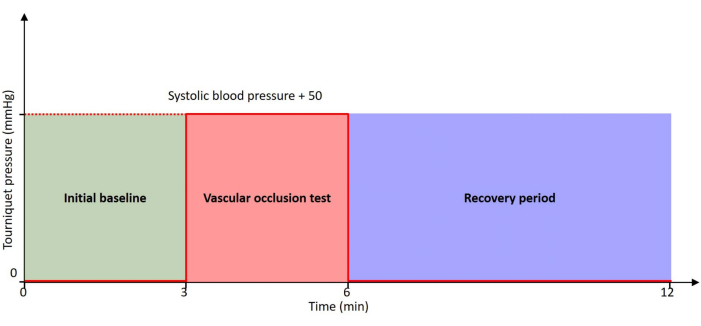
그림 2: 프로토콜 타임라인. 환자는 초기 기준선 및 회복 기간에 0mmHg 압력으로 타임라인 전반에 걸쳐 휴식을 취합니다. VOT는 환자의 수축기 혈압보다 50mmHg 높은 압력으로 부풀린 지혈대로 수행됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
당사는 미세혈관 산소화, 혈액 관류 및 반응성 충혈을 평가하기 위해 하이브리드 확산 광학을 사용하여 골격근의 지속적인 측정 및 모니터링을 위한 완전 자동화되고 견고한 비침습적 장치를 시연했습니다. VASCOVID 장치와 함께 이 프로토콜을 사용하여 HbO, HbR 및 HbT의 절대 혈류역학적 매개변수를 동시에 측정할 수 있습니다. StO2 및 SpO2 로부터의 산소 포화도; DeO2 및 ReO2; 및 BFI. 표시된 실시간 StO2 및 BFI는 각각 TRS 및 DCS 모듈에서 이전 초의 원시 데이터에서 얻습니다. 최신 프로세서는 반무한의 균질한 매체의 표준 모델을 사용하기 때문에 피팅 절차는 시간이 많이 걸리지 않습니다. 획득한 매개변수는 내피 기능의 완전한 그림을 그리지 않습니다. 그러나 측정된 반응성 충혈은 패혈성 쇼크나 COVID-19와 같이 내피 손상이 중요한 역할을 하는 여러 급성 질환에서 예후 가치를 입증했습니다. 6,28 이 프로토콜은 또한 장치 매개변수를 기록하는 자동화된 품질 검사를 통합하며, 이는 나중에 환자의 데이터에서 설명할 수 없는 이상이 감지되는 경우 연구 프로토콜에 유용합니다.
중첩 지방층과 팔 둘레의 정량화는 이 프로토콜에서 상완근을 측정하는 동안 중요한데, 이는 광자가 주입될 때와 검출될 때 주로 중첩 조직을 통과하기 때문입니다. 확산 광학에서 관련된 부분 부피 효과가 있다는 것은 잘 알려져 있습니다. 그러므로, 피상적인 정보는 지방 조직에서의 변이의 영향을 설명하기 위해 데이터를 분석할 때 기록되고 활용되어야 한다46,47. 이는 ICU 환자에서 고정성 및 기타 이유로 인해 물이 고여 팔다리가 부어오르는 부종이 발생하는 것이 일반적이기 때문에 이러한 관심 환자 집단에서 더욱 증폭된다48. 이러한 환자의 경우 중환자실 입원 중 둘레의 변화는 부종의 중증도에 대한 정보를 제공할 수 있습니다. 검출기에 도달하는 광원의 경로는 모든 표층을 통과해야 합니다.
커프는 팔에 편안하게 감겨 꼭 맞아야 합니다. 그러나, 커프(49)를 감싸는 행위만으로도 팔에 과도한 압력을 가할 수 있는 과도한 조임을 피하는 것이 중요하다. 목표는 베이스라인 혈류역학적 매개변수를 변경할 수 있는 불필요한 압박을 유발하지 않고 안전하고 편안한 착용감을 달성하는 것입니다. 암을 압축하면 전체 프로토콜에 대한 데이터 품질이 저하되고 가해진 압력이 VOT의 목표 압력에 효과적으로 추가됩니다. 커프가 팔에 느슨하게 감겨 있는 경우 목표 압력에 도달하는 데 더 많은 공기가 필요하므로 더 많은 시간이 걸립니다. 이것은 산소 공급이 서서히 감소하기 때문에 생리를 조정하기 위한 조직에 시간을 줄 수 있으며, 이는 피해야 합니다50.
조직에 과도한 압력을 가하지 않고 적절한 접촉을 유지하는 방식으로 스마트 프로브를 부착하는 것이 중요합니다. 이를 통해 국소 허혈의 위험을 피하면서 신뢰할 수 있는 측정이 가능합니다. 국소 허혈은 해당 부위로의 혈류가 제한될 때 발생하며, 이는 혈액 순환을 손상시키고 잠재적으로 측정값을 손상시킬 수 있다51.
프로브의 정전식 터치 센서는 프로브가 조직에 부착된 경우에만 레이저가 빛나도록 레이저 안전 시스템에서 사용됩니다. 환자의 팔에 모발 밀도가 높으면 터치 센서의 감도가 저하될 수 있습니다. 프로브의 센서 쪽에 얇은 투명 이중 테이프를 적용하면 터치 센서 문제를 효과적으로 완화할 수 있습니다. 이 테이프와 함께 프로브를 털이 많은 암에 부착하면 안정적이고 안정적인 터치 신호를 제공합니다. 이 테이프의 사전 정의된 절단은 광원과 검출기를 분리하는 스마트 프로브에 사용할 수 있습니다. 이러한 분리는 광원과 검출기 창 사이에 직사광선 채널이 형성되는 것을 방지하는 데 필수적이며, 이는 측정 품질에 영향을 미칠 수 있습니다. 투명 이중 테이프의 사용은 이러한 상황에서 터치 감지의 신뢰성을 향상시키는 실용적인 솔루션 역할을 합니다. 프로토콜 중에 터치 감지가 손실되면 레이저가 꺼지고 측정이 손실됩니다. 프로브에는 향후 백업 안전 조치로 활용될 수 있는 부하 센서도 있습니다.
환자가 팔을 움직이거나 작은 임상 개입으로 인해 기준선 단계에서 획득한 신호의 안정성이 중단되어 급격한 피크가 발생하는 경우 확장 기능을 활용하는 것이 좋습니다. 이 기능을 사용하면 3분 동안 안정적인 기준선을 획득할 수 있어 일관되고 신뢰할 수 있는 신호 측정이 보장됩니다.
프로토콜을 시작한 후 환자의 혈압이 크게 변할 수 있으며, 이는 VOT의 수축기 혈압보다 높은 목표 압력인 50mmHg에 도달하는 능력에 영향을 미칠 수 있다는 점을 고려하는 것이 중요합니다. 이러한 혈압의 변동은 환자의 생리적 반응, 약물 효과, 또는 다른 임상적 조건과 같은 다양한 요인에 의해 영향을 받을 수 있다52. 따라서 VOT의 일관된 관리를 위해 필요한 경우 “+” 또는 “-” 버튼을 눌러 목표 압력을 조정해야 합니다.
VOT의 일반적인 실행은 운영자 가변성으로 인해 한계가 있으며, 이 프로토콜에서는 자동 VOT를 사용하여 해결됩니다. 수축기 혈압 수준보다 50mmHg의 교합 압력을 설정하는 전략을 사용하고 있습니다. 이 방법은 혈류를 멈추게 하며, VOT53,54를 수행하기 위한 이전 연구들에서 보고된 바 있다. 이 프로토콜에서 VOT에 대한 개별화된 목표 압력은 VOT에 대한 일반적인 목표 압력을 고정하여 발생할 수 있는 혈관 수축을 방지하는 데 도움이 됩니다. 불필요하게 높은 압력으로 인한 통증은 혈관 수축을 유발하는 측정에 영향을 미칠 수 있습니다(예: 수축기 혈압이 120mmHg이고 목표 압력이 200mmHg 또는 250mmHg인 환자에서29). 중환자실에 입원한 환자는 혈전증의 위험이 증가하는데, 이는 주로 장기간의 부동자세와 진정제와 같은 요인으로 인해 발생한다55. 이는 위험을 피하기 위해 혈전증이나 혈전정맥염을 앓고 있는 환자에게 이 프로토콜을 사용할 수 없음을 의미합니다.
이 프로토콜의 적용은 손상된 반응성 충혈이 일반적인 특징이며 미세혈관 이상에 기여할 수 있는 ICU 집단에서 유용할 수 있습니다 3,56. 측정 중 작업자의 개입 없이 이 프로토콜에서 획득된 파라미터는 병리학적 상태를 구별하기 위해 패혈증, 암, 뇌졸중 등에 대해 문헌에서 단독으로 또는 작은 조합으로 이전에 사용되었습니다 1,11,15,31. 따라서 이러한 관련 매개변수의 조합이 여러 임상 응용 분야에 유용하다고 생각합니다. 이 프로토콜에 의해 기록된 데이터는 혈관 건강을 개선하기 위한 적절한 치료 전략을 선택하는 데 도움이 될 수 있다57. 교합 및 재관류 중 조직 산소 공급 및 혈류 역학에 대한 귀중한 통찰력을 통해 중요한 장기에 대한 혈액 공급의 적절성을 평가할 수 있습니다. 이는 조직 저산소증을 식별하고 장기 관류를 최적화하기 위한 중재를 안내하는 데 도움이 될 수 있다58. 미세혈관 산소화 및 반응성 충혈에 대한 실시간 정보를 사용하여 혈류역학적 관리, 유체 소생술 및 승압제 요법을 안내하는 추가 도구로 지원합니다59,60. 이를 통해 중재는 개별 환자의 요구에 맞게 조정되어 조직 산소 공급 및 관류를 최적화합니다61,62. 또한, 기계환기 환자의 경우, 자발호흡 시도 내에서 미세혈관 산소화 및 혈류의 진화적 변화는 도움 없이 호흡하는 작업으로 인해 증가하는 대사 부담을 충족하고 극복하기 위해 심혈관 내성을 평가할 때 가장 중요할 수 있다2. 이를 위해 중환자실 환자에게 매일 중요하고 어려운 결정은 환자가 스스로 숨을 쉴 수 있다고 판단되고 기관내 튜브를 제거할 때 끝나는 이유식 과정입니다. 이 프로토콜의 종단적 적용은 중재의 효과를 평가하고, 질병 진행을 추적하고, 치료 전략을 안내하는 데 사용할 수 있습니다.
Disclosures
The authors have nothing to disclose.
Acknowledgements
이 연구는 Fundació CELLEX Barcelona, Fundació Mir-Puig, Ajuntament de Barcelona, Agencia Estatal de Investigación(PHOTOMETABO, PID2019-106481RB-C31/10.13039/501100011033), R&D 우수 센터를 위한 “Severo Ochoa” 프로그램(CEX2019-000910-S), 카탈루냐 총국(CERCA, AGAUR-2017-SGR-1380, RIS3CAT-001-P-001682 CECH), FEDER EC, Fundacion Joan Ribas Araquistain, l’FCRI(Convocatòria Joan Oró 2023), European Commission Horizon 2020(보조금 번호 101016087 (VASCOVID), 101017113(TinyBrains), 871124(LASERLAB-EUROPE V), 101062306(Marie Skłodowska-Curie)), Fundació La Marató de TV3(2017,2020) 및 LUX4MED/MEDLUX 특별 프로그램.
Materials
| Alcohol swabs | No specific | N/A | For cleaning the probes and cuff after measurement |
| Black cloth | No specific | N/A | For blocking ambient light |
| Blood pressure monitor | OMRON | N/A | Hopital ICU equipment or off the shelf product |
| Body fat Calliper | Healifty | 3257040-6108-1618385551 | For measuring the fat layer |
| Examination gloves | No specific | N/A | To be used for interacting with patients |
| Kintex tape | No specific | N/A | For attaching the probe on arm |
| Koban wrap | No specific | N/A | For attaching the probe on arm |
| Measuring tape | YDM Industries | 25-SB-30-150V3-19-1 | For measuring the arm circumference |
| Scissors | No specific | N/A | for cutting tapes |
| VASCOVID precommercial prototype | VASCOVID consortium | N/A | Integrated at ICFO |
References
- Mesquida, J., Masip, J., Gili, G., Artigas, A., Baigorri, F. Thenar oxygen saturation measured by near infrared spectroscopy as a noninvasive predictor of low central venous oxygen saturation in septic patients. Intensive Care Medicine. 35, 1106-1109 (2009).
- Mesquida, J., et al. Thenar oxygen saturation (StO2) alterations during a spontaneous breathing trial predict extubation failure. Annals of Intensive Care. 10 (1), 1-7 (2020).
- Mikacenic, C., et al. Biomarkers of endothelial activation are associated with poor outcome in critical illness. PloS One. 10 (10), e0141251 (2015).
- Varga, Z., et al. Endothelial cell infection and endotheliitis in COVID-19. The Lancet. 395 (10234), 1417-1418 (2020).
- Castro, P., et al. Is the endothelium the missing link in the pathophysiology and treatment of COVID-19 complications. Cardiovascular Drugs and Therapy. 36 (3), 547-560 (2022).
- Mesquida, J., et al. Peripheral microcirculatory alterations are associated with the severity of acute respiratory distress syndrome in COVID-19 patients admitted to intermediate respiratory and intensive care units. Critical Care. 25, 1-10 (2021).
- Fernández, S., et al. Distinctive biomarker features in the endotheliopathy of COVID-19 and septic syndromes. Shock (Augusta, Ga). 57 (1), 95 (2022).
- Sakr, Y., Dubois, M. J., De Backer, D., Creteur, J., Vincent, J. L. Persistent microcirculatory alterations are associated with organ failure and death in patients with septic shock). Critical Care Medicine. 32 (9), 1825-1831 (2004).
- Trzeciak, S., et al. Early microcirculatory perfusion derangements in patients with severe sepsis and septic shock: relationship to hemodynamics, oxygen transport, and survival. Annals of Emergency Medicine. 49 (1), 88-98 (2007).
- Tachon, G., et al. Microcirculatory alterations in traumatic hemorrhagic shock. Critical Care Medicine. 42 (6), 1433-1441 (2014).
- Duranteau, J., et al. The future of intensive care: the study of the microcirculation will help to guide our therapies. Critical Care. 27 (1), 1-13 (2023).
- Mason McClatchey, P., et al. Impaired tissue oxygenation in metabolic syndrome requires increased microvascular perfusion heterogeneity. Journal of Cardiovascular Translational Research. 10 (1), 69-81 (2017).
- Gurley, K., Shang, Y., Yu, G. Noninvasive optical quantification of absolute blood flow, blood oxygenation, and oxygen consumption rate in exercising skeletal muscle. Journal of Biomedical Optics. 17 (7), 075010 (2012).
- Lin, P. Y., et al. Non-invasive optical measurement of cerebral metabolism and hemodynamics in infants. Journal of Visualized Experiments. (73), e4379 (2013).
- Cortese, L., et al. The LUCA device: a multi-modal platform combining diffuse optics and ultrasound imaging for thyroid cancer screening. Biomedical Optics Express. 6 (6), 3392-3409 (2021).
- Durduran, T., Yodh, A. G. Diffuse correlation spectroscopy for non-invasive, micro-vascular cerebral blood flow measurement. Neuroimage. 85, 51-63 (2014).
- Hong, K. S., Yaqub, M. A. Application of functional near-infrared spectroscopy in the healthcare industry: A review. Journal of Innovative Optical Health Sciences. 12 (06), 1930012 (2019).
- Torricelli, A., et al. Time domain functional NIRS imaging for human brain mapping. Neuroimage. 85, 28-50 (2014).
- Tremblay, J. C., King, T. J. Near-infrared spectroscopy: can it measure endothelial function. Experimental Physiology. 101 (11), 1443-1444 (2016).
- Cortese, L., et al. Performance assessment of a commercial continuous-wave near-infrared spectroscopy tissue oximeter for suitability for use in an international, multi-center clinical trial. Sensors. 21 (21), 6957 (2021).
- Contini, D., et al. Multi-channel time-resolved system for functional near infrared spectroscopy. Optics Express. 14 (12), 5418-5432 (2006).
- Lacerenza, M., et al. Wearable and wireless time-domain near-infrared spectroscopy system for brain and muscle hemodynamic monitoring. Biomedical Optics Express. 11 (10), 5934-5949 (2020).
- Lacerenza, M., et al. Performance and reproducibility assessment across multiple time-domain near-infrared spectroscopy device replicas. Design and Quality for Biomedical Technologies XV – SPIE. 11951, 43-48 (2022).
- Durduran, T., Choe, R., Baker, W. B., Yodh, A. G. Diffuse optics for tissue monitoring and tomography. Reports on Progress in Physics. 73 (7), 076701 (2010).
- Boas, D. A., Campbell, L. E., Yodh, A. G. Scattering and imaging with diffusing temporal field correlations. Physical Review Letters. 75 (9), 1855 (1995).
- Giovannella, M., et al. BabyLux device: a diffuse optical system integrating diffuse correlation spectroscopy and time-resolved near-infrared spectroscopy for the neuromonitoring of the premature newborn brain. Neurophotonics. 6 (2), 025007-025007 (2019).
- Amendola, C., et al. A compact multi-distance DCS and time domain NIRS hybrid system for hemodynamic and metabolic measurements. Sensors. 21 (3), 870 (2021).
- Mesquida, J., Gruartmoner, G., Espinal, C. Skeletal muscle oxygen saturation (StO2) measured by near-infrared spectroscopy in the critically ill patients. BioMed Research International. (2013), (2013).
- Gerovasili, V., Dimopoulos, S., Tzanis, G., Anastasiou-Nana, M., Nanas, S. Utilizing the vascular occlusion technique with NIRS technology. International Journal of Industrial Ergonomics. 40 (2), 218-222 (2010).
- Siafaka, A., et al. Acute effects of smoking on skeletal muscle microcirculation monitored by near-infrared spectroscopy. Chest. 131 (5), 1479-1485 (2007).
- Donati, A., et al. Near-infrared spectroscopy for assessing tissue oxygenation and microvascular reactivity in critically ill patients: a prospective observational study. Critical Care. 20, 1-10 (2016).
- Iannetta, D., et al. Reliability of microvascular responsiveness measures derived from near-infrared spectroscopy across a variety of ischemic periods in young and older individuals. Microvascular Research. 122, 117-124 (2019).
- Niezen, C. K., Massari, D., Vos, J. J., Scheeren, T. W. L. The use of a vascular occlusion test combined with near-infrared spectroscopy in perioperative care: a systematic review. Journal of Clinical Monitoring and Computing. 36 (4), 933-946 (2022).
- Donati, A., et al. Recombinant activated protein C treatment improves tissue perfusion and oxygenation in septic patients measured by near-infrared spectroscopy. Critical Care. 5 (5), 1-7 (2009).
- Neto, A. S., et al. Association between static and dynamic thenar near-infrared spectroscopy and mortality in patients with sepsis: a systematic review and meta-analysis. Journal of Trauma and Acute Care Surgery. 76 (1), 226-233 (2014).
- Shapiro, N. I., et al. The association of near-infrared spectroscopy-derived tissue oxygenation measurements with sepsis syndromes, organ dysfunction and mortality in emergency department patients with sepsis. Critical Care. 15 (5), 1-10 (2011).
- Orbegozo, D., et al. Peripheral muscle near-infrared spectroscopy variables are altered early in septic shock. Shock. 50 (1), 87-95 (2018).
- Lu, S., et al. Comparison of COVID-19 induced respiratory failure and typical ARDS: similarities and differences. Frontiers in Medicine. 9, 829771 (2022).
- Parežnik, R., Knezevic, R., Voga, G., Podbregar, M. Changes in muscle tissue oxygenation during stagnant ischemia in septic patients. Intensive Care Medicine. 32, 87-92 (2006).
- Nanas, S., et al. Inotropic agents improve the peripheral microcirculation of patients with end-stage chronic heart failure. Journal of Cardiac Failure. 14 (5), 400-406 (2008).
- International electrical equipment – IEC. Medical electrical equipment – Part 2-22: Particular requirements for basic safety and essential performance of surgical, cosmetic, therapeutic and diagnostic laser equipment. International electrical equipment – IEC. , (2019).
- Cortese, L., et al. Recipes for diffuse correlation spectroscopy instrument design using commonly utilized hardware based on targets for signal-to-noise ratio and precision. Biomedical Optics Express. 12 (6), 3265-3281 (2021).
- Zhou, C., et al. Diffuse optical correlation tomography of cerebral blood flow during cortical spreading depression in rat brain. Optics Express. 14 (3), 1125-1144 (2006).
- Selb, J., et al. Sensitivity of near-infrared spectroscopy and diffuse correlation spectroscopy to brain hemodynamics: simulations and experimental findings during hypercapnia. Neurophotonics. 1 (1), 015005-015005 (2014).
- Amendola, C., et al. Assessment of power spectral density of microvascular hemodynamics in skeletal muscles at very low and low-frequency via near-infrared diffuse optical spectroscopies. Biomedical Optics Express. 14 (11), 5994-6015 (2023).
- Craig, J. C., Broxterman, R. M., Wilcox, S. L., Chen, C., Barstow, T. J. Effect of adipose tissue thickness, muscle site, and sex on near-infrared spectroscopy derived total-[hemoglobin+ myoglobin]. Journal of Applied Physiology. 123 (6), 1571-1578 (2017).
- Nasseri, N., Kleiser, S., Ostojic, D., Karen, T., Wolf, M. Quantifying the effect of adipose tissue in muscle oximetry by near infrared spectroscopy. Biomedical Optics Express. 7 (11), 4605-4619 (2016).
- Ahmadinejad, M., Razban, F., Jahani, Y., Heravi, F. Limb edema in critically ill patients: Comparing intermittent compression and elevation. International Wound Journal. 19 (5), 1085-1091 (2022).
- Van Vo, T., Hammer, P. E., Hoimes, M. L., Nadgir, S., Fantini, S. Mathematical model for the hemodynamic response to venous occlusion measured with near-infrared spectroscopy in the human forearm. IEEE Transactions on Biomedical Engineering. 54 (4), 573-584 (2007).
- Junejo, R. T., Ray, C. J., Marshall, J. M. Cuff inflation time significantly affects blood flow recorded with venous occlusion plethysmography. European Journal of Applied Physiology. 119, 665-674 (2019).
- Baker, W. B., et al. Pressure modulation algorithm to separate cerebral hemodynamic signals from extracerebral artifacts. Neurophotonics. 3 (3), 035004-035004 (2015).
- Martirosov, A. L., et al. Improving transitions of care for critically ill adult patients on pulmonary arterial hypertension medications. American Journal of Health-System Pharmacy. 77 (12), 958-965 (2020).
- Bezemer, R., Lima, A., Klijn, E., Bakker, J., Ince, C. Assessment of tissue oxygen saturation during a vascular occlusion test using near-infrared spectroscopy: Role of the probe spacing and measurement site studied in healthy volunteers. Critical Care. (13), 1-2 (2009).
- Futier, E., et al. Use of near-infrared spectroscopy during a vascular occlusion test to assess the microcirculatory response during fluid challenge. Critical Care. (15), 1-10 (2011).
- Attia, J. R., et al. Deep vein thrombosis and its prevention in critically ill adults. Archives of Internal Medicine. 161 (10), 1268-1279 (2001).
- Reinhart, K., Bayer, O., Brunkhorst, F., Meisner, M. Markers of endothelial damage in organ dysfunction and sepsis. Critical Care Medicine. 30 (5), S302-S312 (2002).
- Georger, J. F., et al. Restoring arterial pressure with norepinephrine improves muscle tissue oxygenation assessed by near-infrared spectroscopy in severely hypotensive septic patients. Intensive Care Medicine. 36, 1882-1889 (2010).
- Lipcsey, M., Woinarski, N. C., Bellomo, R. Near infrared spectroscopy (NIRS) of the thenar eminence in anesthesia and intensive care. Annals of Intensive Care. 2 (1), 1-9 (2012).
- Kazune, S., Caica, A., Luksevics, E., Volceka, K., Grabovskis, A. Impact of increased mean arterial pressure on skin microcirculatory oxygenation in vasopressor-requiring septic patients: an interventional study. Annals of Intensive Care. 9 (1), 1-10 (2019).
- Lima, A., van Bommel, J., Jansen, T. C., Ince, C., Bakker, J. Low tissue oxygen saturation at the end of early goal-directed therapy is associated with worse outcome in critically ill patients. Critical Care. 13 (5), 1-7 (2009).
- Rogers, C. A., et al. Randomized trial of near-infrared spectroscopy for personalized optimization of cerebral tissue oxygenation during cardiac surgery. BJA: British Journal of Anaesthesia. 119 (3), 384-393 (2017).
- Jozwiak, M., Chambaz, M., Sentenac, P., Monnet, X., Teboul, J. L. Assessment of tissue oxygenation to personalize mean arterial pressure target in patients with septic shock. Microvascular Research. 132, 104068 (2020).

