임상 연구에서 상완 동맥의 초음파 평가 내피 의존 흐름 매개 혈관 확장
Summary
내피 기능 장애는 수많은 질병 상태와 관련된 인간의 심혈관 사건의 예측이다. 흐름 매개 혈관 확장 (FMD)는 내피 세포 기능을 평가 비 침습적 초음파 방법이다. 방법 론적 선택과 작업자의 경험은 결과에 영향을 미칠 수 있습니다. 인간 연구에서 FMD에 대한 체계적인 접근 방법은 여기에서 논의된다.
Abstract
혈관 내피 세포는 혈관의 내부를 모두 커버와 구조적 및 기능적 역할을 제공하는 세포의 단일 층이다. 내피는 플라즈마 성분에 백혈구 부착 및 통합뿐만 아니라 제어 투과성을 방지하는 배리어로서 작용한다. 기능적으로, 내피는 혈관 톤에 영향을 미칩니다.
내피 기능 장애는 혈관 톤, thombroresistance, 세포 증식 및 세포 분열을 조절하는 화학 종 사이의 불균형이다. 이는 죽상 경화증의 첫 단계 및 관상 동맥 질환, 말초 동맥 질환, 심장 부전, 고혈압, 고지혈증과 연관된다.
내피 기능 장애의 첫 번째 데모는 아세틸 콜린과 정량적 관상 동맥 조영술의 직접 주입을 포함했다. 아세틸 콜린은 세포 내 칼슘 증가 및 NI의 증가로 이어지는, 내피 세포 표면에 무스 카린 수용체에 결합⚻에 정해진 산화물 (NO) 생산. 내피 손상 환자는 역설적 인 혈관 수축을 경험하는 동안 그대로 내피 세포와 환자에서 혈관 확장이 관찰되었다.
고해상도 B-모드 초음파를 사용하여 말초 동맥 내피 세포 기능을 측정하는 비 침습적 생체 내 방법이 존재한다. 말초 동맥 내피 기능 밀접 관상 동맥 기능에 관한 것이다. 이 기술은 사지 허혈 다음 반응 충혈의 기간 동안 상완 동맥 %의 직경 변화를 측정한다.
내피 세포 의존적 혈관 확장 매개 흐름이라고하는이 기법은, (FMD) 임상 연구에서 설정 값을 갖는다. 그러나, 생리 학적 및 기술적 문제점의 수는 기술을위한 결과 및 해당 지침의 정확성 발행 한 영향을 미칠 수있다. 가이드 라인에도 불구하고, FMD는 크게 개인차가 남아 있고 가파른 학습 곡선을 제시한다.이 문서에서는 상완의 상완 동맥의 FMD를 측정하는 표준화 된 방법을 제시하고 내부 작업자의 변동성을 줄이기 위해 제안을 제공합니다.
Introduction
인간의 혈관 내피 세포는 신체 내에서 구조적 및 기능적 역할을 제공합니다. 조직학 섹션에서, 내피 세포는 평활근 세포 (미디어) 및 결합 조직 (외막)의 두꺼운 층의 층 위에 앉아 1-2 미크론 두께의 얇은 셀 층을 포함하고, 작은 나타난다. 전체적으로 볼, 내피는 혈액 및 혈관 평활근 조직 간의 정보 교환을위한 넓은 면적을 제공한다. 추정 한 700 평방 미터의 단면적 및 70kg의 사람에 1,000-1,500 g의 질량, 간이 한 질량에서 대등하다. 화학적 신호 전달에 기계식 혈관의 항상성을 유지하기 위해 건강한 내피는 허용한다. 내피 기능 장애는 이러한 매개체의 불균형 및 혈관 질환의 첫 번째 단계, 동맥 경화의 조직 학적 증거에 존재하는 사전이다. 인간의 혈관 확장 기능을 정량화하기위한 비 침습적 생체 방법동맥이 있습니다. 이 방법은, 내피 세포 의존적 혈관 확장 매개 흐름 (FMD)의 임상 시험에서 널리 사용된다.
내피 세포는 혈관의 구조적 요소로서 작용하고이 글리코 사 미노 글리 칸 및 피브로넥틴과 같은 세포 외 기질의 성분을 제조한다. 동맥 혈액의 흐름 급성 손상의 장기 변화는 구조적인 변화가 발생할 수 있습니다. 기능적으로, 혈관 내피 세포는 혈관 톤, 염증 프로세스, antithrombosis 및 항 응고의 규제에 참여하고 있습니다. 혈관 확장이 산화 질소 (NO), 프로 스타 사이클린, 내피 세포 유래 과분극 인자 (EDHF) 3-6에 의해 매개되는 동안 내피 세포는 엔도 텔린을 통해 혈관 수축에 영향을 미칩니다.
내피 기능 장애는 이러한 매개체 및 동맥 경화증의 첫 번째 단계의 임의의 손상이다. 놀랍게도 질병의기구로서, 그것의 임상 적으로 중요한 숫자와 연관되어 있지관상 동맥 질환, 고혈압 및 당뇨병과 같은 조건 7-11. 중요한 것은, 내피 기능 장애 진단 심혈관 질환이없는 사람에서 관찰 및 향후 심혈관 질환 7,12,13의 예측입니다 수 있습니다. 내피 기능 장애의 한 측정, 프래 점수와 함께, 혼자 14 중 측정 위의 추가 예후 정보를 제공 할 수 있습니다.
내피 기능 장애의 대책 약리 제의 직접 주입을 포함 할 수있다. 정량적 혈관 조영술과 함께 예를 들어 아세틸 콜린의 Intercoronary 주입, 그대로 내피 세포와 과목에서 혈관 확장을 보여줍니다. 그러나, 내피 손상 경험 역설적 인 혈관 수축을 가진 개인. 15 말초 동맥에서, 게이지 – 변형 혈량 측정법에 의한 흐름의 측정과 약리 에이전트의 주입은 16 수있다.
에이전트내피 세포에 직접 영향을주고 화학 신호를 이끌어들 내피 세포 의존적 혈관 확장제를 칭한다. 아세틸 콜린, 예를 들면, 세포 내 칼슘 농도, 산화 질소 신타 제 및 혈관 확장 활성을 증가로 이어지는 내피 세포에 무스 카린 수용체에 작용한다. 내피 세포의 개입없이 혈관 확장에 영향을 미칠 에이전트는 내피 세포에 독립적 인 에이전트라고합니다. 세포 내 칼슘 농도 (17)를 규제하는 단백질 키나제를 통해 혈관벽에 혈관 이완을 매개 5'-monophasphate (는 cGMP) – 니트로 글리세린은, 예를 들면, 수용성 guanyl 시클 라제 및 환상 구아노 신 -3 '를 활성화한다.
"흐름 중재, 내피 세포 의존성 혈관 확장"(FMD) 18라는 Celermajer 및 동료에 의해 도입 된 내피 기능 장애를 정량화하기위한 비 침습적, 생체 내 방법이있다. 간단히, 변화는 혈액의 흐름 오픈 전단 응력에 민감한 이온 찬 동맥합니다내피 세포에서 넬스. 신호는 두 번째 메신저 폭포를 통해 tranduced 및 NO 생성, 내피 산화 질소 합성 효소 (eNOS의)를 활성화한다. 이 종 인접한 평활근 세포 (SMC)에 세포막을 가로 질러 확산된다. SMC 내 신호는 세포 내 칼슘 농도를 낮추고 혈관 이완 (19)에 영향을 미치는, 형질 도입된다. 동맥 내강의 직경은 하겐 – Poiseullie 방정식과 일치 혈류의 증가로 이어지는 증가한다. FMD의 효과는 예컨대 모노 – methylarginine (L-NMMA) 20 NO 합성 효소 억제제의 투여 폐지 될 수있다.
Celermajer 외.의 혁신적인 작품은 허혈을 따르는 반응성 충혈 중에 동맥 직경의 변화를 평가하기 위해 고해상도 B-모드 초음파의 사용을 허용하고있다. 이 기술에서는, 피험자가 앙와위 달려 상완 동맥의 직경이 길이 방향 평면에서 측정된다. 혈액 pressu재 커프는 사지에 허혈을 생산하는 데 사용됩니다. 동맥의 직경이 다시 측정된다 혈압 커프의 방출에 이어. 전단 응력의 급속한 변화는 NO 매개 혈관 확장에 대한 자극이다. 간단한 방정식 기준 직경 (수학 식 1)에 대하여 직경의 변화를 설명한다. 이 방정식, 충혈 및 기준 직경의 매개 변수의 전체 논의는, 프로토콜에서 발견 섹션을 결과 할 수있다.
<!–Equation 1: Percent FMD
%FMD = 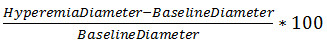
여러 연구에서, %의 FMD는 설립 심혈관 질환 21 ~ 24 환자에서 심혈관 질환을 예측하는 것으로 확인되었습니다. 상완 동맥 %의 FMD과 관상 동맥 사이의 상관 관계 앤더슨 등에 의해 설립 된 FMD., 귀신을심장 (25)에 주변 장치 측정 및 더 많은 임상 관련 허혈성 변화 사이에 링크를 trating. FMD는 용기의 최대 혈관 확장을 보여주지 않는다. 이 평가를 위해, FMD은 동일한 용기의 내피 세포 의존적 혈관 확장 매개 글리세린 뒤에 수있다.
%의 FMD의 측정에 영향을 미치는 기술적 인 문제가 있습니다. 기술의 도입 이후, 여러 연구는 피험자 간 연산자 26 변동성의 높은 정도를 나타내었다. 여기에는 흡연, 고혈압 약물, 시간 공복 상태로 생리적 요인 %의 FMD에 영향을주는 것으로 나타났다. 마찬가지로, 이러한 측정 및 폐쇄 기간 사이트 커프의 위치 선택은 기술적 27,28 측정에 영향을 미치는 것으로 밝혀졌다. 가이드 라인은 현재 합의를 설명하고 기술의 표준화 사이의 허용이 발표되었다실험실 19,29.
기술의 진화 합의에도 불구하고, 흐름 매개 혈관 확장은 주로 긴 학습 곡선에 의존 운영자 남아있다. Corretti 예를 들어, 독립적으로 작동하기 전에 숙련 된 조사관의 감독하에 소노 그래퍼 전체 100 검사를 권장합니다. 적절한 전문 지식의 수준을 유지하기 위해서는 매년 기술자 완전한 백 검사를 권장합니다. 작은 샘플 모집단 및 제한된 자원 연구자 들어, 학습 곡선 진입 장벽을 제공한다. 이 문서에서는 팔 위쪽에있는 상완 동맥의 흐름 매개 혈관 확장하는 방법을 보여주고 내 운영자 변동성을 줄이기 위해 기술 제안을 제공 할 것입니다.
Protocol
Representative Results
Discussion
내피 기능 장애는 용기 톤과 동맥 경화증의 개발 초기 단계에 영향을 미치는 화학적 매개체의 불균형이다. 동맥의 반응성을 측정하는 것은 이들 화학적 경로의 상태를 평가하는 방법이다. 반응성을 평가 모두 직접 및 간접 방법은 검지 손가락 (38)의 비 침습적, 펄스 파형 분석 관상 순환 내피 세포의 효능을 직접 주입에 이르기까지 서로 다른 혈관 침대를 존재한다.
?…
Declarações
The authors have nothing to disclose.
Acknowledgements
혈관 통합 생리학 및 실험 치료학 (VIPERx) 실험실에서이 작품은 외과, 샌프란시스코의 캘리포니아 대학과 연구 및 교육을위한 북부 캘리포니아 공과 대학에서 기금에 의해 지원되었다. 설명이 프로젝트는 연구 자원에 대한 국가 센터에서 보너스 번호 KL2RR024130에 의해 지원되었다. 내용은 전적으로 저자의 책임이며 반드시 연구 자원에 대한 국가 센터 또는 국립 보건원의 공식 견해를 대변하지 않습니다.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Philips HD 11XE ultrasound | Philips Healthcare | ||
| 5-12 MHz linear array transducer | Philips Healthcare | L12-5 | |
| Ultrasound gel | Parker Laboratories | ||
| Vascular Research Tools v.5.0 | Medical Imaging Applications, LLC | ||
| MIA Gating module | Medical Imaging Applications, LLC | ||
| Desktop PC | Dell, Inc | ||
| Windows XP | Microsoft, Inc | ||
| 5 cm tourniquet blood pressure cuff | Hokanson | SC 5 | |
| Hand-held aneroid manometer | Welch Allyn | DS66 |
Referências
- Gerlach, E., Nees, S., Becker, B. F. The vascular endothelium: a survey of some newly evolving biochemical and physiological features. Basic Res Cardiol. 80, 459-474 (1985).
- Sato, T., Arai, K., Ishiharajima, S., Asano, G. Role of glycosaminoglycan and fibronectin in endothelial cell growth. Experimental and molecular pathology. 47, 202-210 (1987).
- Yanagisawa, M., et al. A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature. 332, 411-415 (1988).
- Ignarro, L. J., Buga, G. M., Wood, K. S., Byrns, R. E., Chaudhuri, G. Endothelium-derived relaxing factor produced and released from artery and vein is nitric oxide. Proceedings of the National Academy of Sciences. 84, 9265-9269 (1987).
- Moncada, S., Higgs, E. A., Vane, J. R. Human arterial and venous tissues generate prostacyclin (prostaglandin x), a potent inhibitor of platelet aggregation. The Lancet. 309, 18-21 (1977).
- Ozkor, M. A., et al. Endothelium-derived hyperpolarizing factor determines resting and stimulated forearm vasodilator tone in health and in disease. Circulation. 123, 2244-2253 (2011).
- Suwaidi, J. A., et al. Long-Term Follow-Up of Patients With Mild Coronary Artery Disease and Endothelial Dysfunction. Circulation. 101, 948-954 (2000).
- Neunteufl, T., et al. Systemic endothelial dysfunction is related to the extent and severity of coronary artery disease. Atherosclerosis. 129, 111-118 (1997).
- Taddei, S., et al. Hypertension Causes Premature Aging of Endothelial Function in Humans. Hypertension. 29, 736-743 (1997).
- Perticone, F., et al. Prognostic Significance of Endothelial Dysfunction in Hypertensive Patients. Circulation. 104, 191-196 (2001).
- Williams, S. B., Cusco, J. A., Roddy, M. -. A., Johnstone, M. T., Creager, M. A. Impaired nitric oxide-mediated vasodilation in patients with non-insulin-dependent diabetes mellitus. Journal of the American College of Cardiology. 27, 567-574 (1996).
- Schindler, T. H., et al. Prognostic value of abnormal vasoreactivity of epicardial coronary arteries to sympathetic stimulation in patients with normal coronary angiograms. Arterioscler Thromb Vasc Biol. 23, 495-501 (2003).
- Halcox, J. P., et al. Prognostic value of coronary vascular endothelial dysfunction. Circulation. 106, 653-658 (2002).
- Yeboah, J., et al. Predictive value of brachial flow-mediated dilation for incident cardiovascular events in a population-based study the multi-ethnic study of atherosclerosis. Circulation. 120, 502-509 (2009).
- Ludmer, P. L., et al. Paradoxical vasoconstriction induced by acetylcholine in atherosclerotic coronary arteries. New England Journal of Medicine. 315, 1046-1051 (1986).
- Higashi, Y., et al. Effect of the angiotensin-converting enzyme inhibitor imidapril on reactive hyperemia in patients with essential hypertension: relationship between treatment periods and resistance artery endothelial function. Journal of the American College of Cardiology. 37, 863-870 (2001).
- Linke, A., Erbs, S., Hambrecht, R. Exercise and the coronary circulation—alterations and adaptations in coronary artery disease. Progress in cardiovascular diseases. 48, 270-284 (2006).
- Celermajer, D. S., et al. Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. The Lancet. 340, 1111-1115 (1992).
- Thijssen, D. H. J., et al. Assessment of flow-mediated dilation in humans: a methodological and physiological guideline. American Journal of Physiology – Heart and Circulatory Physiology. 300, (2011).
- Doshi, S. N., et al. Flow-mediated dilatation following wrist and upper arm occlusion in humans: the contribution of nitric oxide. Clinical science. 101, 629-635 (2001).
- Brevetti, G., Silvestro, A., Schiano, V., Chiariello, M. Endothelial Dysfunction and Cardiovascular Risk Prediction in Peripheral Arterial Disease: Additive Value of Flow-Mediated Dilation to Ankle-Brachial Pressure Index. Circulation. 108, 2093-2098 (2003).
- Neunteufl, T., et al. Late prognostic value of flow-mediated dilation in the brachial artery of patients with chest pain. The American Journal of Cardiology. 86, 207-210 (2000).
- Gokce, N., et al. Predictive value of noninvasivelydetermined endothelial dysfunction for long-term cardiovascular events inpatients with peripheral vascular disease. Journal of the American College of Cardiology. 41, 1769-1775 (2003).
- Gokce, N., et al. Risk Stratification for Postoperative Cardiovascular Events via Noninvasive Assessment of Endothelial Function: A Prospective Study. Circulation. 105, 1567-1572 (2002).
- Anderson, T. J., et al. Close relation of endothelial function in the human coronary and peripheral circulations. Journal of the American College of Cardiology. 26, 1235-1241 (1995).
- De Roos, N. M., Bots, M. L., Schouten, E. G., Katan, M. B. Within-subject variability of flow-mediated vasodilation of the brachial artery in healthy men and women: implications for experimental studies. Ultrasound in medicin., & biology. 29, 401-406 (2003).
- Berry, K. L., Skyrme-Jones, R. A., Meredith, I. T. Occlusion cuff position is an important determinant of the time course and magnitude of human brachial artery flow-mediated dilation. Clinical science. 99, 261-267 (2000).
- Betik, A. C., Luckham, V. B., Hughson, R. L. Flow-mediated dilation in human brachial artery after different circulatory occlusion conditions. American journal of physiology. Heart and circulatory physiology. 286, 442-448 (2004).
- Corretti, M. C., et al. Guidelines for the ultrasound assessment of endothelial-dependent flow-mediated vasodilation of the brachial arteryA report of the International Brachial Artery Reactivity Task Force. Journal of the American College of Cardiology. 39 (1001), 257-265 (2002).
- Grenon, S. M., et al. n-3 Polyunsaturated fatty acids supplementation in peripheral artery disease: the OMEGA-PAD trial. Vascular medicine. 18, 263-274 (2013).
- Moens, A. L., Goovaerts, I., Claeys, M. J., Vrints, C. J. Flow-mediated vasodilation. Chest. 127, 2254-2263 (2005).
- Gnasso, A., et al. Association between wall shear stress and flow-mediated vasodilation in healthy men. Atherosclerosis. 156, 171-176 (2001).
- Verma, S., et al. Cross-sectional evaluation of brachial artery flow-mediated vasodilation and C-reactive protein in healthy individuals. European Heart Journal. 25, 1754-1760 (2004).
- Donald, A. E., et al. Methodological Approaches to Optimize Reproducibility and Power in Clinical Studies of Flow-Mediated Dilation. Journal of the American College of Cardiology. 51, 1959-1964 (2008).
- Witte, D. R., et al. Is the Association Between Flow-Mediated Dilation and Cardiovascular Risk Limited to Low-Risk Populations. Journal of the American College of Cardiology. 45, 1987-1993 (2005).
- Benjamin, E. J., et al. Clinical Correlates and Heritability of Flow-Mediated Dilation in the Community: The Framingham Heart Study. Circulation. 109, 613-619 (2004).
- Nosova, E. V., et al. Short-term Physical Inactivity Impairs Vascular Function. Journal of Surgical Research. 10, (2014).
- Axtell, A. L., Gomari, F. A., Cooke, J. P. Assessing Endothelial Vasodilator Function with the Endo-PAT. Journal of Visualized Experiments. , (2000).
- Greenland, P., et al. ACCF/AHA Guideline for Assessment of Cardiovascular Risk in Asymptomatic AdultsA Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines Developed in Collaboration With the American Society of Echocardiography, American Society of Nuclear Cardiology, Society of Atherosclerosis Imaging and Prevention, Society for Cardiovascular Angiography and Interventions, Society of Cardiovascular Computed Tomography, and Society for Cardiovascular Magnetic Resonance. Journal of the American College of Cardiology. 56, (2010).
- Inaba, Y., Chen, J. A., Bergmann, S. R. Prediction of future cardiovascular outcomes by flow-mediated vasodilatation of brachial artery: a meta-analysis. The international journal of cardiovascular imaging. 26, 631-640 (2010).
- Black, M. A., Cable, N. T., Thijssen, D. H. J., Green, D. J. Importance of Measuring the Time Course of Flow-Mediated Dilatation in Humans. Hypertension. 51, 203-210 (2008).
- Chironi, G., Craiem, D., Miranda-Lacet, J., Levenson, J., Simon, A. Impact of shear stimulus, risk factor burden and early atherosclerosis on the time-course of brachial artery flow-mediated vasodilation. Journal of Hypertension. 26, 508-515 (2008).
- Bots, M. L., Westerink, J., Rabelink, T. J., Pd Koning, E. J. Assessment of flow-mediated vasodilatation (FMD) of the brachial artery: effects of technical aspects of the FMD measurement on the FMD response. European Heart Journal. 26, 363-368 (2005).
- Hijmering, M. L., et al. Sympathetic activation markedly reduces endothelium-dependent, flow-mediated vasodilation. Journal of the American College of Cardiology. 39, 683-688 (2002).

