Solid Lipid nanoparticelle (linfonodi sentinella) Applicazioni per intracellulare targeting
Summary
In this study, a method for synthesizing ultra-small populations of biocompatible nanoparticles was described, as well as several in vitro methods by which to assess their cellular interactions.
Abstract
Nanoparticle-based delivery vehicles have shown great promise for intracellular targeting applications, providing a mechanism to specifically alter cellular signaling and gene expression. In a previous investigation, the synthesis of ultra-small solid lipid nanoparticles (SLNs) for topical drug delivery and biomarker detection applications was demonstrated. SLNs are a well-studied example of a nanoparticle delivery system that has emerged as a promising drug delivery vehicle. In this study, SLNs were loaded with a fluorescent dye and used as a model to investigate particle-cell interactions. The phase inversion temperature (PIT) method was used for the synthesis of ultra-small populations of biocompatible nanoparticles. A 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenylphenyltetrazolium bromide (MTT) assay was utilized in order to establish appropriate dosing levels prior to the nanoparticle-cell interaction studies. Furthermore, primary human dermal fibroblasts and mouse dendritic cells were exposed to dye-loaded SLN over time and the interactions with respect to toxicity and particle uptake were characterized using fluorescence microscopy and flow cytometry. This study demonstrated that ultra-small SLNs, as a nanoparticle delivery system, are suitable for intracellular targeting of different cell types.
Introduction
Veicoli di consegna basata nanoparticelle hanno mostrato una grande promessa per le applicazioni destinate intracellulari, fornendo un meccanismo per alterare specificamente segnalazione cellulare e l'espressione genica. Questi veicoli possono essere caricati con farmaci, proteine e acidi nucleici progettati per influenzare la risposta cellulare e ottenere un effetto desiderato nei tessuti bersaglio. Molti tipi di nanovettori sono stati esplorati per beneficio terapeutico e diagnostica compresi lipidi, polimeri, silicio e materiali magnetici. Questi sistemi sono interessanti per la loro potenziale per la consegna della droga localizzato, aumento della concentrazione terapeutica nei tessuti bersaglio, e la riduzione della tossicità sistemica.
Nanoparticelle lipidiche solide (linfonodi sentinella) sono un esempio ben studiato di un sistema di erogazione di nanoparticelle che è emerso come un veicolo di consegna promettente farmaco negli ultimi anni. Linfonodi sentinella possono essere facilmente formulati per molteplici applicazioni tra cui bio-sensing 1, cosmetici 2, e tconsegna herapeutic 3-7. La loro utilità deriva dal fatto che essi sono costituiti interamente da riassorbibili, lipidi non tossici, con conseguente maggiore biocompatibilità. Durante la sintesi, farmaci lipofili possono essere incorporati in veicoli SLN, aumentando così la solubilità e l'idoneità farmaco per somministrazione parenterale. Veicoli SLN anche aiutare a stabilizzare terapeutica incapsulati, riducendo la loro degradazione e di liquidazione, e massimizzando azione terapeutica. Questi veicoli sono particolarmente adatti per lunga durata d'azione, le preparazioni a rilascio controllato per la loro stabilità alle 3,4,8,9 temperatura corporea. È importante sottolineare che l'incapsulamento dei farmaci in nanoparticelle lipidiche altera i profili farmacocinetici intrinseche delle molecole di droga. Ciò fornisce un vantaggio potenziale permettendo il rilascio controllato di farmaci con un ristretto indice terapeutico. Il tasso di rilascio di terapie SLN-incorporato può essere sintonizzato sulla base del tasso di degradazione dei lipidi o il tasso di diffusione della droga nelmatrice lipidica.
Linfonodi sentinella sono spesso progettati ad accumularsi nei tessuti bersaglio specifici. Ad esempio, le loro dimensioni (tipicamente maggiore di 10 nm) potenzia ritenzione nella circolazione, dove la vascolarizzazione del tessuto tumorale leaky facilita la deposizione. Inoltre, la via di somministrazione particella ha dimostrato di alterare biodistribuzione con la possibilità di indirizzare specifiche strutture fisiologiche quali linfonodi 10,11. Dopo la deposizione nei tessuti bersaglio, ottenendo adeguate interazioni cellulari ed eventuale internalizzazione delle nanoparticelle è difficile a causa della capacità delle membrane cellulari per controllare selettivamente il flusso di ioni e molecole dentro e fuori della cella 12. Per facilitare assorbimento cellulare, è possibile modificare nanovettori con leganti specifici inclusi peptidi, piccole molecole, e anticorpi monoclonali 13,14. Diversi meccanismi compresi sia penetrazione passivo e trasporto attivo di nanoparticelleattraverso la membrana cellulare precedentemente descritte 3,12,15. In generale, è stato dimostrato che le interazioni cellula-nanoparticelle sono influenzati dalle proprietà fisico-chimiche delle nanoparticelle tra cui le dimensioni, la forma, carica superficiale e chimica di superficie, oltre ai parametri specifici delle cellule, quali tipo di cellula o cella fase del ciclo 12.
Una precedente inchiesta ha dimostrato la sintesi di sub-10 nm linfonodi sentinella per uso topico 16 e biomarcatori applicazioni di rilevamento 1 con il metodo del 17 temperatura di inversione di fase (PIT). Questo è un metodo di sintesi in cui delicato 2 la composizione rimane costante mentre la temperatura viene gradualmente cambiata. Continua agitazione della soluzione riscaldata, mentre si raffredda a risultati RT in una nanoemulsione. Questo processo determina la sintesi di linfonodi sentinella con granulometria inferiore 1 di quella precedentemente riportata utilizzando vari metodi per la sintesi di lipidi nanoparticles 17-22. La scala di dimensioni risulta, a meno di 20 nm, offre un vantaggio per le applicazioni di targeting intracellulare a causa di una maggiore superficie e il potenziale di interazioni cellulari avanzati.
Uno schema di linfonodi sentinella, destinata a fornire un colorante fluorescente o terapeutico, è mostrata in Figura 1. I linfonodi sentinella costituiti da un lipide interni (ad esempio, alcano lineare) permettendo l'incorporazione di composti lipofili (ad esempio, coloranti o terapeutici) e un esterno tensioattivo (tensioattivo non ionico ad esempio, lineare) circondato da acqua. In questo studio, linfonodi sentinella sono stati caricati con un colorante fluorescente e usati come modello per studiare le interazioni delle particelle-cellula. Fibroblasti dermici umani primari e le cellule dendritiche di topo sono state esposte per tingere-caricato SLN nel tempo al fine di caratterizzare le interazioni in termini di tossicità e l'assorbimento delle particelle. Un test 3- (4,5-dimetiltiazol-2-il) -2,5-diphenylphenyltetrazolium bromuro (MTT) era Utilized al fine di stabilire adeguati livelli di dosaggio. Microscopia a fluorescenza e citometria a flusso sono stati due metodi utilizzati per esaminare l'assorbimento delle particelle in vitro.
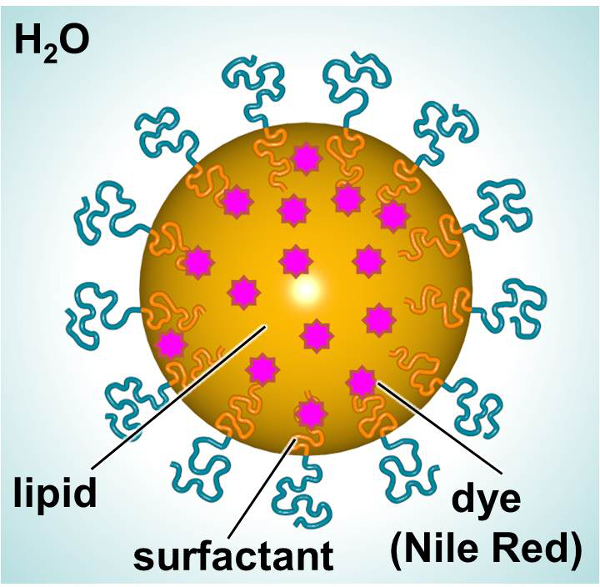
Figura 1. Schema del linfonodo sentinella che mostra i principali componenti. Cliccate qui per vedere una versione più grande di questa figura.
Protocol
Representative Results
Discussion
In questo studio, la sintesi di linfonodi sentinella e loro applicabilità per le applicazioni destinate intracellulari sono state esplorate. Queste nanoparticelle biocompatibili hanno mostrato risultati promettenti come veicoli di consegna per più applicazioni, tra cui la somministrazione di farmaci, silenziamento genico, e le tecnologie di vaccini 25-30. Ultra-piccoli linfonodi sentinella sono stati sintetizzati utilizzando un processo facile, e sono state esplorate le loro interazioni con le cellule della…
Declarações
The authors have nothing to disclose.
Acknowledgements
Research reported in this publication was supported by The Johns Hopkins Applied Physics Laboratory’s Research and Exploratory Development Department, Office of Technology Transfer, and Stuart S. Janney Fellowship Program, in addition to the National Heart, Lung, and Blood Institute of the National Institutes of Health under Award Number R21HL127355.
Materials
| Nile Red (NiR) | Sigma | 19123 | BioReagent, suitable for fluorescence, ≥98.0% |
| Heneicosane | Aldrich | 286052 | 98% |
| Brij O10 | Sigma | P6136 | Brij 97, C18-1E10, Polyoxyethylene (10) oleyl ether |
| Water | Sigma | W3500 | Sterile-filtered, BioReagent, suitable for cell culture |
| Syringe Filter 0.2 µm Supor Membrane Low Protein Binding | Life Sciences | PN4612 | Non-Pyrogenic |
| Nanotrac Ultra | Microtrac | serial number U1985IS | Instrument |
| Differential Scanning Calorimeter | Mettlet-Toledo | —- | Instument |
| Primary human fibroblasts | Life Technologies | C-004-5C | Neonatal (HDFn) |
| Medium 106 | Life Technologies | M-106-500 | A sterile, liquid medium for the culture of human dermal fibroblasts. |
| Low Serum Growth Supplement Kit (LSGS Kit) | Life Technologies | S-003-K | All the components of complete LSGS |
| MTT Cell Proliferation Assay Kit | Trevigen | 4890-025-K | Sensitive kit for the measurement of cell proliferation based upon the reduction of the tetrazolium salt, 3,[4,5-dimethylthiazol-2- yl]-2,5-diphenyl-tetrazolium bromide (MTT) |
| Safire2 microplate reader | Tecan | —- | Instrument |
| Phosphate buffered saline | Sigma | P5493 | For molecular biology |
| Recombinant murine GM-CSF | R&D Systems | 415 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
| Recombinant murine IL-4 | R&D Systems | 404 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
Referências
- Calderon-Colon, X., et al. Synthesis of sub-10 nm solid lipid nanoparticles for topical and biomarker detection applications. J Nanopart Res. 16 (2252), 1-10 (2014).
- Patwekar, S., et al. Review on nanoparticles used in cosmetics and dermal products. World Journal of Pharmacy and Pharmaceutical Sciences. 3 (8), 1407-1421 (2014).
- Martins, S., et al. Solid lipid nanoparticles as intracellular drug transporters: An investigation of the uptake mechanism and pathway. International Journal of Pharmaceutics. 430, 216-227 (2012).
- Yadav, N., Khatak, S., Sara, U. V. S. Solid Lipid Nanoparticles – A Review. International Journal of Applied Pharmaceuticals. 5 (2), 8-18 (2013).
- Weber, S., Zimmer, A., Solid Pardeike, J. Lipid Nanoparticles (SLN) and Nanostructured Lipid Carriers (NLC) for pulmonary application: a review of the state of the art. Eur J Pharm Biopharm. 86 (1), 7-22 (2014).
- Mahajan, A., Kaur, S., Grewal, N. K., Kaur, S. Solid Lipd Nanoparticles (SLNs) – As Novel Lipd based Nanocarriers for Drugs. International Journal of Advanced Research. 2 (1), 433-441 (2014).
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Malam, Y., Loizidou, M., Seifalian, A. M. Liposomes and nanoparticles: nanosized vehicles for drug delivery in cancer. Trends Pharmacol Sci. 30 (11), 592-599 (2009).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers. Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Ali Khan, A., Mudassir, J., Mohtar, N., Darwis, Y. Advanced drug delivery to the lymphatic system: lipid-based nanoformulations. International journal of nanomedicine. 8, 2733-2744 (2013).
- Oussoren, C., Storm, G. Liposomes to target the lymphatics by subcutaneous administration. Advanced drug delivery reviews. 50, 143-156 (2001).
- Shang, L., Nienhaus, K., Nienhaus, G. U. Engineered nanoparticles interacting with cells: size matters. J Nanobiotechnology. 12, 5 (2014).
- Joshi, M. D., Muller, R. H. Lipid nanoparticles for parenteral delivery of actives. European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik e.V. 71, 161-172 (2009).
- Torchilin, V. P. Micellar nanocarriers: pharmaceutical perspectives. Pharmaceutical research. 24, 1-16 (2007).
- Ashley, C. E., et al. The targeted delivery of multicomponent cargos to cancer cells by nanoporous particle-supported lipid bilayers. Nature materials. 10, 389-397 (2011).
- Patchan, M., et al. Nanotech; Nanotechnology 2013: Bio Sensors Instruments, Medical, Environment and Energy; Chapter 3: Materials for Dru., and Gene Delivery. Nanobandage for controlled release of topical therapeutics. 3, 255-258 (2013).
- Forgiarini, A., Esquena, J., Gonzalez, C., C, S., Koutsoukos, P. Formation and stability of nano-emulsions in mixed nonionic surfactant systems. Trends in colloid and interface science XV. Progress in Colloid and Polymer Science. 118, 184-189 (2001).
- Nantarat, T., Chansakaow, S., Leelapornpisid, P. Optimization, characterization and stability of essential oils blend loaded nanoemulsions by PIC technique for anti-tyrosinase activity. International Journal of Pharmacy and Pharmaceutical Sciences. 7, 308-312 (2015).
- Sevcikova, P., Vltavska, P., Kasparkova, V., Formation Krejci, J. Characterization and Stability of Nanoemulsions Prepared by Phase Inversion. , 132-137 (2011).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C., Buckin, V. Studies of the relation between phase behavior and emulsification methods with nanoemulsion formation. Trends in colloid and interface science XIV. Progress in Colloid and Polymer Science. 115, 36-39 (2000).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C. Formation of nano-emulsions by low-energy emulsification methods at constant temperature. Langmuir. 17 (7), 2076-2083 (2001).
- Cabone, C., Tomasello, B., Ruozi, B., Renis, M., Puglisi, G. Preparation and optimization of PIT solid lipid nanoparticles via statistical factorial design. Eur J Med Chem. 49, 110-117 (2012).
- Raimondi, G., et al. Mammalian Target of Rapamycin Inhibition and Alloantigen-Specific Regulatory T Cells Synergize To Promote Long-Term Graft Survival in Immunocompetent Recipients. J Immunol. 184, 624-636 (2010).
- Jhunjhunwala, S., Raimondi, G., Thomson, A. W., Little, S. R. Delivery of rapamycin to dendritic cells using degradable microparticles. J Control Release. 133 (13), 191-197 (2009).
- Kapse-Mistry, S., Govender, T., Srivastava, R., Yergeri, M. Nanodrug delivery in reversing multidrug resistance in cancer cells.. Front Pharmacol. 5 (159), 1-22 (2014).
- Musacchio, T., Torchilin, V. P. Recent developments in lipid-based pharmaceutical nanocarriers. Front Biosci (Landmark Ed). 1 (16), 1388-1412 (2011).
- Cerpnjak, K., Zvonar, A., Gašperlin, M., Vrečer, F. Lipid-based systems as a promising approach for enhancing the bioavailability of poorly water-soluble drugs). Acta Pharm. 63 (4), 27-445 (2013).
- Rodrìguez-Gascòn, A., Pozo-Rodrìguez, A., Solinìs, M. A. Development of nucleic acid vaccines: use of self-amplifying RNA in lipid nanoparticles. Int J Nanomedicine. 9, 1833-1843 (2014).
- Almeida, A. J., Souto, E. Solid lipid nanoparticles as a drug delivery system for peptides and proteins. Adv Drug Deliv Rev. 59, 478-490 (2007).
- Pardeshi, C., et al. Solid lipid based nanocarriers: an overview. Acta Pharm. 62, 433-472 (2012).
- Attama, A. A., Momoh, M. A., Builders, P. F., Sezer, A. D. Lipid Nanoparticulate Drug Delivery Systems: A Revolution in Dosage Form Design and Development. Recent Advances in Novel Drug Carrier Systems. , 107-140 (2012).

