La perfusé Technique du rein de souris isolé
Summary
Le rein de souris isolé perfusé (MIPK) est une technique pour la tenue d' un rein de souris ex vivo sous conditions perfusés et fonctionnelles pendant 1 h. Les tampons et les techniques chirurgicales sont décrits en détail.
Abstract
Le rein de souris isolé perfusé (MIPK) est une technique pour la tenue d' un rein de souris ex vivo sous conditions perfusés et fonctionnelles pendant 1 h. Ceci est une condition préalable à l'étude de la physiologie de l'organe isolé et pour de nombreuses applications innovantes qui peuvent être possible à l'avenir, y compris perfusion décellularisation pour les reins bioingénierie ou l'administration d'anti-rejet ou de la drogue du génome édition à des doses élevées pour amorcer le rein pour la transplantation. Pendant le temps de la perfusion, le rein peut être manipulée, la fonction rénale peut être évaluée, ainsi que divers produits pharmaceutiques administrés. Après la procédure, le rein peut être transplanté ou traitées pour la biologie moléculaire, l'analyse biochimique ou examen microscopique.
Ce document décrit le perfusat et la technique chirurgicale nécessaire pour l'ex vivo perfusion des reins de souris. Détails de l'appareil de perfusion sont données et les données sont présentées montrant la vdonnées flux sanguin rénal, la résistance vasculaire, et d'urine comme micrographies fonctionnels électroniques de transmission des différents segments de néphron comme des lectures morphologiques et western blots de protéines de transport des différents segments de néphron comme lecture moléculaire: ESPONSABILITE de la préparation du rein.
Introduction
La perfusion isolée des organes a fait l'objet d'un effort continu entre les physiologistes depuis de nombreuses décennies 1. La technique permet à la fonction de l'organe, sans influences systémiques tels que la pression artérielle, les hormones, ou les nerfs, à étudier. Carl Eduard Loebell est considéré comme le premier à avoir décrit la perfusion réussie d'un rein isolé, en 1849 2. Depuis lors, le dispositif de perfusion a subi de raffinement significative. Frey et Gruber introduit un poumon artificiel pour l' oxygénation et pulsatiles pompes pour perfusion continue 2. Alors que les premiers chercheurs principalement étudié les reins de grands mammifères , à savoir, les porcs et les chiens 2 3 -le premier rapport de l'utilisation de reins de rats, par Weiss et al. , Était une étape importante dans l'étude de la perfusion de petit mammifère organe 4. Schurek et al. signalé la nécessité d'ajouter des érythrocytes de mammifère au perfusat si tubulaire rénale suffisanteoxygénation devait être atteint 5. Critical pour les expériences à long terme a été l'introduction de la dialyse continue de la mémoire tampon par le même groupe de recherche 6. En 2003, Schweda et al. ont été les premiers à signaler un rein de souris fonctionnelle isolé perfusé (MIPK) 7, puis affiné par Rahgozar et al. 18 et Lindell et al. 14.
Bien que techniquement plus difficile que le rat isolé rein perfusé, l'utilisation du MIPK porte l'avantage de permettre l'utilisation d'une large gamme de souris génétiquement modifiées. Cet article présente les détails de la méthode des auteurs pour perfuser les reins de souris isolées pendant 1 h. La méthode permet l'évaluation continue des taux d'écoulement rénale, la résistance vasculaire, la libération d'hormones, l'analyse des gaz du sang, analyse d'urine, et l'application de la drogue. Après la procédure, les reins peuvent être traitées pour l'analyse moléculaire et biochimique, fixés pour la microscopie, outransplantées dans une souris réceptrice (figure 1).
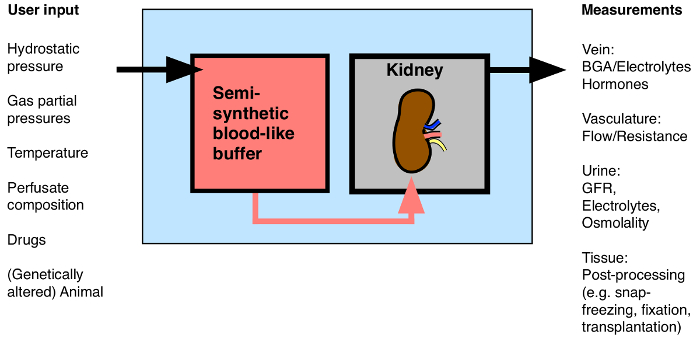
Figure 1: Vue d'ensemble de possibles entrées / sorties du rein isolé perfusé. BGA: analyse des gaz du sang. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Cette technique sera probablement recevoir une attention croissante au cours des prochaines années, car de nombreuses applications innovantes sont en cours de discussion à l'aube de longue normothermique perfusion rénale avant la transplantation (avec ou sans l'application d'anti-rejet ou de la drogue du génome édition) 8, 9, 10 , 11, la bioingénierie des reins entiers de échafauds décellularisés 12, et l'application de doses élevées de colorants fluorescents pour multiphotonique imagerie 13 </sup>. Il est également un modèle idéal avec lequel pour étudier le rôle des gènes spécifiques lors de lésions rénales aiguës 14.
Un protocole étape par étape est donnée pour permettre à d'autres laboratoires pour effectuer isolé souris perfusion rénale avec succès. Tout d'abord, la composition et la préparation de la mémoire tampon est spécifiée. Ensuite, l'opération est décrite en détail, et les étapes essentielles sont représentées. En troisième lieu, les données sont présentées qui sont représentatives d'une préparation réussie: le flux sanguin rénal, la résistance vasculaire, le taux de filtration glomérulaire, et l'électrolyte fractionnée d'excrétion toutes les mesures que fonctionnelles des micrographies de viabilité et électronique à transmission de la morphologie des différents segments de néphron des reins perfusés fixée après 1 h de perfusion.
Protocol
Representative Results
Discussion
La souris isolé rein perfusé est un outil pour l' étude de la fonction rénale dans un environnement contrôlé ex vivo pendant 1 heure, combler le fossé entre les expériences in vivo chez les animaux intacts, ce qui peut être faussée par l'impact de nombreux facteurs systémiques, et des expériences in vitro en segments de néphron isolés ou des cellules en culture, qui négligent nécessairement l'impact de la structure des organes intacts sur la fonction. Il es…
Declarações
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Hans-Joachim Schurek for invaluable scientific advice. The authors would like to thank Monique Carrel and Michèle Heidemeyer for excellent technical assistance, David Penton Ribas and Nourdine Faresse for a critical reading of the manuscript and Carsten Wagner and Jürg Biber for the NaPi-2a antibody. This work was supported by the Swiss National Centre for Competence in Research “Kidney.CH” and by a project grant (310030_143929/1) from the Swiss National Science Foundation.
Materials
| Perfusion Circuit: | |||
| Moist chamber 834/8 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2901 | |
| Cannular with basket and side port | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2947 | |
| Thermostat TC120-ST5 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-4544 | |
| ISM 827/230V Roller Pump Reglo Analogue | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-0114 | |
| Reservoir jacketed for buffer solution 1L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3438 | |
| Reservoir jacketed for buffer solution 0.5L | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3436 | |
| Pressure Transducer APT300 | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3862 | |
| TAM-D Plugsys Transducer | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-1793 | |
| SCP Plugsys servo controller | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-2806 | |
| Windkessel | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3717 | |
| HSE-USB data acquisition | Harvard Apparatus/Hugo Sachs Elektronik GmbH | 73-3330 | |
| Low-Flux Dialysator Diacap Polysulfone | B.Braun | 7203525 | |
| PE-Tubing for aorta cannulation 1.19mm I.D. x 1.70mm O.D. | Scientific Commodities Inc. | BB31695-PE/8 | |
| Name | Company | Catalog Number | Comments |
| Buffer reagents: | |||
| Aminoplasmal 10% | B.Braun | 134518064 | |
| Sodium pyruvate | Sigma-Aldrich | P2256-25G | |
| L-Glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626-100G | |
| L-(-)-Malic acid sodium salt | Sigma-Aldrich | M1125-25G | |
| Sodium-L-Lactate | Sigma-Aldrich | L7022-10G | |
| alpha-Ketoglutaric acid sodium salt | Sigma-Aldrich | K1875-25G | |
| NaCl | Sigma-Aldrich | 31434-1KG-R | |
| NaHCO3 | Sigma-Aldrich | S5761-5KG | |
| KCl | Sigma-Aldrich | 60130-1KG | |
| Urea | Sigma-Aldrich | U5378-500G | |
| Creatinine | Sigma-Aldrich | C4255-10G | |
| Ampicillin | Roche | 10835242001 | |
| MgCl2 * 6H2O | Sigma-Aldrich | M2393-500G | |
| D-Glucose | Sigma-Aldrich | G8270-1KG | |
| CaCl2 * 6H2O | Riedel-de-Haën | 12074 | |
| NaH2PO4 | Sigma-Aldrich | S9638-500G | |
| Na2HPO4 | Sigma-Aldrich | S0876-500G | |
| Antidiuretic Hormone dDAVP | Sigma-Aldrich | V2013-1MG | |
| FITC-Inulin | Sigma-Aldrich | ||
| Filter used for erythrocyte filtration | Macherey-Nagel | MN 615 | |
| BGA Analysis: | |||
| ABL 80 flex | Radiometer Medical ApS | ||
| Electron Microscope: | |||
| Philips CM100 TEM | FEI |
Referências
- Carrel, A., Lindbergh, C. A. The culture of whole organs. Science (New York, N.Y.). 81 (2112), 621-623 (1935).
- Skutul, K. . Über Durchströmungsapparate Pflüger’s Archiv. 123 (4-6), 249-273 (1908).
- Nizet, A. The isolated perfused kidney: possibilities, limitations and results. Kidney Int. 7 (1), 1-11 (1975).
- Weiss, C., Passow, H., Rothstein, A. Autoregulation of flow in isolated rat kidney in the absence of red cells. Am J Physiol. 196 (5), 1115-1118 (1959).
- Schurek, H. J., Kriz, W. Morphologic and functional evidence for oxygen deficiency in the isolated perfused rat kidney. Lab Invest. 53 (2), 145-155 (1985).
- Stolte, H., Schurek, H. J., Alt, J. M. Glomerular albumin filtration: a comparison of micropuncture studies in the isolated perfused rat kidney with in vivo experimental conditions. Kidney Int. 16 (3), 377-384 (1979).
- Schweda, F., Wagner, C., Krämer, B. K., Schnermann, J., Kurtz, A. Preserved macula densa-dependent renin secretion in A1 adenosine receptor knockout mice. AJP Renal Physiol. 284 (4), F770-F777 (2003).
- Moers, C., Smits, J. M., et al. Machine perfusion or cold storage in deceased-donor kidney transplantation. N Engl J Med. 360 (1), 7-19 (2009).
- Nicholson, M. L., Hosgood, S. A. Renal transplantation after ex vivo normothermic perfusion: the first clinical study. Am J Transplant. 13 (5), 1246-1252 (2013).
- Worner, M., Poore, S., Tilkorn, D., Lokmic, Z., Penington, A. J. A low-cost, small volume circuit for autologous blood normothermic perfusion of rabbit organs. Art Org. 38 (4), 352-361 (2014).
- Kaths, J. M., Spetzler, V. N., et al. Normothermic Ex Vivo Kidney Perfusion for the Preservation of Kidney Grafts prior to Transplantation. J Vis Exp. (101), e52909 (2015).
- Song, J. J., Guyette, J. P., Gilpin, S. E., Gonzalez, G., Vacanti, J. P., Ott, H. C. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Med. 19 (5), 646-651 (2013).
- Hall, A. M., Crawford, C., Unwin, R. J., Duchen, M. R., Peppiatt-Wildman, C. M. Multiphoton imaging of the functioning kidney. JASN. 22 (7), 1297-1304 (2011).
- Lindell, S. L., Williams, N., Brusilovsky, I., Mangino, M. J. Mouse IPK: A Powerful Tool to Partially Characterize Renal Reperfusion and Preservation Injury. Open Transplant J. 5, 15-22 (2011).
- Wagner, C., De Wit, C., Kurtz, L., Grünberger, C., Kurtz, A., Schweda, F. Connexin40 is essential for the pressure control of renin synthesis and secretion. Circ Res. 100 (4), 556-563 (2007).
- Czogalla, J., Vohra, T., Penton, D., Kirschmann, M., Craigie, E., Loffing, J. The mineralocorticoid receptor (MR) regulates ENaC but not NCC in mice with random MR deletion. Pflüger’s Archiv. , (2016).
- Poosti, F., et al. Precision-cut kidney slices (PCKS) to study development of renal fibrosis and efficacy of drug targeting ex vivo. Dis Model Mech. 8 (10), 1227-1236 (2015).
- Rahgozar, M., Guan, Z., Matthias, A., Gobé, G. C., Endre, Z. H. Angiotensin II facilitates autoregulation in the perfused mouse kidney: An optimized in vitro model for assessment of renal vascular and tubular function. Nephrology. 9 (5), 288-296 (2004).

