Bepaling van de Relatieve celoppervlak en Total Expressie van recombinant Ion kanalen met flowcytometrie
Summary
Erfelijke hartritmestoornissen worden vaak veroorzaakt door mutaties die de oppervlakte levering van één of meer ionkanalen wijzigen. Hier passen we flowcytometrie assays een kwantificering van de relatieve totale en celoppervlak-eiwit expressie van recombinant ionenkanalen tot expressie gebracht in TSA-201 cellen.
Abstract
Inherited or de novo mutations in cation-selective channels may lead to sudden cardiac death. Alteration in the plasma membrane trafficking of these multi-spanning transmembrane proteins, with or without change in channel gating, is often postulated to contribute significantly in this process. It has thus become critical to develop a method to quantify the change of the relative cell surface expression of cardiac ion channels on a large scale. Herein, a detailed protocol is provided to determine the relative total and cell surface expression of cardiac L-type calcium channels CaV1.2 and membrane-associated subunits in tsA-201 cells using two-color fluorescent cytometry assays. Compared with other microscopy-based or immunoblotting-based qualitative methods, flow cytometry experiments are fast, reproducible, and large-volume assays that deliver quantifiable end-points on large samples of live cells (ranging from 104 to 106 cells) with similar cellular characteristics in a single flow. Constructs were designed to constitutively express mCherry at the intracellular C-terminus (thus allowing a rapid assessment of the total protein expression) and express an extracellular-facing hemagglutinin (HA) epitope to estimate the cell surface expression of membrane proteins using an anti-HA fluorescence conjugated antibody. To avoid false negative, experiments were also conducted in permeabilized cells to confirm the accessibility and proper expression of the HA epitope. The detailed procedure provides: (1) design of tagged DNA (deoxyribonucleic acid) constructs, (2) lipid-mediated transfection of constructs in tsA-201 cells, (3) culture, harvest, and staining of non-permeabilized and permeabilized cells, and (4) acquisition and analysis of fluorescent signals. Additionally, the basic principles of flow cytometry are explained and the experimental design, including the choice of fluorophores, titration of the HA antibody and control experiments, is thoroughly discussed. This specific approach offers objective relative quantification of the total and cell surface expression of ion channels that can be extended to study ion pumps and plasma membrane transporters.
Introduction
Dit artikel geeft een betrouwbare test om de relatieve expressie van celoppervlak membraaneiwitten zoals ionenkanalen tot expressie gebracht in recombinante cellen met de aanwezige flowcytometrie techniek melden. Ionenkanalen porie-vormende membraaneiwitten die verantwoordelijk zijn voor het regelen van elektrische signalen door het poorten van de stroming van ionen door de celmembraan. Zij worden ingedeeld door de activatie mechanisme, natuur, en de selectiviteit van de ion soorten op doorreis in de poriën waar ze worden gelokaliseerd. Op cellulair en weefsel niveaus, de macroscopische ion fluxen door middel van ion kanalen zijn het product van biofysische (gating en permeatie), biochemische (fosforylering), en biogenese (synthese, glycosylering, mensenhandel en afbraak) eigenschappen 1. Elk van deze processen is uniek voor elk type ionenkanalen en is geoptimaliseerd om de fysiologische rol van het ionkanaal voldoen. Derhalve veranderingen in elk van deze verfijnde 'via deerfelijke of door genetische modificatie, vaak aangeduid als "channelopathy", kan schadelijk celhomeostase zijn. Het is belangrijk te benadrukken dat het leveren van de "juiste" hoeveelheid ionenkanalen aan het celoppervlak is essentieel voor celhomeostase. Zelfs kleine stijgingen (gain-of-functie) en kleine dalingen (verlies-van-functie) in ionkanaal activiteit hebben de potentie om een ernstige pathologie over een leven leiden. Defecten in het celoppervlak levering van rijpe ionkanalen is een belangrijke determinant in talrijke kanalopathieën, zoals cystische fibrose (CFTR ionkanaal) 2 en hartritmestoornissen van het lange QT syndroom vorm (cardiale kaliumkanalen) 3.
Kanalopathieën worden geassocieerd met cardiale plotselinge dood 4. De huidige wereldwijde prevalentie van alle cardiale kanalopathieën wordt gedacht dat minstens 1 te zijn: 2,000-1: 3000 per persoon 5 en zijn verantwoordelijk voor ongeveer de helft van een plotselinge aritmische hartdood cases 6. Disfunctie bij cardiale spanningsafhankelijke natrium-, kalium-, calcium- en selectieve ionenkanalen zijn bekend een belangrijke rol spelen in dit proces. De L-type Ca V 1.2-voltage-gated calcium kanaal is vereist om gesynchroniseerd hartspier contractie te starten. De cardiale L-type Ca 1,2 V kanaal is een multi-subeenheid proteïne complex samengesteld uit het porievormende Ca V α1 subeenheid en Ca Vss en Ca V α2δ1 aanvullende subeenheden 7-12. Merk op dat de volledige set van hulp- subeenheden vereist om functionele Ca V 1,2 kanalen in het plasmamembraan en dynamische interacties veroorzaken tussen deze subeenheden zijn essentieel voor de normale elektrische functie van het hart 13 te ondersteunen. Ca V ß bevordert het celoppervlak expressie van ca 1,2 V kanalen via een niet-covalente hydrofobe interactie nanomolair 14. Co-expressie van de Ca V α2δ1 subunit with Ca V ß-gebonden Ca V α1 stimuleert piekstroom uitdrukking (5 tot 10-voudig) en bevordert kanaal activering op meer negatieve spanningen. Gain-of-function mutaties van het porievormende subeenheid Ca V 1,2 zijn geassocieerd met een vorm van ventriculaire aritmieën genoemd het lange QT syndroom 15 dat samen met puntmutaties in de drie subeenheden die het L-type Ca V 1,2 kanaal geïdentificeerd in individuen die lijden aan aritmieën van de korte QT syndroom vorm 16,17. Ion kanalen zijn membraaneiwitten die kunnen worden onderzocht vanuit een biochemisch perspectief (eiwit chemie) of met behulp van elektrofysiologische instrumenten (huidige genererende machines) en vaak met behulp van deze complementaire aanpak. Elektrofysiologie, met name whole-cell patch-klemming, is een geschikte benadering voor de functie van ionkanalen 15 verhelderen maar kan niet wijzigingen in proteïne transport lossen van veranderingen in hun biofysischeeigenschappen. Eiwitchemie is echter vaak beperkt gebruik door de relatief lage expressie van grote membraaneiwitten opzichte van kleinere oplosbare eiwitten. Robuuste high-throughput methoden met behulp van fluorescentie uitlezing moeten worden ontwikkeld om specifiek ingegaan op gebreken in eiwitten biogenese veroorzaken van veranderingen in het celoppervlak expressie van ionkanalen.
Flowcytometrie is een biofysische technologie gebruikt in cel tellen, sorteren, biomarker opsporing en protein engineering 18. Wanneer een monsteroplossing van levende cellen of deeltjes cytometer in een stroom wordt geïnjecteerd, worden de cellen gerangschikt in een enkele stroom die kan worden gesondeerd door de machine detectiesysteem (figuur 1). De eerste stromingscytometer akte in 1956 19 gedetecteerd slechts één parameter maar modern flowcytometers meerdere lasers en fluorescentiedetectoren dat de detectie van meer dan 30 fluorescerende 20,21 parameters mogelijk.Filters en spiegels (emissie optiek) richt de lichtverstrooiing of TL-licht van cellen aan een elektronisch netwerk (fotodiode en detectoren), die het licht proportioneel om te zetten in de intensiteit ervan. Digitale gegevens worden geanalyseerd met gespecialiseerde software en de eerste uitgang wordt weergegeven als puntenplot 21.
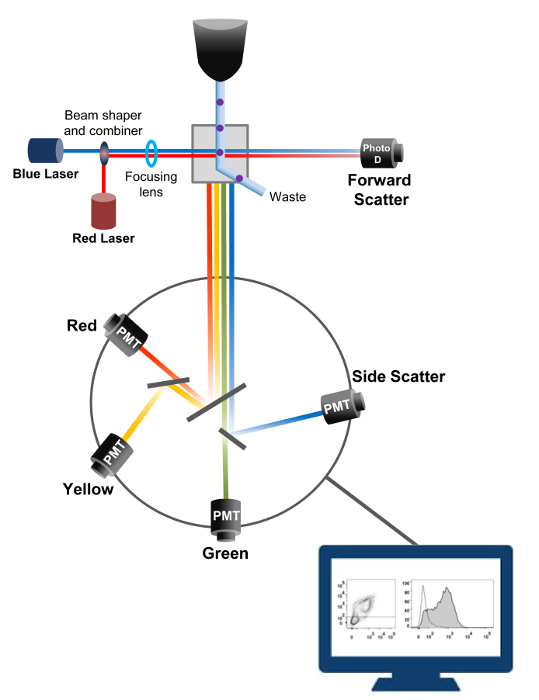
Figuur 1:. Biofysische principes flowcytometrie sorteren Single cellen worden geduwd door een sproeier onder hoge druk in een stroom omhullingfluïdum die hen beweegt op een of meerdere laser afvraagpunten. De lichtbundel wordt afgebogen door de passerende cellen en verzameld in de voorwaartse richting (Forward Scatter, FCS) licht naar een fotodiode die het licht omzet in een signaal evenredig aan de grootte van de cel. Het licht wordt ook verzameld op een 90 ° hoek met de laser pad en naar detectors (ook wel fotomultipliers (PMT)).Dit licht wordt via dichroïsche spiegels die de detectie van het signaal zijwaartse verstrooiing (SSC), die de korreligheid in de cellen weerspiegelt mogelijk, en de fluorescente emissie als opgewonden fluorochromen in de cel aanwezig zijn. Drie detectoren (groen, geel en rood) worden weergegeven met verschillende golflengte banddoorlaatfilters, waardoor de gelijktijdige detectie van verschillende fluorochromen. De verschillende signalen worden gedigitaliseerd door een externe computer en omgezet in gegevens die worden geanalyseerd om de eigenschappen van de cellen te kwantificeren. Klik hier om een grotere versie van deze figuur te zien.
De high-throughput capaciteit van flowcytometers werd benut om de relatieve membraan expressie van recombinant wild-type en de handel-deficiënte voltage-gated L-type Ca V 1.2 kanalen en bijbehorende subeenheden in levende cellen te kwantificeren. cDNA constructen coding voor de eiwitten werden dubbel gelabeld om gelijktijdig een extracellulair niet fluorescerende epitoop die door een ondoordringbare fluorescerend geconjugeerd antilichaam en een intracellulair fluorofoor die constitutief fluorescerende kan worden gedetecteerd. Zowel de extracellulaire epitoop, een extracellulaire lus van het eiwit geplaatst, en de intracellulaire fluorofoor, ingevoegd na de C-terminus, worden omgezet met het eiwit. In deze reeks experimenten werd het Ca V α2δ1 eiwit ontworpen om een extracellulaire hemagglutinine (HA) epitoop (YPYDVPDYA) gedetecteerd door een ondoordringbare FITC (fluoresceïne isothiocyanaat) expressie geconjugeerd anti-HA en mCherry de intrinsieke intracellulaire fluorofoor. De relatieve celoppervlak expressie van het mCherry-Ca V α2δ1 HA-gemerkt eiwit te bepalen, werden recombinante cellen die het fusie-eiwit na transfectie geoogst en gekleurd met FITC-geconjugeerd monoklonaal anti-HA-epitooplabel Antibody (figuur 2). FITC is een organische fluorescente verbinding die aanzienlijk kleiner is dan enzym verslaggevers en dus niet zoveel kans om te interfereren met de biologische functie. mCherry- Ca V α2δ1 HA-overexpressie in TSA-201cells, levert aanzienlijk 3-log toename van de FITC fluorescentie en fluorescentie mCherry twee-dimensionale plots 22. Aangezien de HA epitoop in het extracellulaire deel van het eiwit, de fluorescentie-intensiteit van FITC verkregen in aanwezigheid van intacte cellen weerspiegelen de relatieve index van het celoppervlak expressie van HA-gemerkt eiwit. De toegankelijkheid van de HA epitoop in de constructen systematisch gevalideerd door het FITC signaal nadat cel permeabilisatie. Deze maatregel dient ook om de genormaliseerde totale eiwitexpressie bevestigen aangezien de relatieve fluorescentie intensiteiten voor FITC in gepermeabiliseerde cellen geschat zijn kwalitatief vergelijkbaar met de relatieve fluorescentiewaarden for mCherry gemeten onder permeabel en non-gepermeabiliseerde voorwaarden 22,23. Het is belangrijk op te merken dat de intrinsieke fluorescentie spectrum wordt verschoven naar hogere waarden na permeabilisatie maar dat de enige waarde wordt gerapporteerd is de verandering in fluorescentie-intensiteit in vergelijking met de controle construct. Relatieve veranderingen in de fluorescentie-intensiteit voor de test constructen worden geschat aan de hand van de ΔMean Fluorescence Intensity (ΔMFI) waarden voor elke fluorofoor (mCherry of FITC). Experimenten zijn ontworpen om de fluorescentie-intensiteit van de testconstruct opzichte van de fluorescentie-intensiteit van de controle construct tot expressie gebracht onder dezelfde omstandigheden gemeten experimentele variaties beperken de intrinsieke fluorescentie van het fluorofoor-geconjugeerde antilichaam. Twee membraaneiwitten met succes onderzocht met behulp van deze test: de porie vormende subeenheid van het L-type spanningsafhankelijke Ca calciumkanaal V 1,2 14,22 en een andere reeksexperimenten, de extracellulaire extra Ca V α2δ1 subunit 22,23. Het volgende protocol werd toegepast om de celoppervlak expressie van het Ca V α2δ1 subunit van het cardiale L-type Ca 1,2 V kanaal onder controle omstandigheden en na mutaties die de posttranslationele modificatie van het ionkanaal te bepalen. Onder gestandaardiseerde experimentele omstandigheden het celoppervlak fluorescentie van FITC verhoogt quasi-lineair met de expressie van cDNA dat codeert voor mCherry-Ca V α2δ1 HA-eiwitten (figuur 5 van referentie 22).
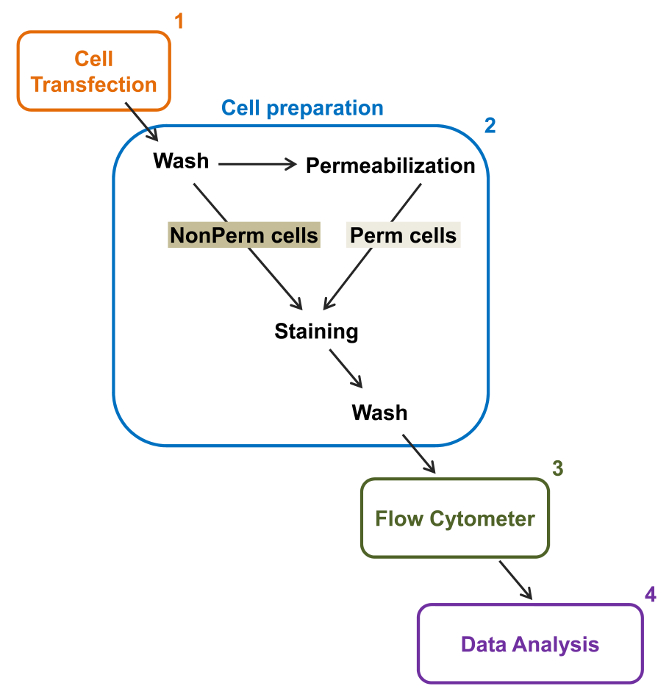
Figuur 2:. Schematische weergave van de totale en het membraan etikettering in de flowcytometrie experimentele protocol De regeling schetst enkele van de belangrijkste stappen die nodig zijn om de relatieve totale en celoppervlak expressie van recombinante ionkanalen door fl kwantificerenow cytometrie. Cellen worden getransfecteerd met de twee merktekens constructie mCherry-Ca V α2δ1-HA in TSA-201 cellen (1) en gekleurd voor of na permeabilisatie (2). Multiparameter gegevens worden verkregen in een flowcytometer (3) voor multivariate analyse (4). Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Dit flowcytometrie gebaseerde bepaling werd met succes toegepast op de meting van de relatieve totale en celoppervlak niveaus van fluorescentie-gemerkt porie-vormende en geassocieerde subeenheden van spanningsafhankelijke calciumkanalen 14,22,26. Het is het beste gebruikt bij het onderzoek naar de effecten van genetische mutaties en vereist dus dat de intrinsieke fluorescentie-intensiteit van de fluorescentie-gemerkt gelabeld wildtype construct ten minste 10 tot 100 maal groter dan de fluorescentie-intensitei…
Declarações
The authors have nothing to disclose.
Acknowledgements
We thank Mr. Serge Sénéchal and Dr. Jacques Thibodeau for sharing their expertise and granting us access to their flow cytometry and cell sorting platform. This work was completed with the operating grant 130256 from the Canadian Institutes of Health Research, a grant-in-aid from the Canadian Heart and Stroke Foundation, and support from the “Fondation de l’Institut de Cardiologie de Montréal” to L.P.
Materials
| Q5 Site-Directed Mutagenesis Kit | New England Biolabs | E0554S | Can be substitute with QuickChange site-directed mutagenesis Kit (Agilent, #200523). |
| Tubes 1,5 mL | Sarstedt | 72-690-001 | |
| Tubes 15 mL | Sarstedt | 62-554-002 | |
| Disposable graduated Tranfer Pipets | VWR | 160001-192 | |
| 100-mm culture dish | Corning | 430167 | For standard culture of HEKT cells. |
| 35-mm culture dish | Falcon | 353001 | For standard culture of HEKT cells. |
| Serological pipette 1 ml | Sarstedt | 86.1251.001 | |
| Serological pipette 5 ml | Sarstedt | 86.1253.001 | |
| Serological pipette 10 ml | Sarstedt | 86.1254.001 | |
| Serological pipette 25ml | Sarstedt | 86.1285.001 | |
| Dulbecco's high-glucose medium | Life Technologies | 12100-046 | Warm in 37°C water bath before use. |
| Fetal Bovine Serum, qualified, heat inactivated, US origin | Life Technologies | 16140-071 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140-122 | |
| Lipofectamine 2000 | Life Technologies | 11668-019 | For liposomal transfection. Can be substituted with calcium phosphate transfection. |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 31985-070 | Warm in 37°C water bath before use. |
| Trypsin-EDTA (1X) 0.05%, phenol red | Life Technologies | 25300-062 | |
| 1.5 mL microtubes | Sarstedt | 72.690.001 | |
| Phosphate Buffered Saline 1X | Fisher | BP661-10 | Can be "home-made". |
| Anti-HA FITC conjugated antibody | Sigma | H7411 | |
| IgG1−FITC Isotype Control antibody | Sigma | F6397 | |
| BD Cytofix/Cytoperm Fixation/Permeabilization Solution Kit | BD Biosciences | 554714 | Fixation/Permeabilization. Permeabilization/Wash solution, store at 4 °C. |
| Hemacytometer | Fisher | 49105161 | |
| Trypan Blue | Fisher | 15250061 | To access cell viability. |
| Refrigerated Microcentrifuge, 5430R | Eppendorf | A14H172200 | |
| Forma Steri-Cycle CO2 Incubator | Fisher | 370 | |
| Laboratory Platform Rocker | Fisher | 545034 | |
| Water Bath | VWR | 89032-216 | |
| BD FACSARIA III | BD Biosciences | 648282 | Flow cytometer. |
| FlowJo Software v10 | FlowJo | FlowJo v10 Dongle | For data analysis. |
Referências
- Delisle, B. P., Anson, B. D., Rajamani, S., January, C. T. Biology of Cardiac Arrhythmias: Ion Channel Protein Trafficking. Circ. Res. 94, 1418-1428 (2004).
- Birault, V., Solari, R., Hanrahan, J., Thomas, D. Y. Correctors of the basic trafficking defect of the mutant F508del-CFTR that causes cystic fibrosis. Curr Opin Chem Biol. 17, 353-360 (2013).
- Balijepalli, S. Y., Anderson, C. L., Lin, E. C., January, C. T. Rescue of Mutated Cardiac Ion Channels in Inherited Arrhythmia Syndromes. J. Cardiovas Pharm. 56, 113-122 (2010).
- Gargus, J. J. Unraveling Monogenic Channelopathies and Their Implications for Complex Polygenic Disease. Am. J. Hum. Genet. 72, 785-803 (2003).
- Abriel, H., Zaklyazminskaya, E. V. Cardiac channelopathies: Genetic and molecular mechanisms. Gene. 517, 1-11 (2013).
- Behr, E. R., et al. Sudden arrhythmic death syndrome: familial evaluation identifies inheritable heart disease in the majority of families. Eur Heart J. 29, 1670-1680 (2008).
- Catterall, W. A. Structure and regulation of voltage-gated Ca2+ channels. Annu. Rev. Cell Dev.Biol. 16, 521-555 (2000).
- Peterson, B. Z., DeMaria, C. D., Adelman, J. P., Yue, D. T. Calmodulin is the Ca2+ sensor for Ca2+ -dependent inactivation of L- type calcium channels. Neuron. 22, 549-558 (1999).
- Dolphin, A. C. Calcium channel diversity: multiple roles of calcium channel subunits. Curr.Opin.Neurobiol. 19, 237-244 (2009).
- Dai, S., Hall, D. D., Hell, J. W. Supramolecular assemblies and localized regulation of voltage-gated ion channels. Physiol Rev. 89, 411-452 (2009).
- Gao, T., et al. Identification and subcellular localization of the subunits of L-type calcium channels and adenylyl cyclase in cardiac myocytes. J. Biol. Chem. 272, 19401-19407 (1997).
- Carl, S. L., et al. Immunolocalization of sarcolemmal dihydropyridine receptor and sarcoplasmic reticular triadin and ryanodine receptor in rabbit ventricle and atrium. J. Cell Biol. 129, 673-682 (1995).
- Abriel, H., Rougier, J. S., Jalife, J. Ion Channel Macromolecular Complexes in Cardiomyocytes: Roles in Sudden Cardiac Death. Circ. Res. 116, 1971-1988 (2015).
- Bourdin, B., et al. Molecular Determinants of the Cavb-induced Plasma Membrane Targeting of the Cav1.2 Channel. J. Biol. Chem. 285, 22853-22863 (2010).
- Raybaud, A., et al. The Role of the GX9GX3G Motif in the Gating of High Voltage-activated Calcium Channels. J. Biol. Chem. 281, 39424-39436 (2006).
- Burashnikov, E., et al. Mutations in the cardiac L-type calcium channel associated with inherited J-wave syndromes and sudden cardiac death. Heart Rhythm. 7, 1872-1882 (2010).
- Hennessey, J. A., et al. A CACNA1C Variant Associated with Reduced Voltage-Dependent Inactivation, Increased Cav1.2 Channel Window Current, and Arrhythmogenesis. PLoS ONE. 9, e106982 (2014).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Graham, M. D. The Coulter Principle: Foundation of an Industry. J. Lab. Autom. 8, 72-81 (2003).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243, 77-97 (2000).
- Rothe, G., Sack, U., Tarnok, A., Rothe, G. . Cellular Diagnostics. Basics, Methods and Clinical Applications of Flow Cytometry. , 53-88 (2009).
- Bourdin, B., et al. Functional Characterization of Cavalpha2delta Mutations Associated with Sudden Cardiac Death. J. Biol. Chem. 290, 2854-2869 (2015).
- Tetreault, M. P., et al. Identification of glycosylation sites essential for surface expression of the Cavalpha2delta1 subunit and modulation of the cardiac Cav1.2 channel activity. J. Biol. Chem. 291, 4826-4843 (2016).
- Senatore, A., Boone, A. N., Spafford, J. D. Optimized Transfection Strategy for Expression and Electrophysiological Recording of Recombinant Voltage-Gated Ion Channels in HEK-293T Cells. J Vis Exp. (47), (2011).
- Herzenberg, L. A., Tung, J., Moore, W. A., Herzenberg, L. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat.Immunol. 7, 681-685 (2006).
- Shakeri, B., Bourdin, B., Demers-Giroux, P. O., Sauve, R., Parent, L. A quartet of Leucine residues in the Guanylate Kinase domain of Cavbeta determines the plasma membrane density of the Cav2.3 channel. J Biol Chem. 287, 32835-32847 (2012).
- Morton, R. A., Baptista-Hon, D. T., Hales, T. G., Lovinger, D. M. Agonist- and antagonist-induced up-regulation of surface 5-HT3A receptors. Br. J. Pharmacol. 172, 4066-4077 (2015).
- Hoffmann, C., et al. Fluorescent labeling of tetracysteine-tagged proteins in intact cells. Nat. Protocols. 5, 1666-1677 (2010).
- Cockcroft, C. J., Gamper, N. . Ion Channels: Methods and Protocols. , 233-241 (2013).
- Gonzalez-Gutierrez, G., Miranda-Laferte, E., Neely, A., Hidalgo, P. The Src Homology 3 Domain of the beta-Subunit of Voltage-gated Calcium Channels Promotes Endocytosis via Dynamin Interaction. J. Biol.Chem. 282, 2156-2162 (2007).
- Galizzi, J. P., Borsotto, M., Barhanin, J., Fosset, M., Lazdunski, M. Characterization and photoaffinity labeling of receptor sites for the Calcium channel inhibitors d-cis-diltiazem, (+/-)-bepridil, desmethoxyverapamil, and (+)-PN 200-110 in skeletal muscle transverse tubule membranes. J. Biol.Chem. 261, 1393-1397 (1986).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiol.Rev. 80, 555-592 (2000).
- Sigworth, F. J. The variance of sodium current fluctuations at the node of Ranvier. J Physiol. 307, 97-129 (1980).
- Bailey, M. A., Grabe, M., Devor, D. C. Characterization of the PCMBS-dependent modification of KCa3.1 channel gating. J. Gen. Physiol. 136, 367-387 (2010).
- Fletcher, P. A., Scriven, D. R., Schulson, M. N., Moore, E. D. Multi-Image Colocalization and Its Statistical Significance. Biophys. J. 99, 1996-2005 (2010).
- Lizotte, E., Tremblay, A., Allen, B. G., Fiset, C. Isolation and characterization of subcellular protein fractions from mouse heart. Anal. Biochem. 345, 47-54 (2005).
- Mattheyses, A. L., Simon, S. M., Rappoport, J. Z. Imaging with total internal reflection fluorescence microscopy for the cell biologist. J. Cell Sci. 123, 3621-3628 (2010).
- Yamamura, H., Suzuki, Y., Imaizumi, Y. New light on ion channel imaging by total internal reflection fluorescence (TIRF) microscopy. J. Pharmacol. Sci. 128, 1-7 (2015).
- Wible, B. A., et al. HERG-Lite-R: A novel comprehensive high-throughput screen for drug-induced hERG risk. J. Pharmacol. Toxicol. Methods. 52, 136-145 (2005).
- Wilde, A. A. M., Brugada, R. Phenotypical Manifestations of Mutations in the Genes Encoding Subunits of the Cardiac Sodium Channel. Circ. Res. 108, 884-887 (2011).
- Milano, A., et al. Sudden Cardiac Arrest and Rare Genetic Variants in the Community. Circ Cardiovasc Genet. , (2016).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nat. Meth. 9, 152-158 (2012).

