フローサイトメトリーを用いた組換えイオンチャネルの相対的な細胞表面および合計式の決意
Summary
継承された不整脈は、しばしば、一つ以上のイオンチャネルの表面の配信を変更する突然変異によって引き起こされます。ここでは、TSA-201細胞で発現された組換えイオンチャネルの相対的な合計および細胞表面タンパク質発現の定量化を提供するために、フローサイトメトリーアッセイを適合させます。
Abstract
Inherited or de novo mutations in cation-selective channels may lead to sudden cardiac death. Alteration in the plasma membrane trafficking of these multi-spanning transmembrane proteins, with or without change in channel gating, is often postulated to contribute significantly in this process. It has thus become critical to develop a method to quantify the change of the relative cell surface expression of cardiac ion channels on a large scale. Herein, a detailed protocol is provided to determine the relative total and cell surface expression of cardiac L-type calcium channels CaV1.2 and membrane-associated subunits in tsA-201 cells using two-color fluorescent cytometry assays. Compared with other microscopy-based or immunoblotting-based qualitative methods, flow cytometry experiments are fast, reproducible, and large-volume assays that deliver quantifiable end-points on large samples of live cells (ranging from 104 to 106 cells) with similar cellular characteristics in a single flow. Constructs were designed to constitutively express mCherry at the intracellular C-terminus (thus allowing a rapid assessment of the total protein expression) and express an extracellular-facing hemagglutinin (HA) epitope to estimate the cell surface expression of membrane proteins using an anti-HA fluorescence conjugated antibody. To avoid false negative, experiments were also conducted in permeabilized cells to confirm the accessibility and proper expression of the HA epitope. The detailed procedure provides: (1) design of tagged DNA (deoxyribonucleic acid) constructs, (2) lipid-mediated transfection of constructs in tsA-201 cells, (3) culture, harvest, and staining of non-permeabilized and permeabilized cells, and (4) acquisition and analysis of fluorescent signals. Additionally, the basic principles of flow cytometry are explained and the experimental design, including the choice of fluorophores, titration of the HA antibody and control experiments, is thoroughly discussed. This specific approach offers objective relative quantification of the total and cell surface expression of ion channels that can be extended to study ion pumps and plasma membrane transporters.
Introduction
この論文は、既存のフローサイトメトリー技術を使用して組換え細胞中で発現するイオンチャネルなどの膜タンパク質の相対的な細胞表面発現を報告するために信頼性のあるアッセイを提供します。イオンチャネルは、細胞膜を横切るイオンの流れをゲート制御することによって電気信号を制御する責任があるポア形成膜タンパク質です。これらは、活性化メカニズム、自然、そしてそれらがローカライズされている細孔を通って通過するイオン種の選択によって分類されています。細胞および組織レベルでは、イオンチャネルを介して、巨視的なイオンフラックスは、生物物理学的(ゲーティングと浸透)、生化学的(リン酸化)、および生合成(合成、グリコシル化、輸送、及び分解)の特性1の産物です。これらのプロセスの各々は、イオンチャネルの種類ごとに固有であり、イオンチャネルの生理学的役割を果たすように最適化されます。その結果、貫通これらの微調整プロセスのいずれかの変化遺伝性またはしばしば「チャネロパチー」という遺伝的改変は、細胞ホメオスタシスに有害であることができます。細胞表面でのイオンチャネルの「右」量を送達することは、細胞恒常性に重要であることを強調することが重要です。小さくても増加する(機能獲得型)とイオンチャネル活性のわずかな減少は、(機能喪失)生涯にわたって深刻な病状を引き起こす可能性があります。成熟したイオンチャネルの細胞表面の配信の欠陥は、嚢胞性線維症(CFTRイオンチャネル)2、QT延長症候群形態(心臓カリウムチャネル)3の不整脈として、多数のchannelopathiesにおける重要な決定因子です。
Channelopathiesは、心臓突然死4に関連しています。すべての心臓channelopathiesの現在の世界的な有病率は、少なくとも1であると考えられている:2,000-1:個々の5あたり3000と突然不整脈心臓死CAの約半分を担当していますSES 6。心臓の電位依存性ナトリウム – 、カリウムで機能不全、およびカルシウム選択性イオンチャネルは、このプロセスにおいて重要な役割を果たすことが知られています。 L型Ca V 1.2電圧依存性カルシウムチャネルは、同期心筋収縮を開始するために必要とされます。心臓のL型Ca V 1.2チャネルは、主孔形成のCa Vの α1サブユニットとのCa V SSとのCa Vα2δ1補助サブユニット7-12で構成されるマルチサブユニットタンパク質複合体です。これらのサブユニットは、心臓13の正常な電気的機能をサポートするために不可欠であるとの間の補助サブユニットの完全な補完は、原形質膜での機能のCa V 1.2チャネルおよび動的な相互作用を生成するのに必要とされることに注意してください。カルシウムV SSは、非共有結合ナノモル疎水性相互作用14を介してのCa V 1.2チャネルの細胞表面発現を促進します。 Ca Vα2δ1サブユニットのwiの共発現カルシウムのV th の SS結合のCa Vα1がピーク電流の式(5から10倍)を刺激し、より負の電圧でチャネルの活性化を促進します。孔形成サブユニットのCa V 1.2の機能獲得型変異はL型Ca V 1.2チャネルを形成する3つの主要なサブユニットにおける点突然変異のホストに対し、QT延長症候群15と呼ばれる心室性不整脈の形と関連しています短いQT延長症候群のフォーム16,17の不整脈を患っている被験者において同定されています。イオンチャネルは、生化学的観点(タンパク質化学)から調査またはこれらの相補的なアプローチを使用して、しばしば電気ツール(電流生成機)を用いてすることができる膜タンパク質です。電気生理学は、特定の全細胞パッチクランプで、イオンチャネル15の機能を解明するための適切なアプローチであるが、それらの生物物理学的変化からタンパク質輸送における改変を解決することはできませんプロパティ。タンパク質化学は、しかし、多くの場合、小さい可溶性タンパク質に比べて大きな膜タンパク質の比較的低い発現に使用が制限されています。蛍光読み取りを使用して堅牢なハイスループット法は、具体的には、イオンチャネルの細胞表面発現の変化を引き起こすタンパク質生合成の欠陥に対処するために開発される必要があります。
フローサイトメトリー細胞計数、ソート、バイオマーカー検出、およびタンパク質工学18に用いられる生物物理学的技術です。生細胞または粒子の試料溶液をフローサイトメータに注入されると、細胞は、マシンの検出システム( 図1)でプローブすることができる単一のストリームに順序付けされます。 1956年19で生産楽器サイトメーター最初の流れはパラメータを1つだけ検出されたが、近代的なフローサイトメーターは、30以上の蛍光パラメータ20,21の検出を可能にする複数のレーザと蛍光検出器を持っています。フィルタやミラー(発光系)は、その強度に比例して光を変換する電子ネットワーク(フォトダイオードおよび検出器)への細胞の光散乱や蛍光光を向けます。デジタルデータは、専用のソフトウェアを用いて分析され、一次出力はドットプロット21として表示されます。
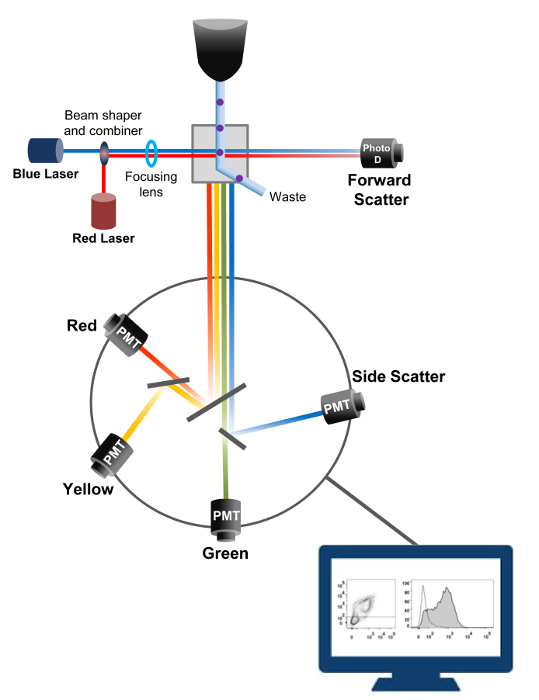
図1:ソーティングフローサイトメトリーの生物物理学的原理単セルは、1つまたは複数のレーザインタロゲーションポイント間にそれらを移動させるシース流体の流れ内の高圧下でノズルを介して押し出されます。光ビームが通過する細胞によって偏向され、順方向(前方散乱、FCS)に集められた光は、セルの大きさに比例した信号に光を変換するフォトダイオードに送信されます。光もレーザー経路に対して90°の角度で収集され、検出器(とも呼ばれる光電子増倍管(PMT))に送信されます。励起された蛍光色素が細胞内に存在する場合、この光は、細胞内の粒度を反映した側方散乱信号(SSC)の検出を可能にダイクロイックミラー、および蛍光発光を介してルーティングされます。 3つの検出器(緑、黄、赤)は、異なる蛍光色素の同時検出を可能にする、異なる波長帯域フィルタで表現されています。異なる信号が外部のコンピュータによってデジタル化し、細胞の特性を定量化するために分析されるデータに変換されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
フローサイトメーターの高スループット能力は、組換え野生型およびトラフィッキング欠損電位依存性L型Ca V 1.2チャネルおよび生細胞内の関連するサブユニットの相対的な膜発現を定量するために利用されました。 cDNAを共同構築しますタンパク質のための鼎は、二重に同時に不透過性の蛍光標識抗体および構成的に蛍光性である細胞内の蛍光団によって検出することができる細胞外非蛍光エピトープを運ぶためにタグ付けされました。 C末端の後に挿入されたタンパク質の細胞外ループに挿入され、細胞外エピトープ、および細胞内の蛍光団、両方は、タンパク質と翻訳されます。この一連の実験では、カルシウムのVα2δ1タンパク質は、内因性の細胞内の蛍光団として抗HAおよびmCherryをを抱合外ヘマグルチニン(HA)エピトープ不透過性のFITC(フルオレセインイソチオシアネート)によって検出された(YPYDVPDYA)を発現するように操作されました。 mCherryを、カルシウムのVα2δ1HAタグ化タンパク質の相対的な細胞表面発現のレベルを決定するために、融合タンパク質を発現する組換え細胞は、トランスフェクション後に回収し、そしてFITC結合マウスモノクローナル抗HAエピトープタグ不格好なやつで染色しましたY( 図2)。 FITCは、したがって、生物学的機能を妨害する可能性が低い酵素レポーターよりもかなり小さく、有機蛍光化合物です。 TSA-201cellsで過剰発現mCherry-のCa Vα2δ1-HAは、2次元プロット22上のFITC蛍光とmCherryを蛍光における有意な3-ログ増加をもたらします。 HAエピトープは、タンパク質の細胞外部分に位置していることを考えると、無傷細胞の存在下で得られたFITC用の蛍光強度は、HAタグ化タンパク質の細胞表面発現の相対的な指標を反映します。構築物中のHAエピトープのアクセシビリティが体系的細胞透過後のFITCシグナルを測定することによって検証されます。 FITCの相対蛍光強度は、透過性細胞で推定するので、この測定値はまた、正規化された全タンパク質の発現を確証するのに役立つFO相対蛍光値と定性的に同等ですR mCherryを透過処理し、非透過性の条件22,23の下で測定しました。固有の蛍光スペクトルを透過処理した後、より高い値にシフトしていることが、対照構築物と比較して報告されている唯一の値は、蛍光強度の変化があることに注意することが重要です。テスト構築物について蛍光強度の相対的変化は、各蛍光団(mCherryをまたはFITC)のためΔMean蛍光強度(ΔMFI)の値を用いて推定しています。実験は、フルオロフォア結合抗体の固有の蛍光の実験変動を制限するために、同一条件下で発現コントロール構築物の蛍光強度を試験構築物の相対的な蛍光強度を測定するように設計されています。二つの膜タンパク質は、正常にこのアッセイを用いて検討した:L型電位依存性カルシウムチャネルのCa V 1.2 14,22との異なるシリーズでの孔形成サブユニット実験では、α2δ1サブユニット22,23外補助のCa V。以下のプロトコルは、制御条件下でイオンチャネルの翻訳後修飾に影響を与える変異後の心臓L型Ca V 1.2チャネルのカルシウムのVα2δ1サブユニットの細胞表面発現を測定しました。標準化された実験条件下で、FITCの細胞表面蛍光はmCherryを、カルシウムVα2δ1-HAタンパク質(参考文献22の図5)をコードするcDNAの発現に準線形的に増加します。
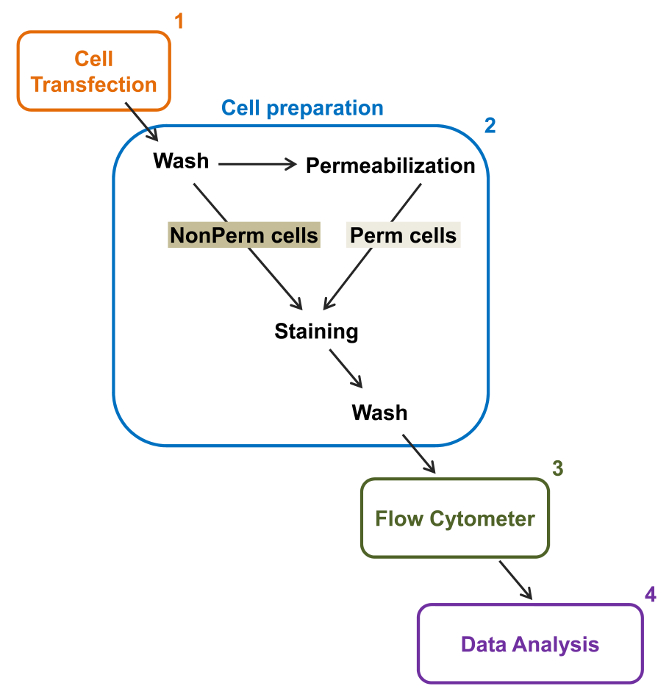
図2:実験プロトコルフローサイトメトリーでの合計と、膜の標識の概略図スキームがFLにより、組換えイオンチャネルの相対的な合計と細胞表面発現を定量化するために必要な主な手順のいくつかを概説します。OWサイトメトリー。細胞を、(2)TSA-201細胞(1)で二重タグ付き構築mCherryを、カルシウムのVα2δ1-HAでトランスフェクトし、透過処理の前または後に染色されます。マルチパラメータデータを多変量解析するためのフローサイトメーター(3)で取得している(4)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
Protocol
Representative Results
Discussion
このフローサイトメトリーベースのアッセイを首尾よく蛍光標識された孔形成および電位依存性カルシウムチャネル14,22,26の、関連するサブユニットの相対的な合計と細胞表面レベルの測定に適用しました。これは、遺伝子変異の影響を調べる際に最良に使用され、このように標識された蛍光タグ付けされた野生型構築物の固有の蛍光強度は、蛍光標識されたタグなし構築物の蛍光強…
Declarações
The authors have nothing to disclose.
Acknowledgements
We thank Mr. Serge Sénéchal and Dr. Jacques Thibodeau for sharing their expertise and granting us access to their flow cytometry and cell sorting platform. This work was completed with the operating grant 130256 from the Canadian Institutes of Health Research, a grant-in-aid from the Canadian Heart and Stroke Foundation, and support from the “Fondation de l’Institut de Cardiologie de Montréal” to L.P.
Materials
| Q5 Site-Directed Mutagenesis Kit | New England Biolabs | E0554S | Can be substitute with QuickChange site-directed mutagenesis Kit (Agilent, #200523). |
| Tubes 1,5 mL | Sarstedt | 72-690-001 | |
| Tubes 15 mL | Sarstedt | 62-554-002 | |
| Disposable graduated Tranfer Pipets | VWR | 160001-192 | |
| 100-mm culture dish | Corning | 430167 | For standard culture of HEKT cells. |
| 35-mm culture dish | Falcon | 353001 | For standard culture of HEKT cells. |
| Serological pipette 1 ml | Sarstedt | 86.1251.001 | |
| Serological pipette 5 ml | Sarstedt | 86.1253.001 | |
| Serological pipette 10 ml | Sarstedt | 86.1254.001 | |
| Serological pipette 25ml | Sarstedt | 86.1285.001 | |
| Dulbecco's high-glucose medium | Life Technologies | 12100-046 | Warm in 37°C water bath before use. |
| Fetal Bovine Serum, qualified, heat inactivated, US origin | Life Technologies | 16140-071 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140-122 | |
| Lipofectamine 2000 | Life Technologies | 11668-019 | For liposomal transfection. Can be substituted with calcium phosphate transfection. |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 31985-070 | Warm in 37°C water bath before use. |
| Trypsin-EDTA (1X) 0.05%, phenol red | Life Technologies | 25300-062 | |
| 1.5 mL microtubes | Sarstedt | 72.690.001 | |
| Phosphate Buffered Saline 1X | Fisher | BP661-10 | Can be "home-made". |
| Anti-HA FITC conjugated antibody | Sigma | H7411 | |
| IgG1−FITC Isotype Control antibody | Sigma | F6397 | |
| BD Cytofix/Cytoperm Fixation/Permeabilization Solution Kit | BD Biosciences | 554714 | Fixation/Permeabilization. Permeabilization/Wash solution, store at 4 °C. |
| Hemacytometer | Fisher | 49105161 | |
| Trypan Blue | Fisher | 15250061 | To access cell viability. |
| Refrigerated Microcentrifuge, 5430R | Eppendorf | A14H172200 | |
| Forma Steri-Cycle CO2 Incubator | Fisher | 370 | |
| Laboratory Platform Rocker | Fisher | 545034 | |
| Water Bath | VWR | 89032-216 | |
| BD FACSARIA III | BD Biosciences | 648282 | Flow cytometer. |
| FlowJo Software v10 | FlowJo | FlowJo v10 Dongle | For data analysis. |
Referências
- Delisle, B. P., Anson, B. D., Rajamani, S., January, C. T. Biology of Cardiac Arrhythmias: Ion Channel Protein Trafficking. Circ. Res. 94, 1418-1428 (2004).
- Birault, V., Solari, R., Hanrahan, J., Thomas, D. Y. Correctors of the basic trafficking defect of the mutant F508del-CFTR that causes cystic fibrosis. Curr Opin Chem Biol. 17, 353-360 (2013).
- Balijepalli, S. Y., Anderson, C. L., Lin, E. C., January, C. T. Rescue of Mutated Cardiac Ion Channels in Inherited Arrhythmia Syndromes. J. Cardiovas Pharm. 56, 113-122 (2010).
- Gargus, J. J. Unraveling Monogenic Channelopathies and Their Implications for Complex Polygenic Disease. Am. J. Hum. Genet. 72, 785-803 (2003).
- Abriel, H., Zaklyazminskaya, E. V. Cardiac channelopathies: Genetic and molecular mechanisms. Gene. 517, 1-11 (2013).
- Behr, E. R., et al. Sudden arrhythmic death syndrome: familial evaluation identifies inheritable heart disease in the majority of families. Eur Heart J. 29, 1670-1680 (2008).
- Catterall, W. A. Structure and regulation of voltage-gated Ca2+ channels. Annu. Rev. Cell Dev.Biol. 16, 521-555 (2000).
- Peterson, B. Z., DeMaria, C. D., Adelman, J. P., Yue, D. T. Calmodulin is the Ca2+ sensor for Ca2+ -dependent inactivation of L- type calcium channels. Neuron. 22, 549-558 (1999).
- Dolphin, A. C. Calcium channel diversity: multiple roles of calcium channel subunits. Curr.Opin.Neurobiol. 19, 237-244 (2009).
- Dai, S., Hall, D. D., Hell, J. W. Supramolecular assemblies and localized regulation of voltage-gated ion channels. Physiol Rev. 89, 411-452 (2009).
- Gao, T., et al. Identification and subcellular localization of the subunits of L-type calcium channels and adenylyl cyclase in cardiac myocytes. J. Biol. Chem. 272, 19401-19407 (1997).
- Carl, S. L., et al. Immunolocalization of sarcolemmal dihydropyridine receptor and sarcoplasmic reticular triadin and ryanodine receptor in rabbit ventricle and atrium. J. Cell Biol. 129, 673-682 (1995).
- Abriel, H., Rougier, J. S., Jalife, J. Ion Channel Macromolecular Complexes in Cardiomyocytes: Roles in Sudden Cardiac Death. Circ. Res. 116, 1971-1988 (2015).
- Bourdin, B., et al. Molecular Determinants of the Cavb-induced Plasma Membrane Targeting of the Cav1.2 Channel. J. Biol. Chem. 285, 22853-22863 (2010).
- Raybaud, A., et al. The Role of the GX9GX3G Motif in the Gating of High Voltage-activated Calcium Channels. J. Biol. Chem. 281, 39424-39436 (2006).
- Burashnikov, E., et al. Mutations in the cardiac L-type calcium channel associated with inherited J-wave syndromes and sudden cardiac death. Heart Rhythm. 7, 1872-1882 (2010).
- Hennessey, J. A., et al. A CACNA1C Variant Associated with Reduced Voltage-Dependent Inactivation, Increased Cav1.2 Channel Window Current, and Arrhythmogenesis. PLoS ONE. 9, e106982 (2014).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Graham, M. D. The Coulter Principle: Foundation of an Industry. J. Lab. Autom. 8, 72-81 (2003).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243, 77-97 (2000).
- Rothe, G., Sack, U., Tarnok, A., Rothe, G. . Cellular Diagnostics. Basics, Methods and Clinical Applications of Flow Cytometry. , 53-88 (2009).
- Bourdin, B., et al. Functional Characterization of Cavalpha2delta Mutations Associated with Sudden Cardiac Death. J. Biol. Chem. 290, 2854-2869 (2015).
- Tetreault, M. P., et al. Identification of glycosylation sites essential for surface expression of the Cavalpha2delta1 subunit and modulation of the cardiac Cav1.2 channel activity. J. Biol. Chem. 291, 4826-4843 (2016).
- Senatore, A., Boone, A. N., Spafford, J. D. Optimized Transfection Strategy for Expression and Electrophysiological Recording of Recombinant Voltage-Gated Ion Channels in HEK-293T Cells. J Vis Exp. (47), (2011).
- Herzenberg, L. A., Tung, J., Moore, W. A., Herzenberg, L. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat.Immunol. 7, 681-685 (2006).
- Shakeri, B., Bourdin, B., Demers-Giroux, P. O., Sauve, R., Parent, L. A quartet of Leucine residues in the Guanylate Kinase domain of Cavbeta determines the plasma membrane density of the Cav2.3 channel. J Biol Chem. 287, 32835-32847 (2012).
- Morton, R. A., Baptista-Hon, D. T., Hales, T. G., Lovinger, D. M. Agonist- and antagonist-induced up-regulation of surface 5-HT3A receptors. Br. J. Pharmacol. 172, 4066-4077 (2015).
- Hoffmann, C., et al. Fluorescent labeling of tetracysteine-tagged proteins in intact cells. Nat. Protocols. 5, 1666-1677 (2010).
- Cockcroft, C. J., Gamper, N. . Ion Channels: Methods and Protocols. , 233-241 (2013).
- Gonzalez-Gutierrez, G., Miranda-Laferte, E., Neely, A., Hidalgo, P. The Src Homology 3 Domain of the beta-Subunit of Voltage-gated Calcium Channels Promotes Endocytosis via Dynamin Interaction. J. Biol.Chem. 282, 2156-2162 (2007).
- Galizzi, J. P., Borsotto, M., Barhanin, J., Fosset, M., Lazdunski, M. Characterization and photoaffinity labeling of receptor sites for the Calcium channel inhibitors d-cis-diltiazem, (+/-)-bepridil, desmethoxyverapamil, and (+)-PN 200-110 in skeletal muscle transverse tubule membranes. J. Biol.Chem. 261, 1393-1397 (1986).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiol.Rev. 80, 555-592 (2000).
- Sigworth, F. J. The variance of sodium current fluctuations at the node of Ranvier. J Physiol. 307, 97-129 (1980).
- Bailey, M. A., Grabe, M., Devor, D. C. Characterization of the PCMBS-dependent modification of KCa3.1 channel gating. J. Gen. Physiol. 136, 367-387 (2010).
- Fletcher, P. A., Scriven, D. R., Schulson, M. N., Moore, E. D. Multi-Image Colocalization and Its Statistical Significance. Biophys. J. 99, 1996-2005 (2010).
- Lizotte, E., Tremblay, A., Allen, B. G., Fiset, C. Isolation and characterization of subcellular protein fractions from mouse heart. Anal. Biochem. 345, 47-54 (2005).
- Mattheyses, A. L., Simon, S. M., Rappoport, J. Z. Imaging with total internal reflection fluorescence microscopy for the cell biologist. J. Cell Sci. 123, 3621-3628 (2010).
- Yamamura, H., Suzuki, Y., Imaizumi, Y. New light on ion channel imaging by total internal reflection fluorescence (TIRF) microscopy. J. Pharmacol. Sci. 128, 1-7 (2015).
- Wible, B. A., et al. HERG-Lite-R: A novel comprehensive high-throughput screen for drug-induced hERG risk. J. Pharmacol. Toxicol. Methods. 52, 136-145 (2005).
- Wilde, A. A. M., Brugada, R. Phenotypical Manifestations of Mutations in the Genes Encoding Subunits of the Cardiac Sodium Channel. Circ. Res. 108, 884-887 (2011).
- Milano, A., et al. Sudden Cardiac Arrest and Rare Genetic Variants in the Community. Circ Cardiovasc Genet. , (2016).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nat. Meth. 9, 152-158 (2012).

